村上定瞭(水浄化フォーラム)
Features of SARS-CoV-2 and Mechanism of mRNA vaccine
目次
1.ウイルスのゲノム
2.生物のウイルス感染への防御機構
3.mRNAワクチンの作用機構と製造法
4.まとめ
関連ページ
ウイルスの概要
新型コロナウイルス感染者の自宅介護(事例)

K. Karikó博士
NHK: https://www3.nhk.or.jp/news/special/coronavirus/world-situation/detail/hungary.html
新型コロナウイルスによる発症と重症化を防ぐ切り札と期待されるワクチンの1つ「mRNAワクチン」に欠かせない基礎技術(図10参照)を開発した女性科学者、K. Karikó博士(ハンガリー出身)がノーベル賞候補として世界的に注目されている。なお、2020年のノーベル化学賞は、「ゲノム編集の新たな手法」*)を開発した2人の女性科学者、マックスプランク研究所の E. Charpetier教授とカリフォルニア大バークレー校の J. A. Doudna教授に授与された。
彼女らの研究対象は、いずれも、生命の遺伝情報(以下、ゲノム)の発現に関わるものである。本ブログでは、ゲノムの視点に立って、ウイルスの特徴とヒトの免疫システムの関係から、mRNAワクチンの仕組みについて述べる。執筆者は医療関係者ではないので、ウイルス感染の予防・症状・診断・治療に関する内容は記載していないので、留意されたい。
なお、新型コロナウイルス感染症(正式名:COVID-19、coronavirus disease 2019)は病名で、新型コロナウイルス(正式名:SARS-CoV-2、severe acute respiratory syndrome coronavirus 2)はその病気の原因となるウイルス名である。
本ページでは、多数の図・イラストを引用している。原著をリンクしてあるので、参考とされたい。
*) ウイルスに対する細菌の獲得免疫の機能を発展させた技術。
1.ウイルスのゲノム
1.1 遺伝情報とセントラルドグマ
地球上の全ての生物(細菌、菌類、動物、植物)は、セントラルドグマ(central dogma、以下、ドグマと略称)というゲノム(genome)の発現によって、自己の命を維持し、子孫へと命をつないでいる。
このドグマとは、「DNA →(転写)→ mRNA →(翻訳)→ タンパク質」の順に伝達されるという概念である。タンパク質はその生物の構造あるいは酵素などとして生命現象の発現に利用されている。
一方、ウイルスはゲノムを有しているが、ドグマを有していないので、宿主となる生物細胞内に自己のゲノムを送り込み、宿主のドグマ(ゲノムやタンパク質の材料となるヌクレオチドやアミノ酸も含めて)を利用して、自己の子孫を多数に複製(増殖)する。このため、生物とは言われていない。
1.2 ウイルスのゲノムと増殖
ウイルスのゲノムは、一般的には、DNAまたはRNAとして保存されている。このゲノムには、(1) 自己を複製する酵素、(2) 宿主細胞に吸着・侵入する酵素、(3) 宿主の持つ免疫機構から逃避する酵素などをコードしている。これらの (1)~(3) の特徴は、ウイルス感染とその対策にとって、極めて重要な知見である。
ウイルスゲノムの種類によって、次の(A)~(C)に示すように増殖の仕組みが異なる。
(A) DNAウイルスは、そのゲノムDNA(gDNA)を鋳型として、RNAポリメラーゼによってmRNAを合成し、そのmRNAからタンパク質を合成・増殖する。
(B) RNAウイルスには、(1) ゲノムRNA(gRNA)からDNAを介さずに宿主ドグマを利用して増殖するものと、(2) gRNAをいったん逆転写酵素によってDNAへ変換し、そのDNAから宿主ドグマを利用して増殖するものに分けられる。(2)を特にレトロウイルスという。
(C) gRNAは、さらに、2本鎖RNA(dsRNA)および1本鎖RNA((±)ssRNA)に分けられる。(a) (+)ssRNAでは、ゲノムRNAがmRNAとして機能し、そのまま宿主ドグマにより翻訳されて、増殖する。(b) (-)ssRNAでは、RNAポリメラーゼにより、相補的な配列である(+)ssRNAへ変換され、これがmRNAとして宿主ドグマに組み込まれて増殖する。
1.3 新型コロナウイルスの構造とゲノム
(A) 構造
一般に、ウイルス粒子の構造を見ると、ゲノムをカプシド(capsid, C)というタンパク質(protein)の殻で包んでおり、そのゲノムを保護している。さらに、ウイルスの種類によっては、Cの外側をエンベロープ(envelope, Env)という脂質2重膜(membrane, M)で覆っている。
SARS-CoV/SARS-CoV-2の粒子構造を図1に示す。これらのウイルス粒子の直径は約100-200nmで、粒子表面はEnvで覆われている。粒子の構造タンパク質は4種類あり、スパイク(spike、S)、エンベロープ(E)、膜(M)、ヌクレオカプシド(nucleo-capsid、N)と呼ばれるタンパク質である。
S-タンパク質は、宿主細胞に結合して侵入する機能を有する。E-タンパクは、複製ウイルス粒子の形成や出芽(宿主細胞からの放出)に関与している。N-タンパク質は、gRNAを取り囲んでいる。M-タンパク質は、Envの各部位をまとめ、膜に存在する各タンパク質同士の位置を調節している。
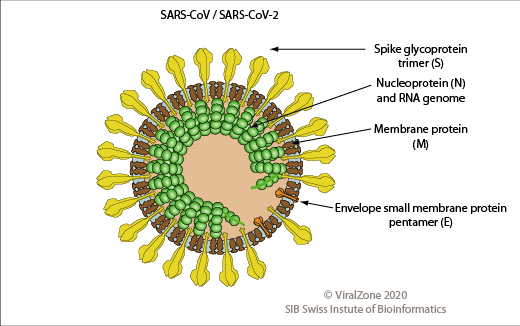
図1 SARS-Cov 2の粒子構造
ViralZone, 2020: https://viralzone.expasy.org/764
(B) ゲノム配列
新型ウイルスのゲノム配列を図2に示す。gRNAは(+)ssRNA型である。そのgRNAは約3万塩基を有し、RNAウイルスの中でも最長といわれる。
SARS-CoV-2の分離株の配列分析は、30kbのゲノムが14個のオープンリーディングフレーム(open-reading frames, ORFs)から構成されていることを示唆している。
ORF1aとORF1bはポリタンパク質(polyproteins)をコードしており、それぞれ、宿主リボソームにより翻訳された大きなアミノ酸配列は、自己タンパク質のプロセシング(processing、小さな成分に切断)により、16個の非構造タンパク質(non-structural proteins、NSP1~NSP16)となる。これらの非構造タンパク質は、次のようなレプリカーゼ-転写酵素複合体(replicase-transcriptase complex)を形成する。
パパイン様プロテアーゼ(papain-like protease, NSP3)、主要プロテアーゼ(main protease、NSP5)、NSP7-NSP8プライマーゼ複合体(primase complex)、一次RNA依存性RNAポリメラーゼ(polymerase, NSP12)、ヘリカーゼ-トリホスファターゼ(helicase-triphosphatase、NSP13)、エキソリボヌクレアーゼ(exoribonuclease、NSP14)、エンドヌクレアーゼ(endonuclease、NSP15)、N7-および2’O-メチルトランスフェラーゼ(methyltransferases、NSP10 and NSP16)
ウイルスゲノムの3’末端では、9個のサブゲノムRNAsから13個の構造タンパク質に係るORFsが見られる。これらのORFsは、4種類の構造タンパク質(structural proteins、SPs)、すなわち、スパイク(S)、エンベロープ(E)、膜(M))およびヌクレオ(N)に対応しており、さらに、これらのタンパク質に係る9つのアクセサリー因子をコードしている。
16種の非構造タンパク質(NSPs)と4種の構造タンパク質をコードしているSARS-CoV-2のゲノムは、SARS-CoVのゲノム構造と非常に類似している。
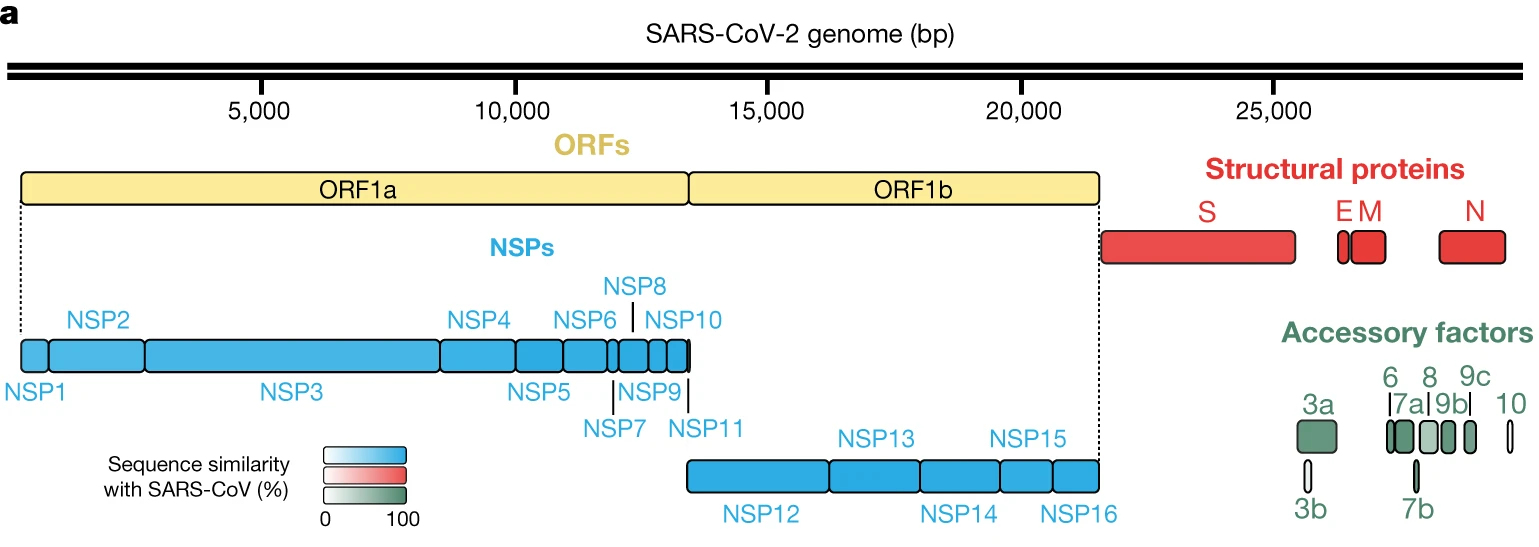
図2 Sars-Cov 2のゲノム配列
E. Dvid et al.: Nature, Vol. 583, pp.459–468 (2020).
https://www.nature.com/articles/s41586-020-2286-9
1.4 新型コロナウイルスの細胞への侵入
ウイルス膜上に隆起しているS-タンパク質がヒト細胞表面にある少なくとも1種類のタンパク質、アンジオテンシン変換酵素2(ACE2)、と結合する。この結合の後、他のタンパク質を分割、切断または刺激するヒトの酵素であるプロテアーゼ(TMPRSS2)は、S-タンパク質外側の切片(S1)を取り除き、内側の切片(S2)を露出させる。S-タンパク質のS2切片はウイルス膜とヒト細胞膜を融合させ、ウイルスの遺伝情報を細胞内に送り込む(田口・松山:ウイルス, Vol.59, pp.215-222, 2009、参照)。
図3 SARS-CoV-2のゲノムのヒト細胞内への侵入機構
The University of Tokyo, ARTICLES, March 23, 2020.
https://www.u-tokyo.ac.jp/focus/en/articles/z0508_00083.html
<解説>
下記のACE2とTMPRSS2については、現在、多くのwebsiteで論文・記事が掲載されているので、参照されたい。
(A) ACE2
ACE2は、アンギオテンシンⅡからアンギオテンシン1-7への変換を触媒するアンギオテンシン変換酵素2(angiotensin converting enzyme 2)の略称。細胞表面に存在する。SARS-CoVとSARS-CoV-2の両方は、ACE2を細胞に感染するときのウイルス受容体として使用する。
ACE2は、呼吸器系の肺胞細胞、腸上皮細胞、内皮細胞、眼や腎臓の上皮細胞、肺胞単球細胞やマクロファージなど一部の免疫細胞、大脳皮質、脳幹などの神経系細胞などにも広く存在し、特に、血管、消化管、呼吸器、排泄系、生殖系の細胞で高い発現が確認されている。このため、SARS-CoV-2感染の約3%のケースで、免疫系の過剰反応(hyper-activation of immune system)によるサイトカインストーム(cytokine storm)が誘導され、多臓器疾患が観察されている。また、SARS-CoV-2感染患者では、嗅覚の消失、味覚の変化、運動障害、吐き気、頭痛など神経系の障害が観察されることがある。
(B) TMPRSS2
TMRSS2は、細胞表面膜に存在する膜貫通型セリンプロテアーゼ(Transmembrane serine protease 2)の略称。SARS-CoV-2のS-タンパク質は、宿主受容体に結合した後、TMPRSS2によってタンパク質分解を受けると言われている。このS-タンパク質の分解がなければ、膜融合は進行しない。
この理由は、S-ACE2結合の後で、ヒト酵素であるTMPRSS2がS-タンパク質外側の切片(S1:図4に示すように、膜表面に突き出している部分で、ACE2との結合には適しているが、嵩張っている大きなタンパク質であり、膜融合の立体的障害となる)を取り除き、内側の切片(S2:fusion peptide、融合ペプチド)を露出させ、S-タンパク質のS2切片がウイルス細胞膜とヒト細胞膜を融合させるからである。つまり、ヒトの酵素であるTMPRSS2が、外敵であるウイルスのゲノムが自己の細胞内へ侵入できるように手助けしているのである。
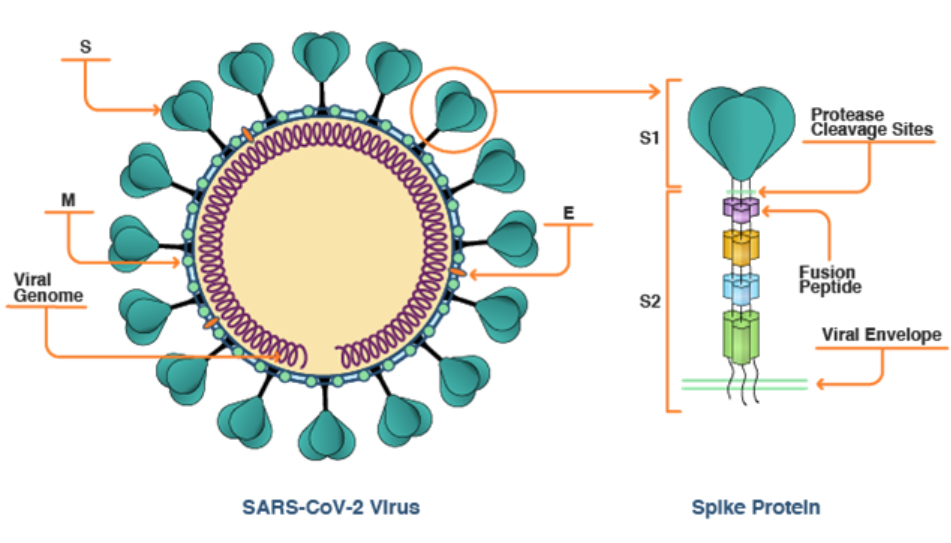
図4 S-タンパク質の構造
R. Granette: CAS, May 21,2021.
https://www.cas.org/ja/resource/blog/covid-19-spike-protein
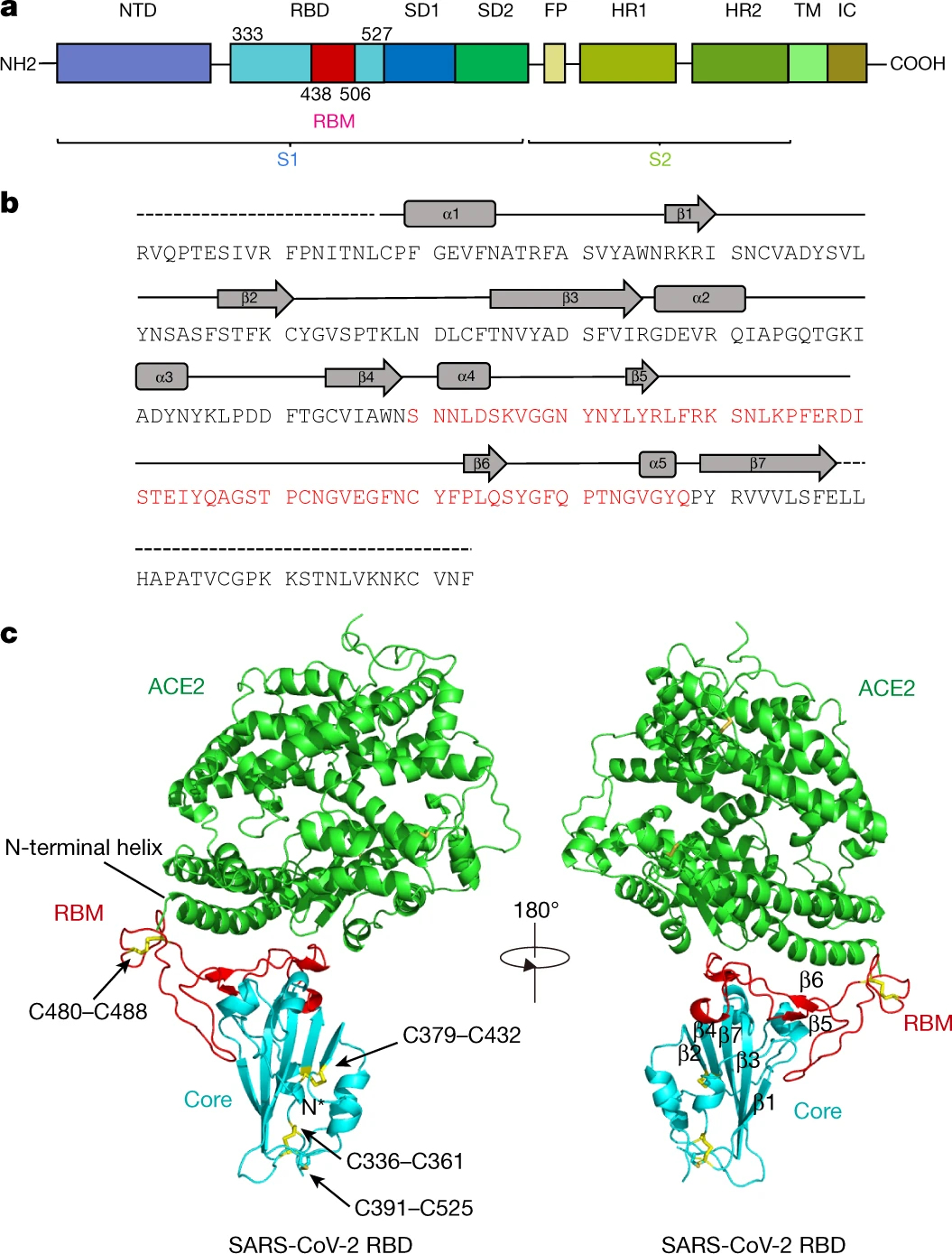
図5 S-スパイクタンパク質のアミノ酸配列とACE2とS1-RBDとの結合状態
J. Lan et al., Nature, vol. 581, pp.215–220 (2020).
https://www.nature.com/articles/s41586-020-2180-5
1.5 新型コロナウイルスの細胞内での複製
エンドサイトーシス(endocytosis)による宿主細胞内のウイルスの吸着と膜融合・コーティング解除、および細胞質へのヌクレオカプシド(nucleocapsid、NC)の細胞内への放出に続いて、ウイルス(+)ssRNAゲノムは宿主リボソームと結合して2つのポリタンパク質を生成し、その後、タンパク質分解経路でより小さな成分に切断される。
宿主および3CLpro(3-Chymotrypsin-like protease、3-キモトリプシン様プロテアーゼ)およびPLpro(パパイン様プロテアーゼ)を含むウイルス・プロテアーゼによって。RdRp(RNA-dependent RNA polymerase、RNA依存性RNAポリメラーゼ)は、ウイルスゲノムの複製、およびウイルスmRNAおよび関連するウイルスタンパク質の生成に関与している(1.3 (B)ゲノム配列を参照)。
次に、宿主細胞のERGI(endoplasmic reticulum-Golgi intermediate compartment、小胞体-ゴルジ中間区画)で、ウイルスゲノムとウイルスタンパク質が集合して新しいウイルスが形成される。
最終的に、新しいビリオン(virion、完成した構造を持ち、感染性を有するウイルス粒子)は、図6に示すエキソサイトーシス(exocytosis)を通して、細胞の外に放出される。
SARS-Cov-2に感染した細胞(培養細胞・解剖肺組織など)の顕微鏡写真を見ると、感染した一群の細胞が多核巨細胞を形成している。このウイルスは、1.4に示した機構により、ある標的細胞内に侵入すると、その周りの細胞も巻き込んで(細胞融合させて多核巨細胞を形成して)、多数のビリオンを複製した後、多核巨細胞を破壊して、一気に出芽する。このとき、破壊された巨細胞内の細胞質も溶出するので、重症化(多数の細胞が感染)するとサイトカインストームを誘発しやすいとの推定も考えられる。いずれにしても、ヒト細胞へのSARS-CoV感染状況は、一般的なウイルスの生活環-①宿主細胞への付着・侵入・脱殻、②ビリオン構成物・ゲノムの複製、③ビリオン形成と宿主細胞からの出芽-に加えて、一部には細胞破壊も想像される。
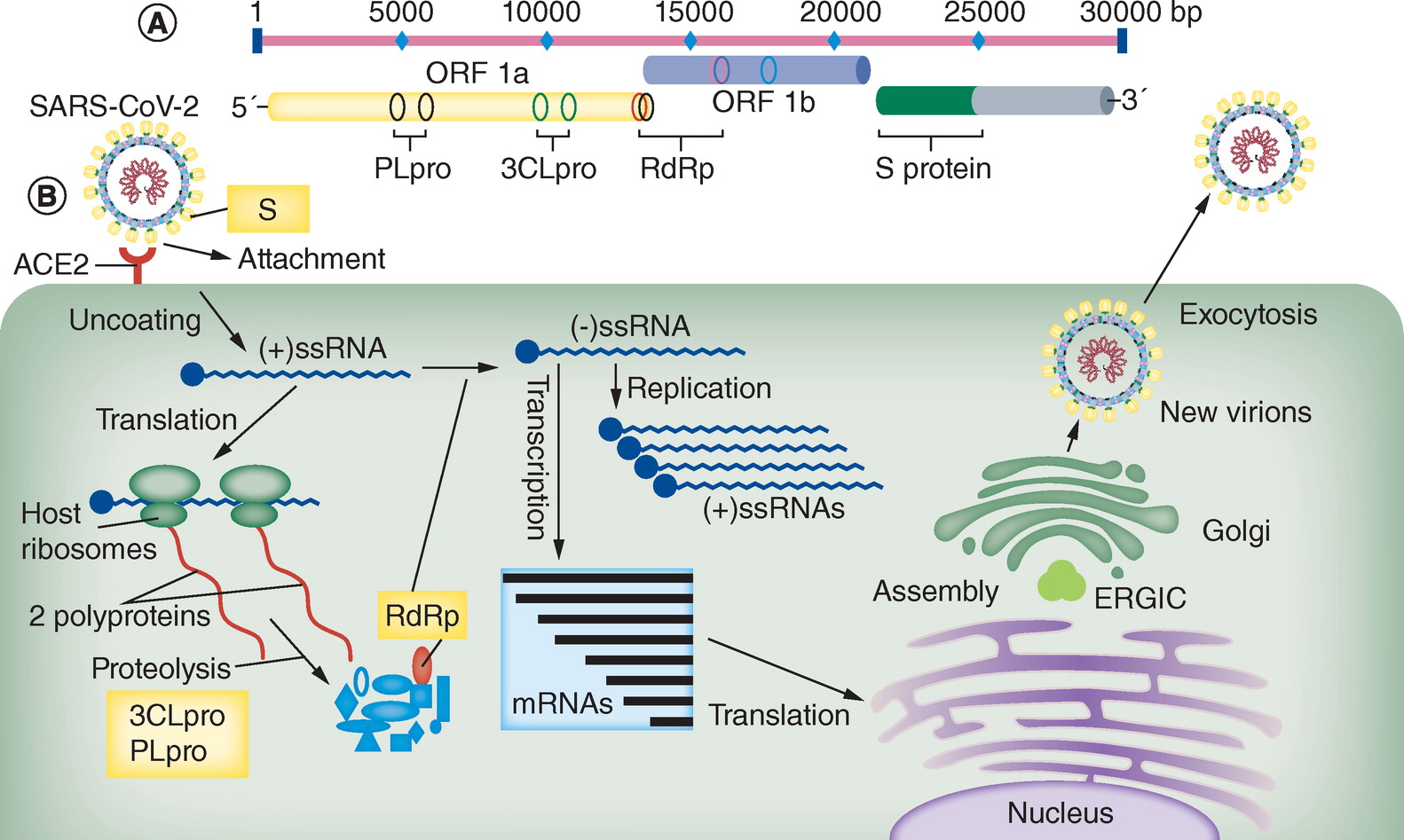
図6 SARS-Cov-2の増殖機構
R. Ghanbari, el al.: Future Microbiology, Vo.15, No.18, pp.1747-1758 (2020).
https://www.futuremedicine.com/doi/10.2217/fmb-2020-0120
2.生物のウイルス感染への防御機構
2.1 生物の防御機構
地球上の生物は、水環境の中で約40~35億前に誕生したといわれる。最初に誕生した生物(独立栄養細菌、原核生物)は、無機物質の化学反応によって生成するエネルギーを利用して、自己の維持や増殖に必要な有機物を生産していた。さらに、太陽光をエネルギー源とするシアノバクテリア(光合成細菌、原核生物)が誕生し、地球上のCO2とH2Oを原料として有機物を合成するようになった。光合成細菌の一部は進化して真核生物である藻類や植物となった。一方で、原核生物・藻類・植物(独立栄養生物)を捕食して、自己の維持や複製を行う原生動物や多細胞動物(従属栄養生物)が現れ、同時に、独立・従属栄養生物の死骸や排泄物を栄養源とする細菌も現れた。
以上述べた各種生物は生態系を形成し、食物連鎖の流れの中で、地球上の物質循環の一つとして、重要な役割を担っている。生態系の構成は、地球環境と食物連鎖の中で、生物種間のバランスが保たれている。一方で、個別の生物種(ここでは、ウイルスも含む)は環境への対応と補食・非捕食の中で、自己維持や子孫繁栄のための様々な仕組みを発達させてきた。その仕組みは、(1) 異種生物の共存、(2) 競合生物種の排除(同種内でも、縄張りをめぐって争いが起こる)、(3) 捕食の工夫、(4) 外敵への回避・防御などである。(4)の回避・防御には、保護色・逃避・毒素発生・免疫機能・集団防衛などがあり、生物種によって様々な仕組みを持っている。
ウイルスは、粒子として環境水や土壌中に膨大な数で存在しており、自己のみでは増殖できないので、原核・真核を問わず全ての生物の細胞内へ侵入して、自己増殖を行っている。ただし、個々のウイルス種の宿主細胞はそれぞれ異なっている(同種の多細胞生物においても、侵入できる細胞は特化されている)。
細菌・古細菌は、ウイルス感染に対して、次のような防衛機構を有している。
(a) ウイルス粒子の付着とそのゲノムを侵入させない細胞表面構造とする、(b) 細胞内に侵入したウイルスゲノムを分解して、自己のドグマを利用されないようにする、(c) 切り出したウイルスゲノムの一部を自己のゲノム内へ記録・保存して、次の侵入に対して速やかに対応する、(d) ウイルスに感染した細胞の自殺により、同種集団への感染拡大を防ぐ。(細菌の免疫機構を参照)
ヒトなどの哺乳動物の耐ウイルスの仕組みは複雑で、次のような防御機構がある。
(a) 表皮組織による侵入の物理的阻止機能、(b) 粘膜組織による物理的・化学的なバリヤ機能、(c) 涙・汗・消化液による排除・分解機能、(d) 自然・獲得の免疫担当細胞(放出物質も含む)によるウイルスの破壊・捕食、(e) 中和抗体のS-タンパク質への付着による細胞表面上の受容体結合の阻止、感染細胞のプログラム死の誘導、(f) 細胞内に侵入した外来ゲノムの分解とそのドグマへの組込み阻止など
一方で、ウイルスは、様々な生物に対して、それぞれの防御機能をうまく通り抜けて、細胞内への侵入と宿主ドグマの利用により、自己増殖する機能を発達させている。
<解説>自然・獲得免疫の仕組み
ヒトのウイルス・細菌などの病原体(外敵)に対する免疫の仕組みは、極めて複雑である。高校の生物学教科書、専門書籍、Websiteなどに掲載されているので、詳細説明は省き、全体像(図7)を説明する。
(A) 自然免疫
皮膚や粘膜は外敵に対して物理・化学的な防壁となるが、これを突破して外敵が侵入する。上皮細胞表面上のTLRが外敵の侵入をキャッチすると、細胞から外敵侵入を知らせる化学物質を放出する。その一方で皮膚や粘膜にいるマクロファージや樹状細胞が、それぞれの細胞が持つTLRで外敵をキャッチし、それを食べて殺す。マクロファージは特に大食で、外敵の食殺に主要な役割を担う。また、化学物質に誘発されて、好中球が集まり、外敵を食殺していく。
(B) 獲得免疫
外敵を食べた樹状細胞やマクロファージはリンパ節に移動し、そこいるリンパ球のT細胞に分解した外敵の一部(抗原)を提示する。これを受けてCD4-T細胞は活性化し、B*細胞やCD8-T細胞(細胞損傷性)に攻撃の指示をだす。B*細胞は抗体を産生し、外敵の抗原部位に取り付いて、無力化とともに、食細胞の攻撃の目印とする。CD8-T細胞は外敵の増殖・拡散を防ぐため、感染した細胞のプログラム死を誘発する。全ての外敵が駆除されると、制御性T細胞が免疫活動を終了させる。一部のB細胞は、B*細胞とはならず、メモリーB細胞として生き続け、次の外敵侵入に備えることとなる。
(C) TLR
(1) 概要
Toll様受容体(Toll-like receptor:TLRと略す)は動物の細胞表面にある受容体タンパク質で、種々の病原体を感知して自然免疫を作動させる機能がある。TLRやその他の自然免疫に関わる受容体は病原体に常に存在し、しかも、宿主にはない病原体に特異的なパターンを認識するものでなければならない。そのためにTLRは、細菌表面のリポ多糖(LPS、lipopolysaccharide)、リポタンパク質、鞭毛のフラジェリン、ウイルスの二本鎖RNA、細菌やウイルスのDNAに含まれる非メチル化CpGアイランド(宿主のCpG配列はメチル化されているので区別できる)などを認識するようにできている。TLRは、特定分子を認識するのでなく、上記のようなある一群の分子を認識するパターン認識受容体の一種である。
(2) 機能
TLRは特に哺乳動物で詳しく研究されている。TLRの機能は知られている全ての生物で似ているため、基本的には同一モデルで説明できる(ただし、昆虫では活性化の様式が異なる)。各TLRは、病原体のもつ特異的分子(または分子の特異的な組合せ)により活性化されて二量体を形成することにより機能する。
多くのTLRはホモ二量体(同種分子からなる)として働くが、TLR2はTLR1やTLR6との間でヘテロ二量体をつくり、互いに特異性が異なる。TLRは完全な機能を得るために他の補助因子が必要なこともあり、この例としてはTLR4がある。全てのLPSの認識にはMD-2が必要であり、CD14とLPS結合タンパク質(LBP)はLPSのMD-2への提示を促進することが知られている。
活性化されたTLRは、細胞内シグナル伝達経路を介して、転写因子であるIRFやNF-κBを活性化し、それぞれIFN-α/βまたは、IL-1、IL-6、IL-8(IL, interleukin)などサイトカインを誘導し、獲得免疫、あるいは炎症を誘導する。細菌は、ファゴサイトーシスで取り込まれて消化され、その抗原はヘルパーT細胞(CD4-T細胞)に呈示される。ウイルスに対しては、インターフェロン(抗ウイルス活性をもつサイトカイン)を産生する。ウイルス感染細胞はタンパク質産生を中止し、アポトーシス(apoptosis、プログラム死)に至る。
(D) IFN
(1) 概要
インターフェロン(IFN、interferon)とは、哺乳動物におけるサイトカインファミリーの一種で、当初はウイルス感染を抑制する因子として同定された。現在までに、抗ウイルス特性に加えて、病原体に対する増殖抑制・免疫調節・他の細胞活性や調整機能を有することが明らかとなっている。なお、サイトカイン(cytokine)とは、免疫・造血・炎症などに係る細胞同士が情報伝達物質として産出するIFNやILなどのタンパク質の総称であり、細胞の活性化に加えて、細胞増殖を誘発する。IFNは、タンパク質構造および受容体複合体の認識に基づき、I型(9種以上のクラスと、さらにサブクラスがある)、II型(1種)、III型(3種)に分類されている。
(2) 機能
一般に、IFN-I(I型インターフェロン)の発現は、Toll様受容体(TLR)によって誘導される。多くのウイルスやいくつかの病原体に応答して、マクロファージ・好中球・樹状細胞・他の体細胞から産生される。
自然免疫系は、TLR受容体を介して「非自己」を認識する能力を進化させてきた。例えば、TLR-3は二本鎖RNA 、TLR-4はリポ多糖、TLR-9はメチル化CpG-DNAモチーフに応答する。TLRにより活性化された細胞から産生されるIFNは、オートクラインまたはパラクライン様式で作用する。IFNが受容体に作用すると、細胞内で速やかにシグナルが伝達し、抗ウイルス状態を誘発する。IFN-Iは、シグナル伝達カスケードとして JAK1-STAT 経路を活性化する。この経路では、ウイルス感染細胞を防御する種々の遺伝子、例えば、(2′-5′)オリゴアデニル酸合成酵素、Mxタンパク質、タンパク質キナーゼR (PKR)など、の発現増加を誘導する。
複数のIFN-α/βを含めて、なぜこれほど多くの異なるIFN-Iが存在するのかは、まだ明らかにされていない。様々な研究によって、それらが重複した機能を持つとともに生物学的活性のユニークなセットを有することが示唆されており、IFN-Iは、免疫調節において重要な役割を果たしている。
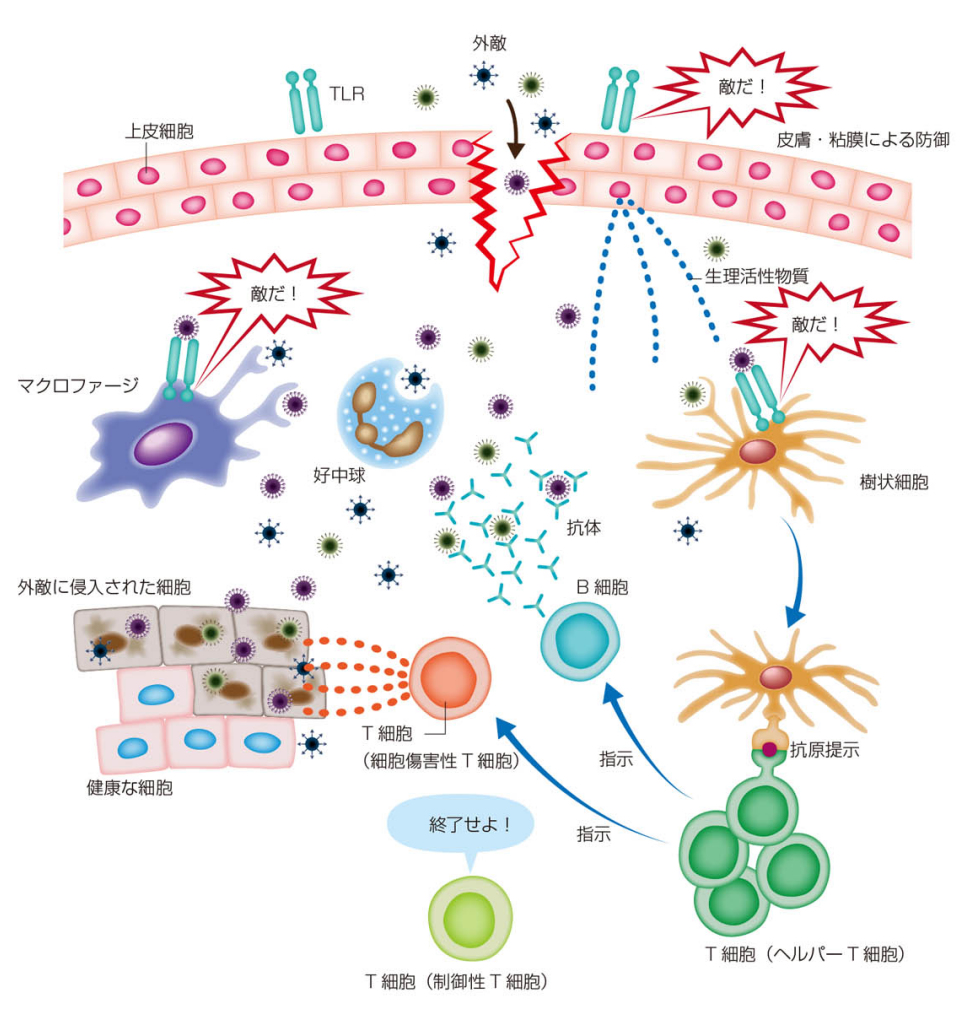
図7 免疫のしくみの全体像
松本健治:免疫学の基本、ナイナビ出版・電子版、p.21 (2018).
この書籍は、免疫に関する基礎、感染症と対策、免疫機能不全疾患などについて分かり易く図解しており、初心者の入門書として推薦する。
2.2 新型コロナウイルスのヒト防御機構の抑制
H. Xiaら(図8参照)は、宿主のIFN-I(I型インターフェロン)産生とその伝達に対して、異なるメカニズムによって阻害する 3種のタンパク質を発見し、SARS-CoV-2による IFN-I応答の回避と、ウイルス感染と病因への影響を指摘した。概要は以下のとうりである(図2および図8参照)。
非構造タンパク質-6 (nsp6)は TANK結合キナーゼ-1(TBK1)に結合してIFN調節因子-3(IRF3)のリン酸化を抑制し、nsp13はTBK1のリン酸化に結合してブロックする。非構造タンパク-6 (ORF6)は、インポーチン・カリオフェリンα2(KPNA2)に結合して、IRF3の核移行を阻害する。彼らは、シグナル伝達因子および転写1 (STAT1)/STAT2リン酸化または核転座の活性化因子をブロックすることにより、IFN-I シグナル伝達に拮抗する 2組のウイルスタンパク質を同定している。注目すべきことは、SARS-CoV-2のnsp1およびnsp6は、SARS-CoVおよびMERS-CoVと比較して、より強くIFN-Iシグナル伝達を抑制することである。
上記の各阻害タンパク質の遺伝子群は、図2に示す非構造タンパク質(nsp: non-structural protein)をコードしているオープンリーディングフレーム ORFs内に存在する。
以上述べたように、新コロナウイルはヒトの免疫機構を回避する仕組みを有している。特に、ヒトのサイトカイン機能を抑制することから、発症の有無にかかわらず(発症前から)、SARS-CoV-2の感染者は、他人への感染力を示すこととなる。
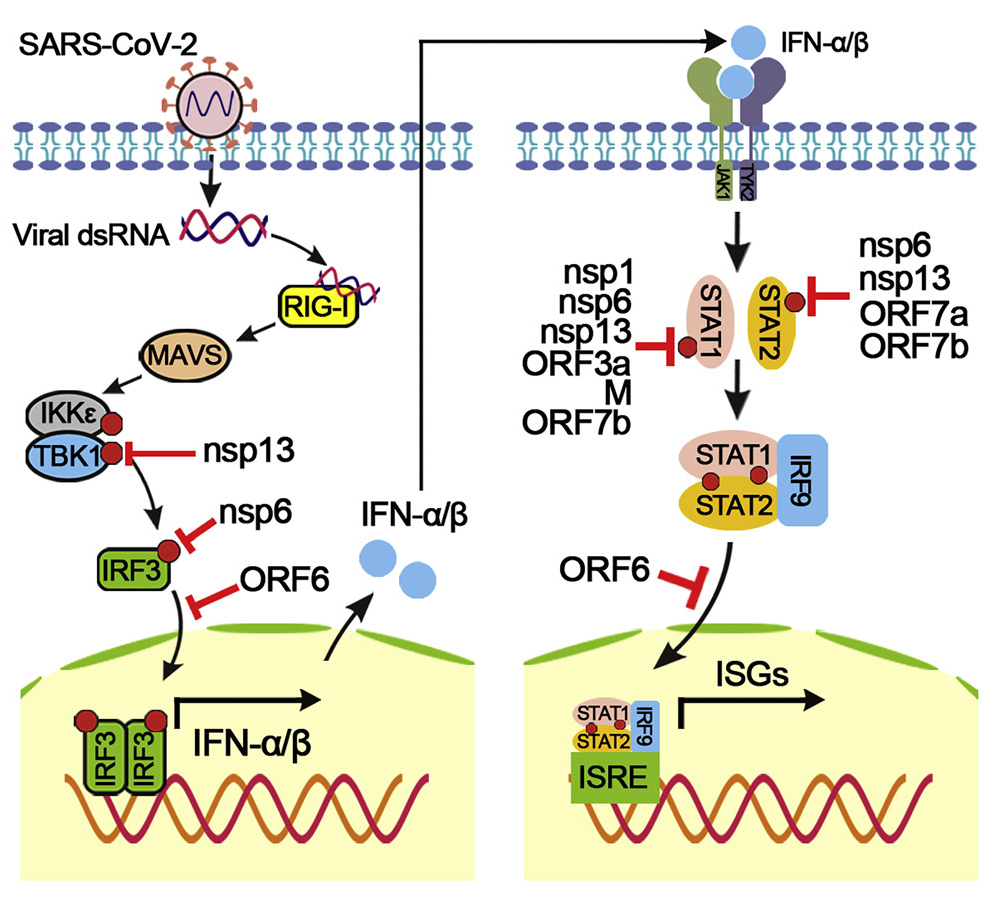
図8 SARS-CoV-2 のⅠ型インターフェロンの産生とそのシグナル伝達の抑制
H. Xia et al.: Cell Reports, Vol.33, Issue 1, 6 October 2020, 108234.
https://www.sciencedirect.com/science/article/pii/S2211124720312237
3.mRNAワクチンの作用機構と製造法
3.1 mRNAワクチンの開発と経緯
予防接種は、感染する前にワクチンを投与してその病気に対する免疫を人為的に獲得させ、感染症の発病や重症化を防ぐ方法である。
ワクチンには、病原性微生物の毒性を弱めた「生ワクチン」、病原性微生物を殺したり感染する能力を失わせる、微生物が出す毒素を取り出して毒性をなくしたり(トキソイド、toxoid)してつくった「不活化ワクチン」がある。
ところが、ワクチンは医薬品であるので、図9に示すように、その研究開発と承認・販売において、人材・設備・年月と膨大な経費を必要とする。
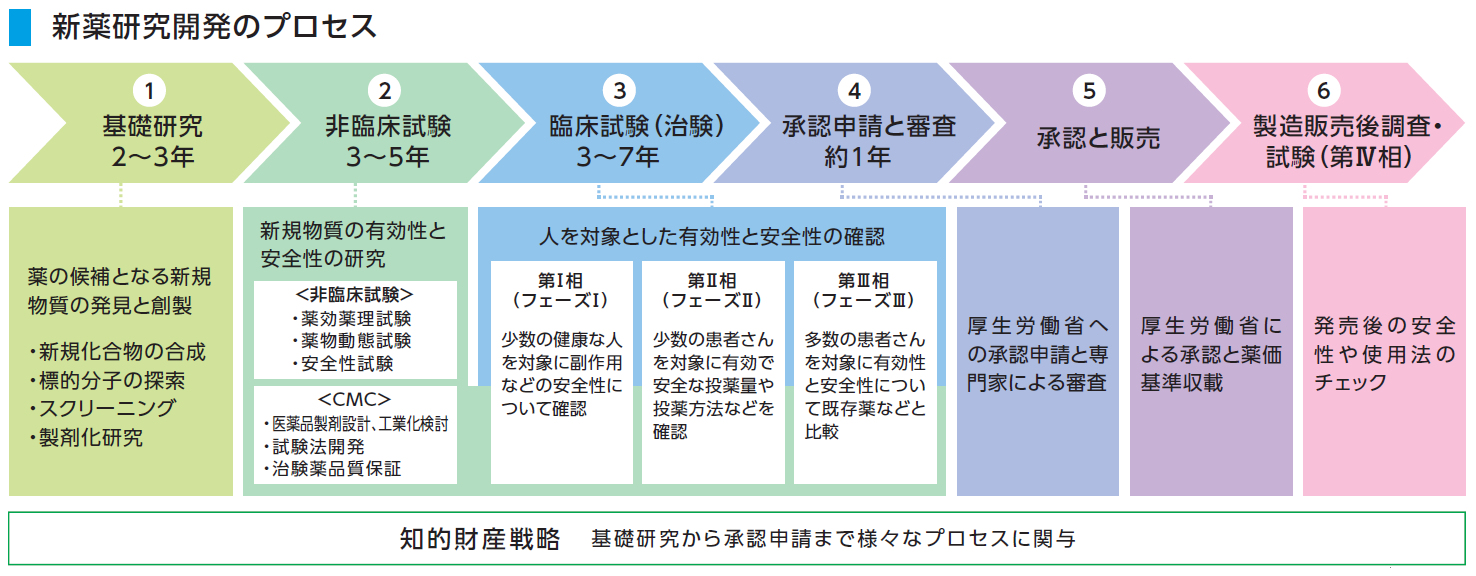
図9 新薬開発と承認・販売のプロセス
生化学工業:https://www.seikagaku.co.jp/ja/development/flow.html
新型コロナ感染症COVID-19は2019年末に中国で発生し、新型コロナウイルスSARS-CoV-2は2020年に世界全域に拡散してパンデミック病原体となった。
しかし、世界の数社がワクチンを開発して、2020年末には販売・普及を開始した。このスピード開発・販売の背景には、2003年のパンデミックとなったウイルスSARS-Cov(突然現れて、収束した)についての基礎研究のデータがあった。また、2000年前後からの生物に係る研究ツール・機器の登場も分子生物学の進展を加速している。たとえば、遺伝子編集法、遺伝子人口合成法、PCRによるDNA増幅法、DNA断片を解析する電気泳動法、塩基配列を調べる次世代シーケンサー、生物微細構造を測定するクライオ電子顕微鏡法、微量ペプチドを測定するクロマト-タンデム質量分析法など。
3.2 mRNAワクチンの特徴
従来の生ワクチンや不活化ワクチンの開発は一般に、時間とコストがかかるが、SARS-CoV-2のような伝染力の強い新規のウイルスに対しては、ワクチンの迅速な開発が要求され、現在、mRNAワクチンが注目されている。
これは、mRNAが in vitro転写により細胞のない環境で大量に生産可能であり、迅速な開発、製造プロセスの簡素化、コストパフォーマンスの高い製造が可能なことによる。
DNAワクチンと比べて、mRNAワクチンは宿主細胞の遺伝子に組み込まれることがないため、宿主ゲノムに変異のリスクがない(図12)。そして、mRNAワクチンにはウイルス粒子の情報がないため、mRNAワクチン自体が、予防対象の疾患を引き起こすこともない。さらに、mRNAワクチン接種後の抗原の発現は一過性で、体内における存続期間は限定的である。ワクチンのmRNA鎖が意図しない免疫反応を引き起こす可能性を考慮しこれを最小限に抑えるため、mRNAワクチン配列は哺乳類細胞が生産するmRNAの配列に最適化されている(下記の<解説>(A)を参照)。
これまで、遊離mRNAは体内ですぐに分解するため、目的とする効果が弱まる問題点があったが、これを回避するため、mRNAは脂質ナノ粒子に組み込んで安定化させている。このような技術の進歩によりmRNAワクチンは広範囲に利用できるようになった。
<解説>
(A) mRNAの修飾
生理学的に重要なタンパク質をコードするin vitroで転写されたmRNAは不安定で免疫原性があるため、臨床で使用することはできない。K. Karikó et al.は、2005年、塩基ウラシル(uracil, U)をシュードウリジン(pseudouridine、Ψ)と置き換えた修飾mRNA(図10A-d)は、遺伝子置換とワクチン接種の両方にとって有望なツールとなることを発表した
哺乳類細胞またはマウスに対して、Ψを含むmRNAは未修飾のmRNAよりも高い翻訳能力を持つことを示した。未修飾のmRNAは免疫原性(2.1<解説>で述べたように、非自己の外来性物質と認識される)を示し、インターフェロン-α(IFN-α)の高い血清レベルを誘導した。これらの発見は、ヌクレオシド修飾が、in vivoでの免疫原性を低下させながら、mRNAの安定性と翻訳能力を高める効果的なアプローチであることを示した。
今回開発された修飾mRNAには、図10A-d-左に示す分子式中の青丸で示す-NH-を-N(CH3)-に置換した1-メチルシュードウリジン(m1Ψ)を採用しており、①炎症反応の抑制と②抗原たんぱく質の産生増加、に対する効果を高めている。
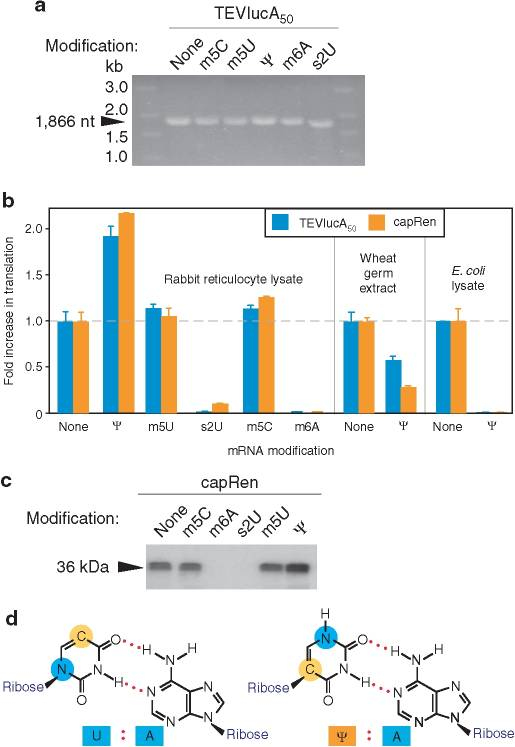
図10A mRNAの修飾とその効果
K. Karikó et al.: Mol Ther., Nov.16(11), pp.1833-1840 (2008).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2775451/
K. Karikó et al.:Immunity, Vol.23, August, pp.165-176(2005).
https://www.cell.com/action/showPdf?pii=S1074-7613%2805%2900211-6
新型コロナウイルスへのmRNAワクチンの特徴は、ウイルス表面のS-タンパク質(抗原)をコードしているmRNAをヒト細胞のセントラルドグマに組み込み、ヒト-リボソームによって抗原を産生し、これを利用して獲得免疫システムを誘発していることにある。ところが、ウイルスのS-タンパク質をコードしているRNA(図10BのORP領域、すなわち、図2の構造タンパク質S領域)をそのままヒト細胞内に導入しても、外来異物として直ちに分解されるだけである。真核細胞のドグマでは、核膜内でDNAから転写されたプレmRNAは未成熟で、①5’末端へのキャップ(Cap)の付加、②3’末端へのポリAテール(Poly-A-tail)の付加、③イントロンのスプライシングが行われ、成熟したmRNAが核膜外へ移動して、リボソームにより翻訳されてタンパク質が産生される。ウイルスの場合には、③は不要であるが、mRNAワクチンの合成には①と②が必要となることを参考までに付記する。投与ワクチンのmRNAの具体的構造は、Cap-5’UTR-ORF-3’UTR-Poly-A-tailとなっている(図10B)。ORF(open reading frame encoding antigen S-protein)は抗原となるS-タンパク質の翻訳領域。5’UTRと3’UTRは成熟mRNAの5’末端と3’末端にある非翻訳領域(untranslated region, UTR)でORFの開始コドンと終始コドンのそれぞれ上流・下流に配置される。
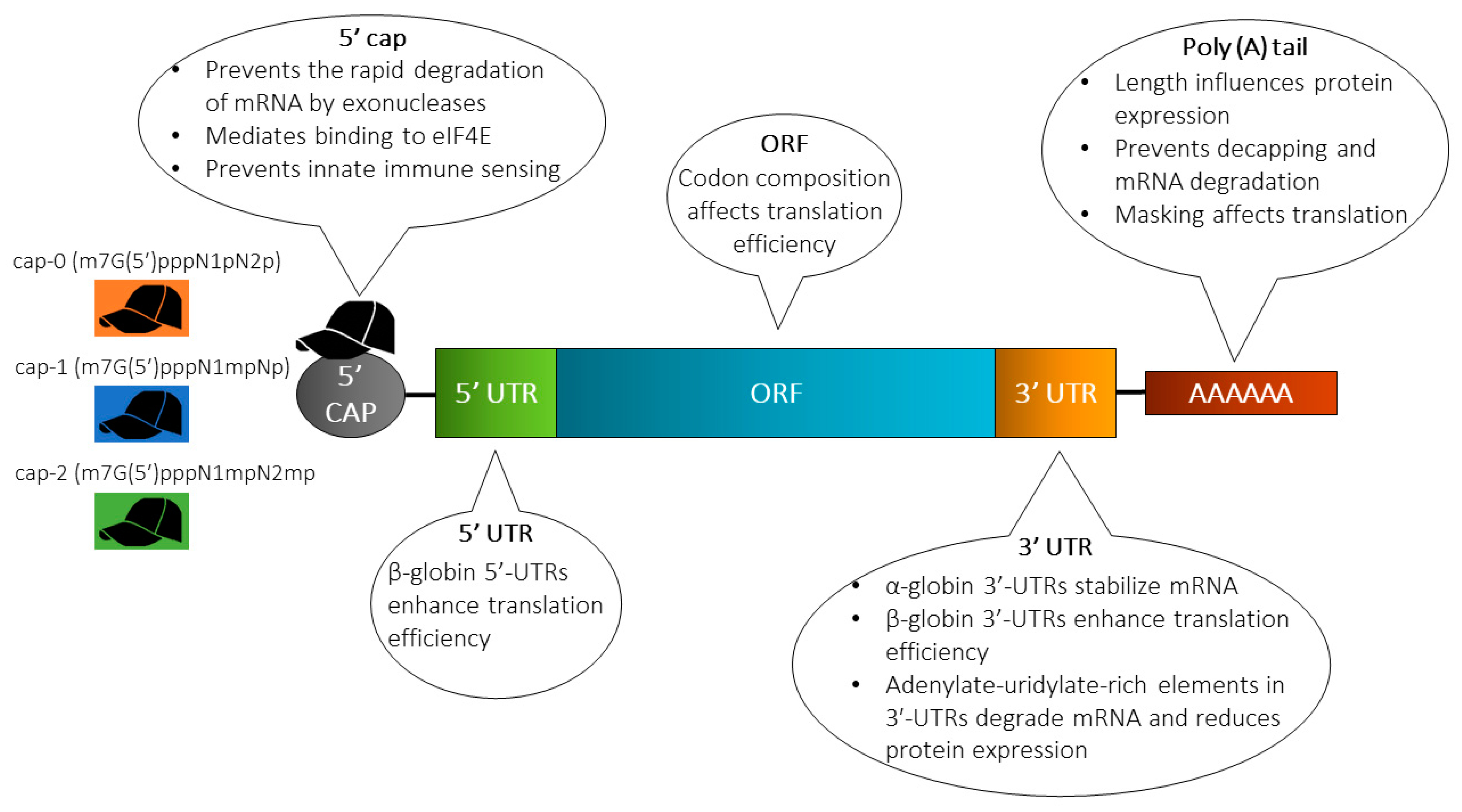
図10B 投与ワクチンのmRNAの配列構造
A. Wadhwa, et al., Pharmaceutics, Vol.12, Iss.2,102(2020).
https://www.mdpi.com/1999-4923/12/2/102
(B) 脂質ナノ粒子
近年、mRNAは多機能な治療薬として注目されており、さまざまな病気の予防や治療に役立つ可能性を持っている。現在の臨床研究は、ワクチン接種、タンパク質補充療法、および遺伝性疾患の治療などに重点が置かれている。mRNAの生産設計と細胞内送達方法の開発により、mRNA治療薬が可能となっている。ところが、mRNAは不安定で簡単に分解されるので、これを保護・送達するカプセルが必要である。脂質ナノ粒子(lipid nanoparticle、LNP)は、最も成熟したmRNAの保護・送達物質のひとつである。
LNPは、通常、次の (1)~(4) を組み合せた構成となっている。(1) ポリアニオンmRNAをカプセル化するための第3級または第4級アミンを含むイオン化可能、またはカチオン性の脂質またはポリマー材料。(2) 細胞の脂質膜に類似した両性脂質。(3) コレステロール安定化LNP脂質二重層。(4) コロイド安定性を改善するとともに、タンパク質の吸収を減少させるため、ナノ粒子に水和層を持たせるポリエチレン グリコール(PEG)と脂質。
製剤用LNPの要件として、次の(1)~(3)の事項が挙げられる。
(1) 高効率の核酸カプセル化と効率的な遺伝子導入性
(2) 治療薬を提供するための高い組織透過性
(3) 細胞毒性と免疫原性が無いまたは極めて低いこと
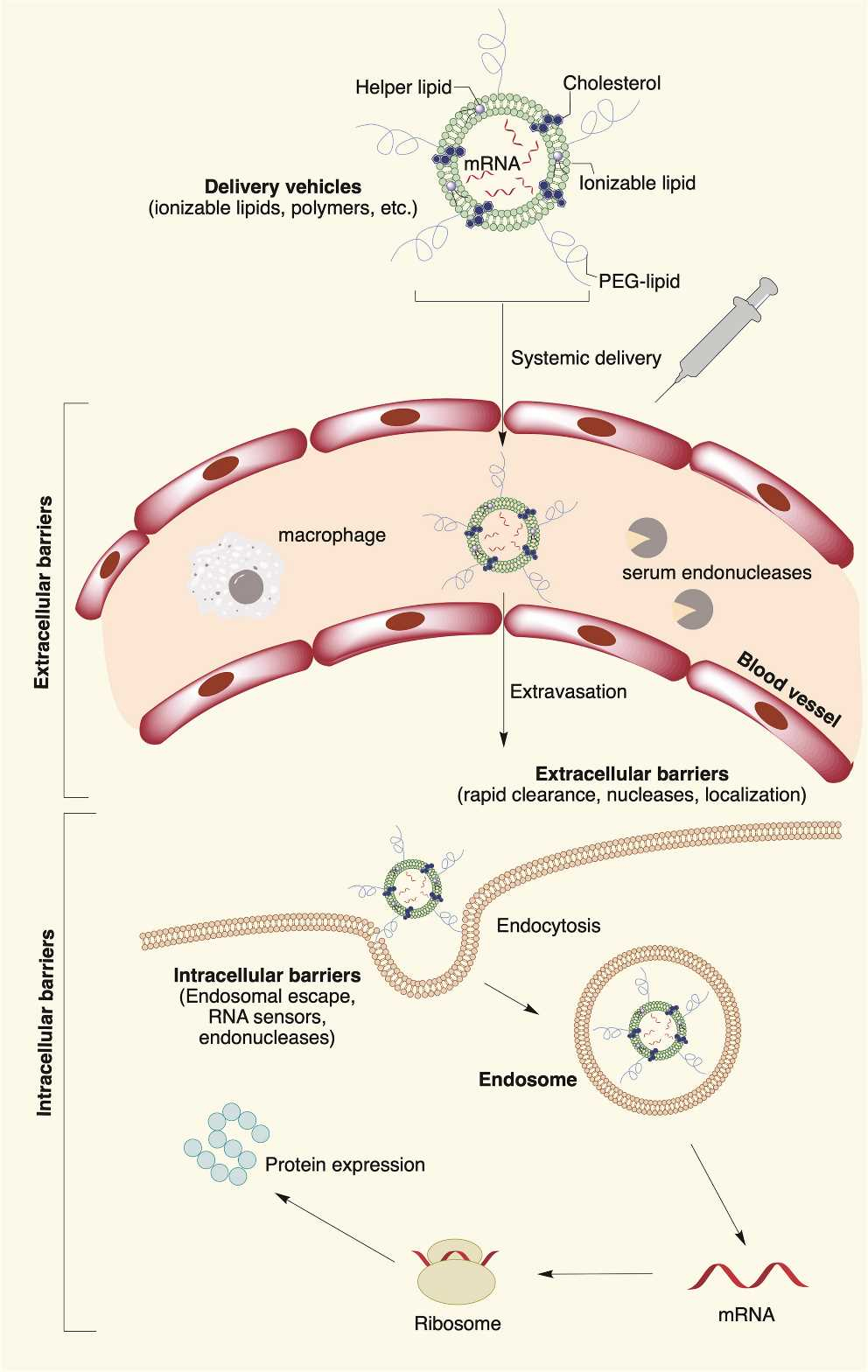
図11 脂質ナノ粒子によるmRNAの生体内への配送機構
Creative Biolbs: https://mrna.creative-biolabs.com/lipid-nanoparticle.htm
3.3 mRNAの作用機序
(A) 核酸ワクチン
生ワクチンや不活化ワクチンは、抗原そのものを体内に投与する。
核酸ワクチンは、ウイルス抗原の鋳型となる遺伝子を投与し、その遺伝子が取り込まれた細胞のセントラルドグマを利用して、ウイルス抗原を産生する。DNAワクチンは、鋳型DNAが核に入り、mRNAに転写される。一方で、mRNAはそのままリボソームにより翻訳されて抗原が産生される。自己細胞が自ら産生した抗原(外敵の一部断片)となり、2.1<解説>自然・獲得免疫の仕組みに示したように免疫力が強化される。
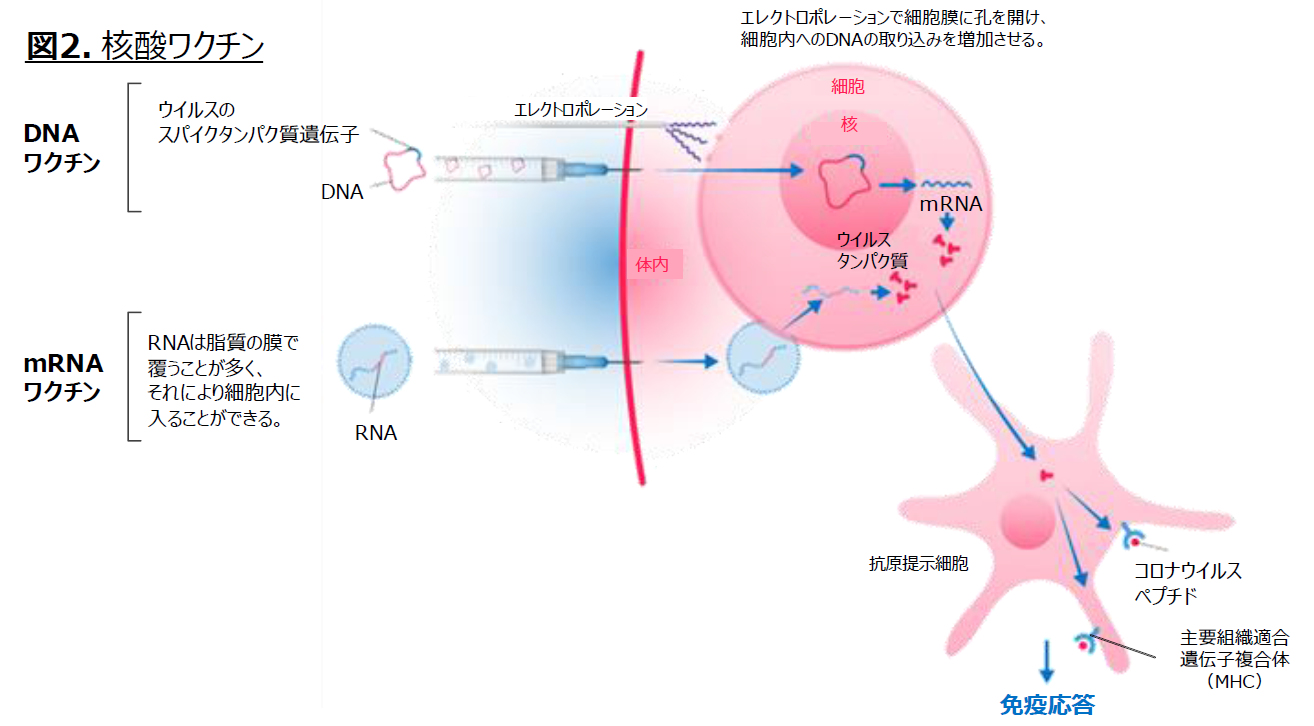
図12 核酸ワクチン
Pfizer-BioNTech:mRNAワクチン説明資料(2021年2月24日)
(B) mRNAワクチンによる免疫応答の誘発
本節には、2.1<解説>(B)獲得免疫と重複している内容があるが、あらためて、説明する。一部の表示記号が異なっていることにも、留意されたい。
(1) SARS-CoV-2 mRNA ワクチンが筋肉内に投与されると、筋肉内免疫反応が起こる(intramuscular imunization)。
(2) mRNA-LNPまたは局所的に生成された抗原(mRNA/antigen)のいずれかが、樹状細胞(dendritic cell、DC)などの抗原提示細胞(APCs)に取り込まれる。
(3) DC/APCsは、リンパ節(lymph nodes)に移動する。
(4) リンパ節では、DC/APCsがナイーブ(naive)なTリンパ球(T-lymphocytes)を形質化(priming)または活性化(activating)する。
(5a) 抗原を提示されたCD4-Tリンパ球は、Th1細胞やTfh細胞など、様々なヘルパーT細胞へ分化することができる。
(5b) 抗原を提示されたCD8-Tリンパ球は、当該ウイルスに感染した細胞を直ちに殺すこと(プログラム死)ができる細胞損傷性Tリンパ球の形成を誘導できる。
(6) TFh細胞は、リンパ節内の胚中心(germinal center、GC)反応(GC reaction)の開始を誘発する。ワクチン接種によって誘発されるGC反応は、成熟メモリーB細胞(matured memory B cell、MBC)および抗体を分泌する長寿命の形質細胞(long-lived plasma cell、LLPC)の形成をもたらす。
Tfh細胞は、Th1またはTh2形質型のいずれかに偏ることがある。このことは、LLPCによって生成されたTh1またはTh2に関連するそれぞれの抗体(antibodies、Abs)の発現への切り替えに影響する。
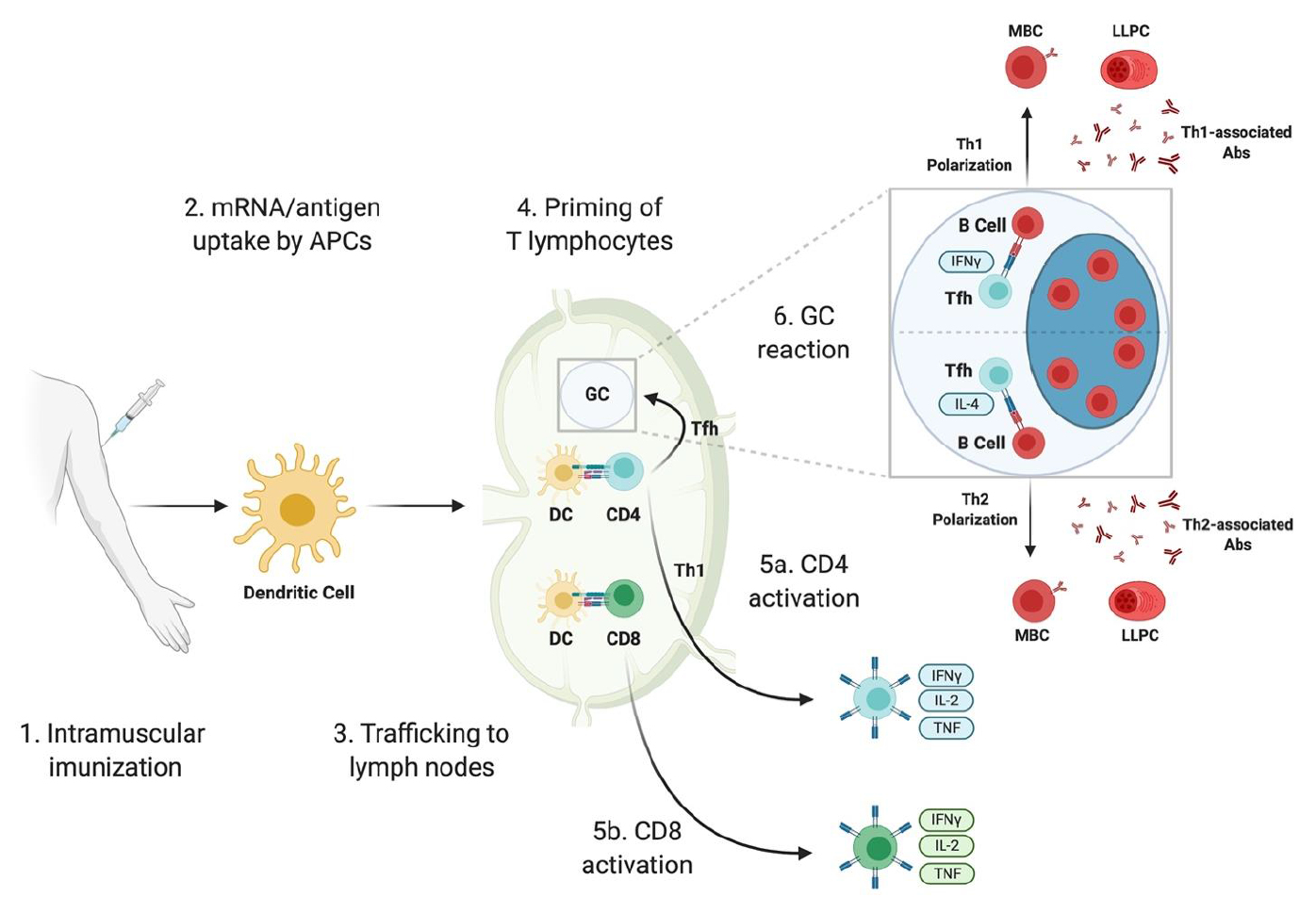
図13 mRNAワクチンによって誘発される免疫応答
E. Bettini and M. Locci: Vaccines 2021, 9(2), 147.
https://doi.org/10.3390/vaccines9020147
3.4 mRNAワクチンの製造工程
ニューヨークタイムズが、ファイザー社のmRNAワクチン製造工程について取材・紹介しているので、この概略を下記に示す。詳細については、Websiteまたは和訳をリンクしてあるので、閲覧されたい。
Step 1-1 コロナウイルスのS-タンパク質をコードするDNDを含むプラスミド調整し、保管しておく。

Step 1-2 プラスミドを解凍し、大腸菌へ導入(形質変換)する。

Step 2 形質変換大腸菌を培養する。
Step 3 最大300Lの培地が可能な容器に移し変えて、4日間培養する。
Step 4 大腸菌からプルスミドを取り出し、精製する。

Step 5 プラスミドの純度を検査し、DNAの塩基配列を確認する。
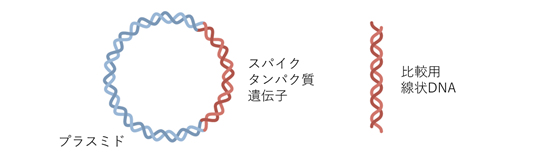
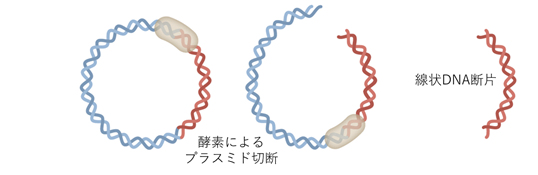
Step 6 大量精製したプラスミドからS-タンパク質をコードしているDNA切り出し線状化する(2日間を要す)。
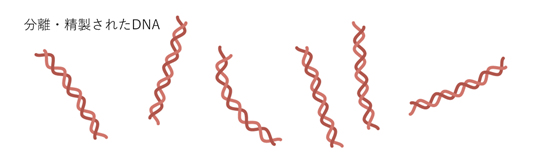
Step 7 DNAを精製し、塩基配列を確認する。1ボトルからワクチン150万人分ができる。
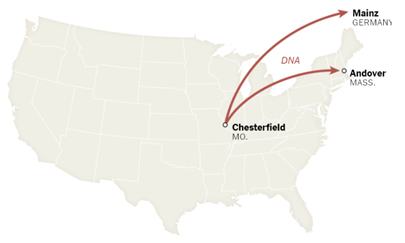
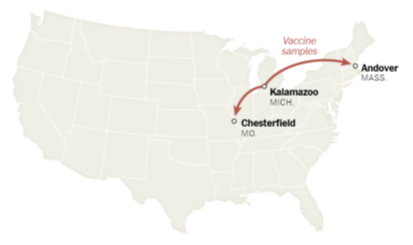
Step 8 瓶詰めしたDNAを凍結して、ミズーリ州からマサチェーセッツ州とドイツの工場へ送る。
Step 9 鋳型DNSの塩基配列からmRNAを作る(転写)。一つのバッチから750万本のワクチンが生産できる。
Step 10 mRNAを精製し、その純度と塩基配列を確認する。
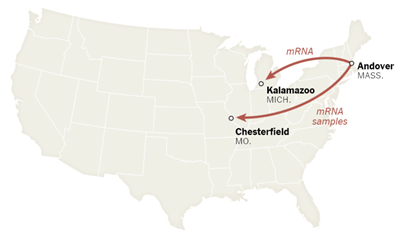
Step 11~12 精製mRNAを凍結して、ミシガン州とミズーリ州の工場に送る。ドイツのものはベルギーの工場に送られる。
Step 13 mRNAを封入するための脂質を調整する。

Step 14 脂質とmRNAを混ぜて、脂質ナノ粒子を調整する。その後、不意純物を除去し。滅菌処理する。
Step 15~16 脂質ナノ粒子を滅菌したバイアルに充填・密封して、凍結する。
Step 17 一部のサンプルは元の工場へ送られ厳密な品質検査が行われる。
(以上の全工程に約60日を要し、その半分は品質検査に費やされる。)
Step 18~19 完成ワクチンは、梱包されて各地へ輸送され、解凍されて投与される。
Next Step 変異株のワクチン
現在、流行している変異体の多くにはS-タンパクに重要な変異が認められ、ウイルスがヒト細胞に強く結合したり、ある種の抗体を回避する。変異株に対する有効性の高いワクチンを開発・試験中である。
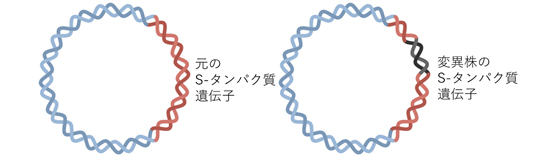
4.まとめ
COVID-19に対するmRNAワクチンについて、迅速な実用化とその接種効果に対して、国内専門家の中にも、当初、懐疑的な意見もあった(下記①~⑤に示すように、決して早急ではない総合的な科学技術の背景があった)。しかし、海外に続き国内での高い獲得免疫効果(感染率の低下と感染者の重症化抑制)が認められ、COVID-19の収束に向けてワクチン接種に大きな期待が掛かっている。本ページの内容をまとめると、下記のようになる。
① ここ十数年において、分子生物学に関する先端の知識・技術の進展があった。
② SARS-CoV(2003年のパンデミック・ウイルス)に関する地道な継続研究があった。
③ RNAに関する最近の基礎的・臨床的研究の著しい進展があった。
①〜③の背景のもとで、次の事実が挙げられる。
④ SARS-CoV-2の粒子構造とゲノムの迅速な解明
⑤ SARS-Cov-2のヒト細胞への侵入機構の解明
S−タンパクのACE2への吸着およびTMPRSS2によるS1-タンパクの切断とS2−タンパク質によるウイルス膜とヒト細胞膜の融合とウイルスゲノムの侵入。なお、ACE2を発現しない未分化iPS細胞に対して、SARS-CoV-2は感染できない(CiRAニュース, 2021年4月19日)。
④と⑤の事実に基づいて、mRNAワクチンの設計・生産技術の確立と早急な臨床試験が行われ、世界各国で接種が実施されている。生ワクチンや不活化ワクチン(以後、従来ワクチン)に比べて、mRNAワクチン(新ワクチン)の特徴は以下のとおりである
⑥ 従来ワクチンでは、病原体であるウイルス粒子そのものを抗原として接種する。
⑦ 新ワクチンでは、ウイルスのヒト細胞への侵入を阻止するために、S−タンパクを抗原として設定し、その抗原をヒト細胞のセントラルドクマを活用して生成させる。
⑧ S-タンパクを発現するmRNAをバイオ技術により人工的に生産し、これを脂質で包んだナノ粒子を筋肉注射して、獲得免疫を形成させる。
⑨ 抗原としてS−タンパクに的を絞ったmRNAワクチンは、高率な液性・細胞性免疫を獲得できることが明確となっている。
液性免疫(中和抗体による受容体への付着抑制)力は少しづつ減少するので、日数経過とともに感染予防力は低くなる。一方で、抗原に対する記憶細胞は保持され、細胞性免疫(感染細胞のプログラム死誘発)は有効であるので、長期間にわたって重症化を防ぐ効果は維持される。しかし、これらのワクチン効果の明確な継続日数については、現在のところよく分かっていない。
⑩ ウイルスのゲノムと粒子構造の解明に基づくmRNAワクチンは、変異種に対しても迅速に対応できる。
⑪ 注入されたmRNAは、ヒト細胞の核膜内に侵入することはなく、また、適宜、分解されるのでヒト細胞内での存在時間は限定的であって、原理的には安全なワクチンである。新ワクチン接種直後に、脂質膜の補助成分に起因すると思われるアナフィラキシーがまれな頻度で発生するが、対応処置法が確立されている。
大阪大学名誉教授・宮坂昌之氏は、日本記者クラブ主催のリモート会見において、新型コロナウイルス、変異株、ワクチン効果などについて詳しく話している。下記Youtubeに掲載されているので、是非、閲覧を勧めたい。
宮坂昌之:日本記者クラブ会見(2021年5月11日)
https://www.youtube.com/watch?v=Rk3rJ6EduwQ
新コロナウイルスの変異株も次々と現れている。ワシントン大学医学部保健指標評価研究所(Institute for Health Metrics and Evaluation、IHME)の報告によると、現在までのところ、各ワクチンの変異株に対する有効性に高低はあるものの、どの変異株に感染した場合であっても高い重症化予防効果が期待できることが示唆されている。変異株に対してワクチン効果が減弱する可能性があるという報告を受け、一部の企業では変異株に対応したワクチンの開発が始まっているとのことである。mRNAワクチンやアデノウイルスベクターワクチンは、これまで主流であった不活化ワクチンと比較すると変異株に対応するために変更する事項が少なくて済むという利点があり、変異株に対応するワクチンの開発も短時間で可能となることが期待される。
最後に余談であるが、今から45年頃前、ファイバースコープが導入された機能性内視鏡についての話である。執筆者は、医学部消化器内科での光化学・超音波・微細電極などを組合わせた消化器腫瘍の診断・治療法の開発に関わったことがある。その中の一つに、脂質ナノ粒子を投与、胃壁を通過したナノ粒子をリンパ節に移行させた後、超音波を照射して腫瘍がどの範囲まで浸潤・転移しているか診断するという研究があった。当時は、mRNAを脂質ナノ粒子で包んで、細胞内へ導入することなど、誰も考えていなかった。
一日も早い、新コロナウイルスの収束と生活・経済活動の回復を願っている。
村上定瞭
2021年6月11日
補筆
本ページ公開後、次に示す論文が公開された。
How the coronavirus infects our cells by M. Scudellari: Nature, Vol.595, pp.640-644,29 July 2021.
本論文では、「コロナウイルスが細胞に感染する方法となぜデルタ株がとても危険なのか」を最新の知見を元に考察している。本ページの記載内容をさらに深めた内容となっているので、是非、参照されたい。
時期を同じくして、中和抗体カクテルが開発された。感染初期段階における抗ウイルス治療薬(点滴投与)としてその効果が認められている。このカクテル薬の仕組みおよび製造技術についての解説記事を予定している。また、服用抗ウイルス薬も開発が進められおり、これが実現化すれば、切迫している医療体制の改善に多大な貢献となる。
