Chrome, Manganese and Iron – Properties, Processing and Measurement
村上定瞭(水浄化フォーラム), Sadaaki Murakami (Water & Solutions Forum)
はじめに
Ⅰ.クロム
1.クロムの水溶液化学
1.1 クロム(Ⅲ)
1.2 クロム(Ⅵ)
1.3 クロムの酸化還元反応
2.クロムの除去法
Ⅱ.マンガン
1.マンガンの水溶液化学
1.1 マンガン(Ⅱ)
1.2 マンガン(Ⅵ)
1.3 マンガンの酸化還元反応
Ⅲ.鉄
1.鉄の水溶液化学」
1.1 鉄(Ⅱ)
1.2 鉄(Ⅲ)
1.3 Feの酸化還元反応
Ⅳ.鉄・マンガンの除去
Ⅴ.定量測定
1.クロムの測定
2.マンガン・鉄の測定
参考文献
Introduction
I. Chromium
1. Aqueous chemistry of chronium
1.1 Chromium(III)
1.2 Chromium(VI)
1.3 Redox reactions of chromium
2. Chromium removal method
II. Manganese
1. Aqueous chemistry of manganese
1.1 Manganese(II)
1.2 Manganese(VI)
1.3 Redox reactions of manganese
III. Iron
1. Aqueous chemistry of iron
1.1 Iron(II)
1.2 Iron(III)
1.3 Redox reactions of iron
IV Removals of iron and manganese
V. Quantitative measurements
1. Chromium measurement
2. Manganese and iron measurements
General References
はじめに
Cr(最外殻電子:3d54s1)・Mn(3d54s2)・Fe(3d64s2)などは遷移元素で、自然の水環境の条件(好気・嫌気または酸化還元電位)によって、金属イオンの価数が容易に変化する。
わが国では、水質汚濁に係る環境基準および事業所の排水基準が定められている。人の健康に係る項目としてCr(VI)については環境基準0.05mg/Lおよび排水基準0.5mg/L、生活環境項目として溶解性の鉄およびマンガンについてそれぞれ排水基準10mg/Lが規定されている。
本ページでは、これらの重金属について、水中での化学的性質、除去および定量測定を説明する。公的な定量測定については、数種類の方法が規定されているが、化学的性質および除去法の理解を深めるために、吸光光度法について詳しく解説している。また、鉄およびマンガンは動植物にとって必須な微量元素でもあり、環境水、用水および排水のみでなく、土壌と農業においても重要なものである。
Introduction
The valence of metal ions especialy for transition elements, Cr(outermost shell electron: 3d54s1), Mn(3d54s2), Fe(3d64s2), etc. changes easily due to depending on the conditions of the water environment(aerobic or anaerobic one).
In Japan, environmental standards for water pollution and wastewater standards for business establishments have been established. Environmental standards of 0.05 mg/L and wastewater standards of 0.5 mg/L for Cr(VI) are specified as human health items, and 10 mg/L of wastewater standards for soluble iron and manganese are specified as living environment items.
This page describes the chemistry, removal and quantitative measurement of these heavy metals in water. Although several kinds of methods have been specified for official quantitative measurement, the absorptiometric method is explained in detail in order to deepen the understanding of the chemical properties and removal methods. Iron and manganese are also essential trace elements for plants and animals, and are important not only in natural water, water and wastewater, but also in soil and agriculture.
Ⅰ.クロム
クロムは、銀白色の光沢を持った硬くてもろい金属である。クロムは地殻中に100mg/kg程度含まれており、重金属の中では鉄、マンガンについで多い物質である。クロム鉱物は、主にクロム鉄鉱(FeO・Cr2O3)及びベニエン鉱(PbCrO4)等が知られているが、単体で産出することはなく、大部分は不溶性の形で存在するため自然水中に含まれることはまれである。
用途として、耐食性が高いためメッキや不動態を作る性質及び合金にすると硬度を増す性質のためにクロム鋼・ステンレス鋼の原料として利用されている。また、金属塩は、種々の色があるために顔料、うわぐすりとして使われており、皮なめしにも用いられている。
主なクロム化合物は三価及び六価である。天然の存在形態は、ほとんどが三価のクロムで、六価のクロムは、人為的起源によるものとみられる。
六価クロムは三価クロムより毒性が強く、ラットに対する経口投与のLD 50は、20~250mgCr(Ⅵ)/体重kg、185~615mgCr(Ⅲ)/体重kgである。また、重クロム酸カリウムの水生生物に対する24時間TLmは、コイで140~150mg/L、フナで705mg/Lである。
多量のクロム酸塩や二クロム酸塩の誤飲以外の毒性は、大きくないと考えられていたが、昭和50年(1975年)、クロムメッキ工場排水が新興住宅地の井戸水を汚染(0.05~2.54mg/L)し、これを飲用したり、浴用にして、100名もの人が消化器障害や皮膚疾患をはじめ、全身症状を呈し、低濃度の場合でも亜急性~慢性中毒のおそれがあることがわかり、注目を集めた。慢性毒性としては、職業病として知られている鼻中隔穿孔、呼吸器障害等がある。これは、六価クロムを含む空気やダストを吸引することによる。六価クロムに暴露された者の調査結果から、肺ガン、呼吸器系ガンとの相関性があるといわれている。
汚染のない河川水中でクロムは0~0.1μg/L、海水で0.04~0.07μg/L程度含まれているといわれている。
I. Chromium
Chromium is a hard and brittle metal with a silvery white sheen. Chromium is contained in the crust at around 100 mg/kg, which is the second most heavy metal after iron and manganese. Chromite ore (FeO・Cr2O3) and beniene ore (PbCrO4) are known as chrome minerals, but they are not produced alone and are rarely contained in natural water because they exist in insoluble form.
As a use, it is used as a raw material for chrome steel and stainless steel because of its high corrosion resistance and the property of forming plating and passivation and the property of increasing hardness when alloyed. In addition, metal salts are used as pigments and glazes because they have various colors, and are also used for skin tanning.
The main chromium compounds are trivalent and hexavalent. Most of the natural forms of existence are trivalent chromium, and hexavalent chromium is thought to have anthropogenic origin.
Hexavalent chromium is more toxic than trivalent chromium, and the LD 50 for oral administration to rats is 20 to 250 mg Cr(Ⅵ)/kg body weight, 185 to 615 mg Cr(Ⅲ)/kg body weight. The 24-hour TLm of potassium dichromate for aquatic organisms is 140 to 150 mg/L for carp and 705 mg/L for crucian carp.
It was thought that toxicity other than accidental ingestion of large amounts of chromate or dichromate was not large, but in 1975, a chrome plating factory drainage contaminated well water in new residential areas (0.05 to 2.54 mg/L), after drinking or bathing it, 100 people showed systemic symptoms including digestive disorders and skin diseases, and it was found that even at low concentration, there is a possibility of subacute to chronic poisoning, so attention collected. Chronic toxicity includes perforation of nasal septum and respiratory disorder, which are known as occupational diseases. This is due to suction of air and dust containing hexavalent chromium. From the results of a survey of people exposed to hexavalent chromium, it is said that there is a correlation with lung cancer and respiratory system cancer.
It is said that chromium is contained in uncontaminated river water in the range of 0 to 0.1 μg/L, and in seawater in the range of 0.04 to 0.07 μg/L.
Table I-1. Water quality standards for chromium, manganese, and iron.

1. Aqueous chemistry of chromium
Although there is a first chromium salt (II), the most important one is the second chromium salt (III), which shows properties similar to Al(Ⅲ) and Fe(Ⅲ). Chromates and dichromates are VI-valent.
1.1 Cr(Ⅲ)
(1)pHの影響
第二クロム(Ⅲ)イオンは、酸性では6配位八面体構造の[Cr(H2O)6]3+(以下、Cr3+と略称)として存在し、pHの増加にともなって[Cr(H2O)5OH]2+(以下、CrOH2+と略称)(青または紫色)を経て、pH 5付近からCr(OH)3(灰色)の沈殿を生成する。なお、[Cr(H2O)5OH]2+は、ヒドロキソブリッジによる2量体と平衡にある。
Cr(OH)3沈殿は、pH 12.5付近で緑色の[Cr(H2O)2(OH)4]–(以下、Cr(OH)4–またはCrO2–と略称)を生じて再溶解するが、溶液を沸騰させることにより難溶性のCr(OH)3が完全に沈殿する。
Cr(OH)3はコロイド状になることが多く、鉄(Ⅲ)やアルミニウム(Ⅲ)が大量にあって、その水酸化物が沈殿するときには凝集する。反対に、Cr(Ⅲ)が多いときには他の水酸化物の凝集が遅くなる。
1.1 Cr(Ⅲ)
(1) Effect of pH
Chromium(III) ion exists as [Cr(H2O)6]3+ (hereinafter abbreviated as Cr3+) having a hexa-coordinated octahedral structure in the acidic soution. Cr(OH)3 (gray) precipitates with increasing pH from around 5 via intermediate [Cr(H2O)5OH]2+(abbreviated as CrOH2+ hereinafter, blue or purple color). [Cr(H2O)5OH]2+ is in equilibrium with the dimer formed by hydroxo bridge.
The Cr(OH)3 precipitate is redissolved by producing green [Cr(H2O)2(OH)4]– (hereinafter abbreviated as Cr(OH)4– or CrO2–) at around pH 12.5, but the insoluble Cr(OH)3 is completely re-precipitated by boiling.
Cr(OH)3 is often in the form of colloid, and when iron (Ⅲ) and aluminum (Ⅲ) are present in large amounts, thier hidroxides aggregate and precipitate (coprecipitation). On the contrary, when Cr(III) is large, the aggregation reactions of other hydroxides are delayed.
[Cr(H2O)5OH]2+ ⇄ [(H2O)5Cr=(OH)2*=Cr(H2O)5]4+
(=(OH)2*=:ヒドロキソブリッジ)
Cr(OH)2+ + H2O = Cr(OH)2+ + H+ pK2 = 5.5
Cr(OH)2+ + H2O = Cr(OH)3(aq) + H+ pK3 = 5.9
Cr(OH)3(aq) + H2O = Cr(OH)4– + H+ pK4 = 11.0
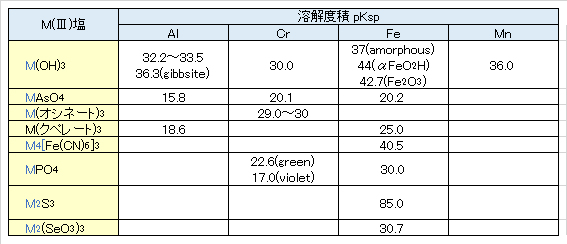
Cr3+ + 3OH– = Cr(OH)3(s) pKsp = 30
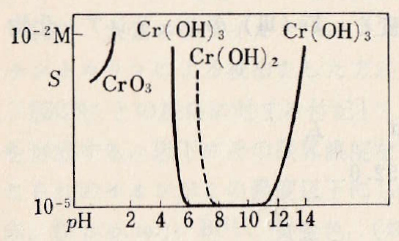
図Ⅰ-1 Cr(Ⅲ)水溶液の溶解度とpHとの関係
詳しくは、別ページを参照、自動計算MS-Excel(ダウンロード)
Fig.I-1. Relationship between solubility of Cr(Ⅲ) aqueous solution and pH.
For details, refer to another page and automatic calculation MS-Excel (download)
(2)Cr(Ⅲ)の難溶性塩
難溶性塩は多くない。緑がかったCrPO4は酢酸に可溶、無水の硫酸塩と塩化物は非常にゆっくりとしか溶解しない。
(2) Sparingly soluble Cr(III) salts
There are not many poorly soluble salts. Greenish CrPO4 is soluble in acetic acid, anhydrous sulfate and chloride are very slowly soluble.
(3)Cr(Ⅲ)錯体
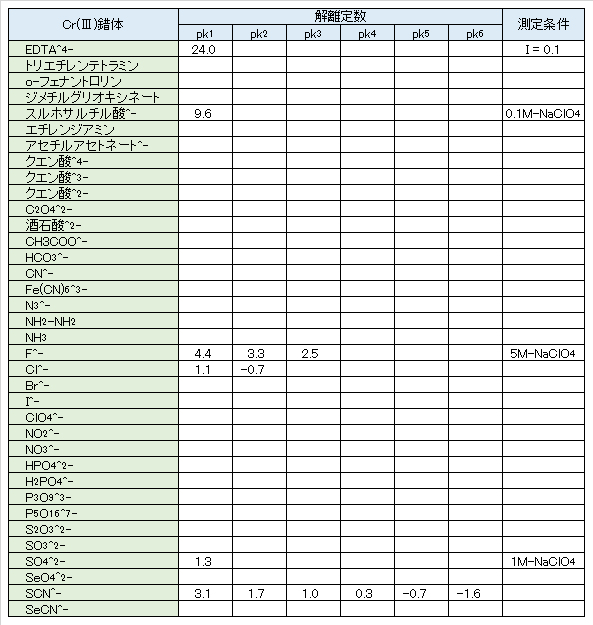
塩化物イオンとの錯体はかなり不安定で、CrCl2+は緑色である。SO42-との錯体CrSO4+、Cr(SO4)2–は相当安定である。酢酸イオンとの錯体と紅紫色アンミン錯体のいずれも溶液を沸騰すると分解する。シュウ酸、クエン酸、シアン化物イオンとの錯体は安定で、またフッ化物イオン、チオシアン酸イオンとの錯体もある。これらの錯体の多くは平衡に達するのがおそい。
(3) Cr(III) complexes
Complex with chloride ion is quite unstable, CrCl2+ is green. The complexes CrSO4+ and Cr(SO4)2– with SO42- are fairly stable. Both the complexes with acetate ion and the magenta ammine decompose when the solution is boiled. Complexes with oxalic acid, citric acid, and cyanide ions are stable, and there are also complexes with fluoride ions and thiocyanate ions. Many of these complexes are slow to reach equilibrium.
1.2 Cr(Ⅵ)
(1)pHの影響
CrO3(深紅色)は水に非常に可溶性で、濃いHClO4やH2SO4にはあまり溶けない。pH 1以下の酸性では4面体構造のH2CrO4として存在する。pH 2~6ではHCrO4–および重クロム酸イオンCr2O72-(2量体、橙赤色)が平衡状態にあり、pH 6以上のアルカリ性ではCrO42-(黄色)として存在する。なお、重合したイオンものは2量体Cr2O72-が大部分であるが、極めて小部分が3量体Cr3O102-(赤)や4量体とCr4O132-(褐色)として存在する。
1.2 Cr (VI)
(1) Effect of pH
CrO3 (crimson) is very soluble in water and poorly soluble in concentrated HClO4 and H2SO4. It exists as tetrahedral H2CrO4 in acidic conditions below pH 1. At pH 2 to 6, HCrO4– and dichromate ion Cr2O72- (dimer, orange-red) are in equilibrium, and in alkalines above pH 6 they exist as CrO42- (yellow). Most of the polymerized ionic compounds are dimers Cr2O72-, but very small parts exist as trimers Cr3O102- (red) and tetramer Cr4O132- (brown).
HCrO4– + H2O = CrO42- + H+ pK2 = 6.5
Cr2O72- + H2O = 2HCrO4– pK = 1.5
(2)難溶性のCr(VI)塩
クロム酸塩には難溶性のものが多い。もっとも難溶性のものはBaCrO4、Hg2CrO4(レンガ色)およびPbCrO4(黄色)で、これらはpH 4でも難溶性である。レンガ色のAg2CrO4はNH3やHNO3に溶解する。Mg2+、Zn2+、Cu2+、Mn2+、Fe2+やアルカリ金属の塩は可溶性である。
(2) Sparingly soluble Cr(VI) salts
Many chromates are poorly soluble. The most sparingly soluble are BaCrO4, Hg2CrO4 (brick color) and PbCrO4 (yellow), which are sparingly soluble even at pH 4. Brick-colored Ag2CrO4 dissolves in NH3 and HNO3. Mg2+, Zn2+, Cu2+, Mn2+, Fe2+ and alkali metal salts are soluble.
1.3 Redox reactions of Cr
1) Metal Cr
Metals are quickly covered with an oxide film in nitric acid and become difficult to react. It is soluble in HCl as shown in the formula (Cr-E1).
2) Cr(Ⅱ)
5N-HCl溶液ではEo’= -0.41 V、1-2N H2SO4ではEo’= -0.40 V。酸性では第一クロム塩Cr2+は極めて還元性があり、空気中で速やかに酸化される。H+イオンとゆっくり作用し、式(Cr-E3)のようになる。
この反応は白金のような触媒があるとさらに急速に進行する。Cr2+イオンは他のほとんどの全ての系を還元し、ClO4-を還元したり、NO3–をNH4+に、Sn2+をSnに還元する。
2) Cr(II)
Eo’= -0.41 V for 5N-HCl solution, Eo’= -0.40 V for 1-2N H2SO4. When acidic, the chromium(I) salt Cr2+ is extremely reducing and is rapidly oxidized in air. It acts slowly with H+ ions and becomes as shown in formula (Cr-E3).
This reaction proceeds even more rapidly with a catalyst such as platinum. Cr2+ ions reduce almost all other systems, reducing ClO4–, NO3– to NH4+ and Sn2+ to Sn.
3) Cr(Ⅲ)
Cr3+は酸性で亜鉛または亜鉛アマルガムによって還元されCr2+になる。強アルカリ性では水酸化物はまず黒褐色に酸化される。
3) Cr(Ⅲ)
Cr3+ is acidic and reduced by zinc or zinc amalgam to Cr2+. In strong alkalinity, the hydroxide is first oxidized to blackish brown.
4) Cr(Ⅵ)
酸性では、式(Cr-E4)に示すように、強い酸化剤となる。強酸性では酸化反応はかなり速く進行する。pH 2での反応はおそく、Fe2+、HAsO2やSn2+、Fe(CN)64-がその反応の触媒として作用する。pH 4.5では反応は一般に非常におそく、クロム酸はもはや強力な還元剤によっても還元されなくなるが、一方、Cr3+の酸化される早さも酸性溶液では非常におそく、強力な酸化剤たとえばMnO4–を過剰に加えて熱する場合にのみ酸化が起こる。CrO2–はアルカリ性の溶液中にのみ存在するが、式(Cr-E5)に示すように、このものはより早く酸化される。中間物質として難溶性の酸化物CrOHCrO4、またはCr2(CrO4)3が生成する(図1-2)。
アルカリ性ではCr3+は塩素、臭素、過酸化水素、過酸化鉛、過酸化ナトリウム、ペルオキシ二硫酸塩によって容易に酸化される。塩素はpH 4.5以上ではCr3+を酸化する。
4) Cr(Ⅵ)
When it is acidic, it becomes a strong oxidant as shown in the formula (Cr-E4). In strong acidity, the oxidation reaction proceeds fairly fast. The reaction at pH 2 is slow, and Fe2+, HAsO2, Sn2+, and Fe(CN)64- act as a catalyst for the reaction. At pH 4.5 the reaction is generally very slow and chromic acid is no longer reduced by strong reducing agents, while the oxidation rate of Cr3+ is also very slow in acidic solutions. Oxidation only occurs when heating is carried out with the addition of strong oxidants such as MnO4–. CrO2– is present only in alkaline solutions, but it is oxidized more quickly, as shown in equation (Cr-E5). The insoluble oxide CrOHCrO4 or Cr2(CrO4)3 is produced as an intermediate substance (Fig.1-2).
In alkaline, Cr3+ is easily oxidized by chlorine, bromine, hydrogen peroxide, lead peroxide, sodium peroxide and peroxydisulfate. Chlorine oxidizes Cr3+ above pH 4.5.
Cr3+ + e– = Cr2+ Eo = -0.41 V (Cr-E2)
2Cr2+ + 2H+ = 2Cr3+ + H2(g) (Cr-E3)
Cr2O72- + 14H+ + 6e– = 2Cr3+ + 7H2O Eo = 1.33 V (Cr-E4)
CrO42- + 4H+ + 3e– = CrO2– + 2H2O Eo = -0.12 V (pH 14) (Cr-E5)
Cr(CN)33- + e– = Cr(CN)64- Eo = -1.14 V (Cr-E6)
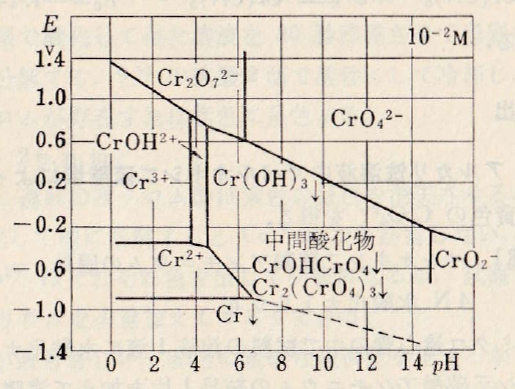
図Ⅰ-2 Crの酸化還元系の近似的な見かけの電位とpHとの関係
2.クロムの除去
(1)発生源
クロムは、製錬工場、無機顔料製造業などの無機工業製品製造業、有機顔料または合成染料の製造業などの有機化学化学工業製造業、医薬品製造業、皮革工場、染色工場金属製品製造業、機械器具製造業、酸またはアルカリによる表面処理施設、電気メッキ施設などからの廃水に含まれる。また、冷却水の循環使用にさいしてクロム酸塩を腐食抑制剤(インヒビター)として加えた場合のブローとして排出されることがある。
2. Chromium removal
(1) Source
Chromium is included in wastewaters from a machinery or equipment manufacturing, surface treatment facilities using acids or alkalis, electroplating facilities, a smelting factory, an inorganic industrial product manufacturing industry such as an inorganic pigment manufacturing industry, an organic chemical chemical manufacturing industry such as an organic pigment or synthetic dye manufacturing industry, a pharmaceutical manufacturing industry, a leather factory, a dyeing factory, a metal product manufacturing industry. In addition, when circulating cooling water, it may be discharged as a blow when chromate is added as a corrosion inhibitor.
(2)処理法
処理法に1)沈殿法、2)イオン交換法、3)その他がある。
1)沈殿法
沈殿化合物はCr(OH)3が一般的である。
廃液中に存在するCr(Ⅵ)イオン(CrO42-やCr2O72-など)は還元し、Cr(Ⅲ)の陽イオンにしたのち、アルカリを加えてpHを8前後にし、生成したCr(OH)3を凝集沈殿と清浄ろ過で分離する。
a) Cr(Ⅵ)の還元には還元剤を加える方法、電解還元による方法がある。
b) 還元剤としては一般に硫酸第一鉄、亜硫酸水素ナトリウム、その他が用いられる。
c) 硫酸第一鉄によるCr(Ⅵ)の還元はpHが低いほど反応速度が大で、pH 4以下、一般に 2~2.5で行われる。
d) Cr(Ⅲ)の水酸化物沈殿には、アルカリとして一般に石灰類(生石灰、消石灰)が用いられる。
(2) Treatment method
Treatment methods include 1) precipitation method, 2) ion exchange method, and 3) others.
1) Precipitation method
Cr(OH)3 is generally used as the precipitation compound.
Cr(Ⅵ) ions (CrO42-, Cr2O72-, etc.) present in the waste liquid are reduced to cations of Cr(Ⅲ), and then alkali is added to adjust the pH to around 8.
a) Cr(Ⅵ) can be reduced by adding a reducing agent or by electrolytic reduction.
b) Ferrous sulfate, sodium bisulfite, etc. are generally used as the reducing agent.
c) The reduction of Cr(Ⅵ) with ferrous sulfate has a higher reaction rate at lower pH, and is performed at pH 4 or less, generally at 2 to 2.5.
d) Lime (quick lime, slaked lime) is generally used as alkali for the hydroxide precipitation of Cr(Ⅲ).
2)イオン交換法
希薄濃度のCr(Ⅵ)イオンの除去に強塩基性陰イオン交換樹脂を用いるイオン交換法が応用される。Cr(Ⅵ)イオンは酸化作用が大であるのから耐酸化性の大きいイオン交換樹脂を選ぶ。また、溶離性がよくないので再生に留意する。
2) Ion exchange method
An ion exchange method using a strongly basic anion exchange resin is applied to remove dilute Cr(Ⅵ) ions. Since Cr(Ⅵ) ion has a large oxidizing effect, select an ion exchange resin with high oxidation resistance. Also, pay attention to regeneration because the elution property is not good.
II.マンガン
マンガンは、灰白色で、もろい金属である。軟マンガン鉱(MnO2)、サイロメレン鉱等として産出される。自然界においては広く分布しており、陸上では古い熱水鉱床に由来する黒鉱がある。海底でも熱水鉱床が次々に発見されているが、その他に深海底にはマンガン団塊の存在が知られている。
用途として、特殊鋼、乾電池、ガラスの着色、染色等に使われている。
マンガンには、Ⅰ価~Ⅶ価の7つの原子価状態が知られているが、Ⅱ、Ⅳ、Ⅶ価のものが普通にみられる。そのうち、Ⅱ価(Mn2+)とⅦ価(MnO4–)は、水中で安定しているが、Ⅳ価のマンガンは、不溶性の酸化物MnO2になりやすい。
水中では、イオンやコロイドの他、懸濁粒子や有機物と結合した形態等で存在している。河川中のマンガンは、主に天然由来のものであるが、鉱山廃水、工場排水等の混入により、希に高くなることがある。
天然水中では、通常、鉄と共存することが多い。地下水中では、遊離炭酸が多く、溶存酸素が少ないとき、還元状態のMn2+の形で溶存している。表層水では、酸素と接触することにより酸化され、Mn(Ⅳ)として存在する。湧き水や鉱山排水口の水路底の砂礫が黒い被膜で蔽われていることがあるが、これは地下水中のMn2+が地表でMn(Ⅳ)に変化し、黒色のMnO2の生成によるものである。他方、湖沼や貯水池では、水温成層期に深・底層部分が還元状態となり、不溶性MnO2は、還元されて可溶性のMn2+となりマンガンの溶出が起きる。
マンガンは、生体の微量必須元素であるが、多量のマンガンを摂取すると、急性中毒を引き起こす。人におけるマンガンの生物学的半減期は、13日である。水生生物への影響については、淡水中ではほとんど問題にならない。
一般に、自然水中に溶解性マンガンは0.1mg/L以下のオーダーで、1mg/Lになると異常値とみなすことができる。
II. Manganese
Manganese is an off-white, brittle metal. It is produced as soft manganese ore (MnO2) and silomerene ore. It is widely distributed in nature, and there is black ore derived from old hydrothermal deposits on land. Hydrothermal deposits have been found one after another on the sea floor, but it is also known that manganese nodules exist on the deep sea floor.
It is used for special steel, dry batteries, glass coloring and dyeing.
Seven valence states of valence I to VII are known for manganese, but valence states Ⅱ, Ⅳ, and Ⅶ are commonly found. Among them, the II value (Mn2+) and VII value (MnO4–) are stable in water, but IV value manganese tends to become an insoluble oxide MnO2.
In water, in addition to ions and colloids, they exist in the form of being combined with suspended particles and organic substances. Manganese in rivers is mainly of natural origin, but rarely becomes high due to the inclusion of mining wastewater, factory wastewater, and the like.
In natural water, it usually coexists with iron. In groundwater, when there is a large amount of free carbonic acid and a small amount of dissolved oxygen, it is dissolved in the form of reduced Mn2+. Surface water is oxidized by contact with oxygen and exists as Mn(IV). The spring water and the gravel at the bottom of the mine drainage channel are sometimes covered with a black film. This is because Mn2+ in groundwater changes to Mn(Ⅳ) on the ground surface and black MnO2 is generated. On the other hand, in lakes and reservoirs, the deep and bottom layers are reduced during water temperature stratification, and insoluble MnO2 is reduced to soluble Mn2+, which causes the elution of manganese.
Manganese is a trace essential element of the living body, but ingestion of a large amount of manganese causes acute poisoning. The biological half-life of manganese in humans is 13 days. The impact on aquatic organisms is rarely a problem in freshwater.
Generally, manganese soluble in natural water is on the order of 0.1 mg/L or less, and can be regarded as an abnormal value at 1 mg/L.
1.マンガンの水溶液化学
Mn(最外殻電子:3d54s2)は、Ⅰ(3d6) ~ Ⅶ(3d0)までの全てが知られている。元素が種々の酸化状態をとり得る場合はその酸化の程度が高いほどイオン半径は小さくなる。電荷もちろん同時に大きくなるから、元素の陽イオンの酸性は酸化数とともにより強くなる。そのため、陽イオンの存在範囲は非常に酸性の溶液中だけに限定される。このような高い酸化状態では、一般に、陰イオンの状態として存在し、かつそれに対する水酸化物は強酸の性質を帯びる。
1. Aqueous chemstry of manganese
Mn (outermost shell electrons: 3d54s2) is all known from I(3d6) to VII(3d0). When an element can be in various oxidation states, the higher the degree of oxidation, the smaller the ionic radius. Of course, as the charge increases simultaneously, the acidity of the elemental cation becomes stronger with the oxidation number. Therefore, the existence range of cations is limited only to a very acidic solution. In such a high oxidation state, it generally exists as an anion state, and the hydroxide to which it has a strong acid property.
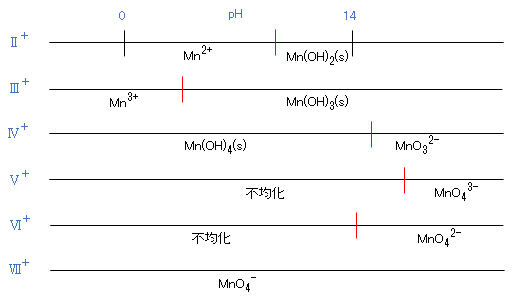
図Ⅱ-1 マンガンの価数と酸化物および水酸化物
Fig.II-1. Manganese valences and oxides and hydroxides.
1.1 Mn(Ⅱ)
(1)pHの影響
Mn2+は、Fe2+、Ni2+、Co2+の化合物と類似している。
陽イオンMn2+は淡桃色、白色のMn(OH)2は、pH 8.5(0.01M)から沈殿する。この沈殿は非常な強アルカリ性溶液に極めて少量溶解してHMnO2-(または、6配位八面体の[Mn(H2O)3(OH)3]–)を生じる。NH4+が存在すれば、6配位八面体構造の安定なアンミン錯体を形成[Mn(NH3)6]2+を形成し、全く沈殿しない。また、空気中で酸化されて、MnO2に変化し褐色になる。
1.1 Mn(II)
(1) Effect of pH
Mn2+ is similar to Fe2+, Ni2+, and Co2+ compounds.
The cation Mn2+ is pale pink and white Mn(OH)2 precipitates from pH 8.5 (0.01M). This precipitate dissolves in a very small amount in a very strong alkaline solution to produce HMnO2– (or hexacoordinate octahedral [Mn(H2O)3(OH)3]–). If NH4+ is present, it forms a stable ammine complex with a hexacoordinate octahedral structure, forming [Mn(NH3)6]2+, and does not precipitate at all. In addition, it is oxidized in the air and changes to MnO2 and turns brown.
Mn(OH)– + H2O = Mn(OH)2(aq) + H+ pK2 = 9.9
Mn(OH)2(aq) + H2O = Mn(OH)3– + H+ pK3 = 11.0
Mn(OH)3– + H2O = Mn(OH)42- + H+ pK4 = 15.4
Mn2+ + 2OH– = Mn(OH)2 pKsp = 15.9
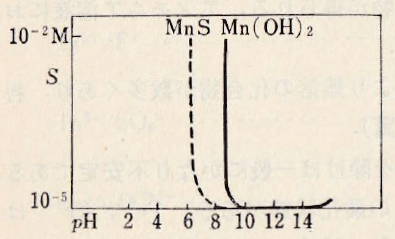
図Ⅱ-2 Mn(Ⅱ)水溶液の硫化物と水酸化物の溶解度とpHとの関係
自動計算MS-Excel事例(ダウンロード)
Fig.II-2. Relationship between pH and solubility of sulfide and hydroxide in Mn(II) aqueous solution.
Automatic calculation MS-Excel file (download).
(2)難溶性のMn(Ⅱ)塩
数多くあるが、溶解度が極めて小さい塩はまれである。硫化物MnSは最も難溶性で、ピンク色であるが、空気中で酸化されて、MnO2(aq)になる。硫化アンモニウムの過剰の存在下で煮沸するとさらに水和の少ない緑色の硫化物が得られる。MnNH4PO4も難溶解性化合物である。
(2) Sparingly soluble Mn(II) compounds
There are many, but the salts with extremely low solubility are rare. The sulfide MnS is the most sparingly soluble and pink, but it oxidizes in air to MnO2(aq). Boiling in the presence of excess ammonium sulphide gives a green sulphide with even less hydration. MnNH4PO4 is also a sparingly soluble compound.
(3)Mn(Ⅱ)錯体
不安定な錯体が数多くある。リン酸塩、シュウ酸塩、アンミンおよび有機ヒドロキシ化合物の錯体など、シアン化物イオンとの錯体は緑色でより安定である。フッ化物イオンとの錯体も同様に安定である。
(3) Mn(II) complexes
There are many unstable complexes. Complexes with cyanide ions, such as those of phosphates, oxalates, ammine and organic hydroxy compounds, are greener and more stable. Complexes with fluoride ions are similarly stable.
1.2 Mn(Ⅵ)
Mn(Ⅶ)(4s24p6 | 3d0)はその外殻電子(価電子)の状況から、クロムCr(Ⅵ)(3s23p6 | 3d0)、モリブデンMo(Ⅵ)(4s24p6 | 4d0)、タングステンW(Ⅵ)(5s25p6 | 5d0)および硫黄S(Ⅱ–)(2s22p6 |3s23p6)に類似している。ただし、(内殻電子 | 外殻電子)である。
Mn(Ⅶ)は溶液では、マンガン酸イオンMnO42-(四面体構造、図Ⅱ-3)としてのみ存在する。この溶液は緑色で、イオンは溶液が強アルカリ性の場合にのみ安定である。アルカリ性が弱くなると不均一化する。
1.2 Mn (Ⅵ)
Mn(Ⅶ) (4s24p6 | 3d0) has no outer shell electrons (valence electrons), so chromium Cr(Ⅵ)(3s23p6 | 3d0), molybdenum Mo(Ⅵ)(4s24p6 | 4d0), tungsten W(Ⅵ)( 5s25p6 | 5d0) and sulfur S(II–) (2s22p6 | 3s23p6). Here, it is (inner shell electrons | outer shell electrons).
Mn(VII) exists only in the solution as manganate ion MnO42- (tetrahedral structure, Fig.II-3). The solution is green and the ions are stable only when the solution is strongly alkaline. It becomes non-uniform when the alkalinity becomes weak.
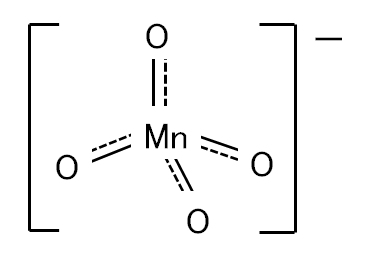
図Ⅱ-3 MnO4–の四面体構造
Fig.II-3. Tetrahedral structure of MnO4–.
Ba2+ + MnO42- = BaMnO4(s) pKsp = 9.6
1.3 Redox reactions of Mn
Metal Mn is a strong reducing agent that acts on H2O (Mn-E1).
M(Ⅱ)/Mn(0)
Mn(Ⅲ)/Mn(Ⅱ)
Mn3+ + e– = Mn2+ E = 1.5 V (9N-H2SO4) (Mn-E2-1)
Mn(CN)63- + e– = Mn(CN)64- E = -0.24 V (Mn-E2-2)
Mn(Ⅳ)/Mn(Ⅱ)
アルカリ性では、沈殿したMn(OH)2は空気に触れるとすぐに酸化される。この反応は、ClO–、H2O2、S2O82-などの酸化剤が共存すれば、なお速い。その結果、順次にMn2O4、Mn2O3およびMnO2のような化合物の水和物が得られる。
10N-NaOH中では酸化の結果、まず褐色のMn2O4、次にMn2O3が生成し、最後にMnO2が生じることとなる。H2O2の分解はこれらの酸化還元によって触媒作用を受ける。
In alkaline, the precipitated Mn(OH)2 is oxidized immediately on contact with air. This reaction is even faster in the presence of oxidizing agents such as ClO–, H2O2, S2O82-. As a result, hydrates of compounds such as Mn2O4, Mn2O3 and MnO2 are sequentially obtained.
As a result of oxidation in 10N-NaOH, brown Mn2O4 is formed first, then Mn2O3, and finally MnO2. The decomposition of H2O2 is catalyzed by these redox compounds.
Mn3O4(s) + 2H+ + 2e– = 3MnO(s) + H2O E = -0.4 V (Mn-E3-1)
3Mn2O3(s) + 2H+ + 2e– = 2Mn3O4(s) + H2O E = -0.2 V (Mn-E3-2)
2MnO2(s) + 2H+ + 2e– = Mn2O3(s) + H2O E = -0.05 V (pH 14) (Mn-E3-3)
Mn(Ⅵ)/Mn(Ⅳ)
Mn(Ⅶ)/Mn(Ⅵ)
Mn(Ⅶ)/Mn(Ⅳ)
Mn(Ⅶ)/Mn(Ⅳ)系およびMn(Ⅳ)/Mn(Ⅱ)系の電位は互いに非常に近い。したがって、MnO4-は一般にMn2+まで直接還元されるが、一方、このMn2+はMnO4–と反応してゆっくりとMn(Ⅳ)を生じる。
酸性溶液ではMnO4–はFe(Ⅱ)のο-フェナント錯体(図Ⅲ-2)を赤から薄青に変化させる。反応を起こし、またFe2+、濃HCl、Cl–(熱時)、Sn2+、CeO42-(熱時)、H2O2、S2-、As(Ⅲ)、N3–などを酸化する。酢酸緩衝液中では、Br–とI–は酸化されるが、Cl–は酸化されない。
酸性の弱い溶液や中性またはアルカリ性の溶液では強力還元剤のみが過マンガン酸イオンをMn2+にまで還元するが、一般に反応はMnO2でとまる。しかし、Mn2+と錯体を生成するようなイオン(例えば、F–)が共存すると還元はMn(Ⅲ)の段階で止まる。
The potentials of Mn(Ⅶ)/Mn(Ⅳ) system and Mn(Ⅳ)/Mn(II) system are very close to each other. Therefore, MnO4– is generally directly reduced to Mn2+, while this Mn2+ reacts with MnO4– to slowly produce Mn(IV).
In acidic solution, MnO4– changes the ο-phenant complex of Fe(II) (Fig.III-2) from red to light blue. It causes a reaction and also oxidizes Fe2+, concentrated HCl, Cl– (when hot), Sn2+, CeO42- (when hot), H2O2, S2-, As(Ⅲ), N3–. In the acetate buffer, Br– and I– are oxidized, but Cl– is not.
In weakly acidic or neutral or alkaline solutions, only strong reducing agents reduce permanganate ions to Mn2+, but the reaction generally stops at MnO2. However, when an ion that forms a complex with Mn2+ (for example, F–) coexists, the reduction stops at the Mn(Ⅲ) stage.
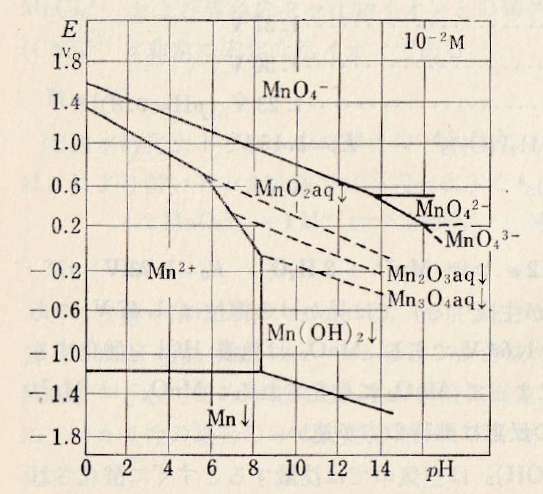
図Ⅱ-4 Mnの酸化還元系の近似的な電位の見かけの電位とpHとの関係
Fig.II-4. Relationship between apparent potential and pH of Mn redox system.
不均一化による分解
式(Ⅱ-1)のようにMn2O3(aq)は酸性でMnO2とMn2+に分解する(図Ⅱ-4)。
MnO42-はpH 13.5以下では存在しない。それ以下のアルカリ性溶液では、式(Ⅱ-2)のように不均化する。同様に、MnO43-も強アルカリ性溶液中のみに存在する(図Ⅱ-1参照)。
Decomposition due to non-uniformity
Like formula (II-1), Mn2O3(aq) is acidic and decomposes into MnO2 and Mn2+ (Fig.II-4).
MnO42- does not exist at pH below 13.5. Alkaline solutions below that cause disproportionation as shown in formula (II-2). Similarly, MnO43- is also present only in strongly alkaline solutions (see Fig.II-1).
3MnO42- + 4H+ = 2MnO4– + MnO2(s) + 2H2O (Ⅱ-2)
Ⅲ.鉄
鉄は、光沢があり、展延性に富んでいる金属である。主に赤鉄鉱(Fe2O3)、磁鉄鉱(Fe3O4)、褐鉄鉱(Fe2O3・nH2O)、黄鉄鉱(FeS2)などに含まれて産出する。地殻中には酸素、ケイ素、アルミニウムに次いで多い。用途として、自動車、パイプ、建材、鉄道、機械等であり、広範囲に使われている。
水中の溶解性鉄は、鉄(Ⅱ)イオン、鉄(Ⅲ)イオン及びそれらの各種錯イオンである。また、不溶解性鉄の主な形態は、水酸化鉄(Ⅲ)(Fe(OH)3)、酸化鉄(Ⅲ)(Fe2O3)、有機鉄(鉄のフミン錯体)、ケイ酸と結合した形である。
水に溶けている鉄(Ⅱ)イオンは、無色であるが、水中に酸素があるときは酸化されて、赤褐色の水酸化鉄(Ⅲ)の沈殿を生じる。その結果、無色透明の水が赤色に変わって見える。地下水中では、有機物が溶存酸素によって酸化分解されて、二酸化炭素を生じる一方、酸素が消費されて還元状態にあるとみられる。このような地下水中では、鉄は鉄(Ⅱ)イオンとしてかなり高濃度で、かつ安定に溶けている。その地下水を汲み上げ地表に持ってくると、二酸化炭素が大気中に揮散し、水中の鉄イオンと炭酸との平衡が崩れ、他方、大気中の酸素が溶け込み酸化が起こり、その結果、赤褐色の水酸化鉄(Ⅲ)が沈殿することとなる(文献を参照)。無色透明な温泉水が瞬く間に真っ赤に濁るのは、同じ機構によるものである。
地表水の溶解性鉄の濃度が一般に 1mg/L(場合によっては 1μg/L)以下と極めて少ないのは、自然の酸化と水酸化鉄(Ⅲ)または酸化鉄(Ⅲ)の溶解度が小さいことによる。逆に、富栄養化が進んだ湖沼、貯水池では、水温成層期に深・底層部が還元状態となり、鉄やマンガンの溶出が起こる。
鉄分のある水は、布地や器物などを黄褐色に着色(0.3mg/L以上)したり、臭気や苦味(0.5~1.0mg/L)を与える。また、製紙、染色、電子工業等の製品の品質に影響を与えることから、水道水としても、工業用水としてもできるだけ少ないことが望まれる。したがって、用水中の鉄の含量は、どんな目的に使用するとしても 0.3mg/L以下、理想的には 0.1mg/L以下が望ましいとされている。
鉄は、ヒトの必須元素(7~48mg/日)であるが、血液中の遊離鉄イオンは、有害である。塩化第二鉄をウサギに静注した場合、急性致死量は、7.2mg/kg体重の値が示されている。魚の毒性としては、24時間半数致死濃度は2.4mg/L(コイ)~25mg/L(ハゼ)である。しかし、環境の濃度レベルでは、人への健康影響は少ないと考えられる。むしろ、用水としての利用面、上水の性状の面で重要と考えられる。
鉄について環境基準値は設定されていない。
III. Iron
Iron is a metal that is glossy and highly spreadable. Mainly contained in hematite (Fe2O3), magnetite (Fe3O4), limonite (Fe2O3・nH2O), pyrite (FeS2), etc. Oxygen, silicon, and aluminum are the second largest in the crust. It is used for automobiles, pipes, building materials, railways, machinery, etc. and is widely used.
Soluble iron in water is iron (II) ion, iron (III) ion and their various complex ions. The main forms of insoluble iron are iron (III) hydroxide (Fe(OH)3), iron oxide (III) (Fe2O3), organic iron (a humic complex of iron), and silicic acid.
Iron(II) ions dissolved in water are colorless, but when oxygen is present in water, they are oxidized to form reddish brown iron(III) hydroxide. As a result, colorless and transparent water looks red. In groundwater, organic matter is oxidatively decomposed by dissolved oxygen to produce carbon dioxide, while oxygen is consumed and it seems to be in a reducing state. In such groundwater, iron is dissolved at a fairly high concentration as iron (II) ions and is stable. When the groundwater is pumped up and brought to the surface, carbon dioxide is volatilized into the atmosphere and the equilibrium between iron ions in the water and carbonic acid is disrupted, while oxygen in the atmosphere dissolves and oxidation occurs, resulting in reddish brown water by Iron oxide (III) precipitation (see the literature). The same mechanism causes colorless and transparent hot spring water to turn cloudy red in an instant.
The concentration of soluble iron in surface water is extremely low, generally less than 1 mg/L (1 μg/L in some cases) because of natural oxidation and low solubility of iron(III) hydroxide or iron(III) oxide. On the contrary, in lakes and reservoirs where eutrophication has advanced, deep and bottom layers are reduced during the water temperature stratification period, and iron and manganese are eluted.
Water with iron content colors fabrics and utensils to a yellowish brown color (0.3 mg/L or more) and gives odor or bitterness (0.5 to 1.0 mg/L). Further, since it affects the quality of products such as paper making, dyeing, and electronics industry, it is desired that the amount of tap water and industrial water is as small as possible. Therefore, the iron content in the water should be 0.3 mg/L or less, ideally 0.1 mg/L or less for any purpose.
Iron is an essential element in humans (7 to 48 mg/day), but free iron ions in the blood are harmful. When ferric chloride is intravenously injected into rabbits, the acute lethal dose is 7.2 mg/kg body weight. Regarding the toxicity of fish, the lethal concentration for 24 hours and a half is 2.4 mg/L (carp) to 25 mg/L (goby). However, at the concentration level of the environment, human health effects are considered to be small. Rather, it is considered to be important in terms of water usage and properties of tap water.
Environmental standard values have not been set for iron in Japan.
1. Aqueous chemistry of iron
Ferrous iron Fe(II) (outer shell electrons: 3d6) belongs to the genus Zinc. Ferric iron Fe(Ⅲ)(3d5) belongs to the genus Ammonia. Ferrate (VI) (3d2) is similar to manganate and chromate.
1.1 Fe(Ⅱ)
(1)pHの影響
Fe(Ⅱ)は、Mn(Ⅱ)、Zn(Ⅱ)、Ni(Ⅱ)、Co(Ⅱ)に似ている。NaOHを加えるとはじめに塩基性塩が得られ、ついで水酸化物が得られる。アンモニア溶液における硫化物の溶解度は一般に小さい。水酸化物より難溶性の化合物が多数あり、特に硫化物は難溶である。錯体も多数であるが、CN–との錯体を除けば一般に不安定である。いくつもの酸化状態があり、Cr、Mn、Feなどが類似している。
1.1 Fe(II)
(1) Effect of pH
Fe(II) is similar to Mn(II), Zn(II), Ni(II) and Co(II). The addition of NaOH first gives the basic salt and then the hydroxide. The solubility of sulfides in ammonia solution is generally low. There are many compounds that are less soluble than hydroxides, especially sulfides. There are many complexes, but they are generally unstable except for the complex with CN–. There are several oxidation states, Cr, Mn, Fe, etc. are similar.
Fe(OH)– + H2O = Fe(OH)2(aq) + H+ pK2 = 7.9
Fe(OH)2(aq) + H2O = Fe(OH)3– + H+ pK3 = 14.8
Fe(OH)3– + H2O = Fe(OH)42- + H+ pK4 = 19.5
Fe2+ + 2OH– = Fe(OH)2 pKsp = 15.1
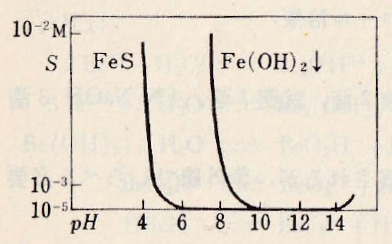
図Ⅲ-1 Fe(Ⅱ)水溶液の溶解度とpHとの関係
自動計算MS-Excelファイル(ダウンロード)
Fig.III-1. Relationship between pH of Fe(II) aqueous solution and pH.
Automatic calculation MS-Excel file (download).
(2)Fe(II)の難溶性塩
Fe(Ⅱ)塩には、炭酸塩、シアン化物、シュウ酸塩、リン酸塩など難溶性のものが多い。黒色の硫化物FeSはpH 4から沈殿しはじめ、空気中でゆっくり酸化を受ける。コロイド状態では溶液は濃厚な緑色である。
(2) Sparingly soluble Fe(II) salts
Many Fe(II) salts are sparingly soluble such as carbonates, cyanides, oxalates and phosphates. The black sulfide FeS begins to precipitate from pH 4 and slowly undergoes oxidation in air. In the colloidal state the solution is a deep green color.
(3)Fe(II)錯体
Ni2+、Zn2+などのようにFe2+はアンミン錯体を生成するが、空気中では速やかに酸化される。有機のヒドロキシ化合物、次亜リン酸、シュウ酸イオンとも錯体を生成する。また、1,10-フェナントロリン(phenanthroline:phen)やCN–とそれぞれ安定な錯体[Fe(phen)3]2+や[Fe(CN)6]4-を形成する。
(3) Fe(II) complexes
Fe2+ forms ammine complexes like Ni2+ and Zn2+, but it is rapidly oxidized in air. It also forms a complex with organic hydroxy compounds, hypophosphorous acid and oxalate ion. It also forms stable complexes [Fe(phen)3]2+ and [Fe(CN)6]4- with 1,10-phenanthroline (phen) and CN–, respectively.
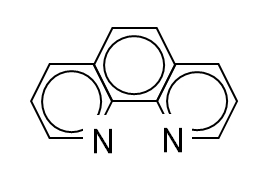
図Ⅲ-2 1,10-フェナントロリン Fig.III-2. 1,10-phenanthroline.
1.2 Fe(Ⅲ)
(1)pHの影響
酸性ではFe3+が常に存在する。Fe3+の溶液は無色か淡紅紫色(過塩素酸または硝酸溶液)である。塩酸や硫酸の溶液では黄色い錯体が生じる。錆色の水酸化物Fe(OH)3はpH 2(10-2 M)から沈殿するが、中性付近までコロイド状になって溶液中に分散していることがある。強アルカリ性では少量の水酸化物がさらにコロイド状になる。
Fe(Ⅱ)があるときには水酸化第一・第二鉄が沈殿する。緑色:Fe3(OH)8;黒色:Fe4(OH)10。
1.2 Fe(Ⅲ)
(1) Effect of pH
When acidic, Fe3+ is always present. The solution of Fe3+ is colorless or pink-red (perchloric acid or nitric acid solution). A yellow complex is formed in a solution of hydrochloric acid or sulfuric acid. Rust-colored hydroxide Fe(OH)3 precipitates from pH 2 (10-2 M), but it may be dispersed in the solution in the form of colloid up to near neutrality. In strong alkaline, a small amount of hydroxide becomes more colloidal.
When Fe(II) is present, ferrous and ferric hydroxide precipitate. Green: Fe3(OH)8; Black: Fe4(OH)10.
Fe(OH)2- + H2O = Fe(OH)2– + H+ pK2 = 3.4
Fe(OH)2– + H2O = Fe(OH)3(aq) + H+ pK3 = 4.3
Fe(OH)3(aq) + H2O = Fe(OH)4– + H+ pK4 = 15.0
Fe3+ + 3OH– = Fe(OH)3 pKsp = 37(無定形)
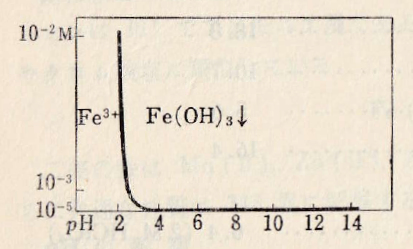
図Ⅲ-3 Fe(Ⅲ)水溶液の溶解度とpHとの関係
自動計算MS-Excelファイル(ダウンロード)
Fig.III-3. Relationship between solubility of aqueous Fe(Ⅲ) solution and pH.
Automatic calculation MS-Excel file (download).
(2)難溶性のFe(III)塩
水酸化物より難溶性な化合物は少ない。FePO4は酢酸酸性では難溶性である。塩基イオンCO32-、BO2–などは一般に適当なpHになると水酸化物の沈殿を生成させる。
硫化アンモニウムは黒色のFe2S3を沈殿させ、これはアルカリ性でのみ安定である。H2S は 2FeS + S を沈殿させる。
(2) Sparingly soluble Fe(III) salts
There are few compounds that are poorly soluble than hydroxides. FePO4 is sparingly soluble in acetic acid. Basic ions such as CO32− and BO2– generally form hydroxide precipitates at suitable pH.
Ammonium sulfide precipitates black Fe2S3, which is only alkaline and stable. H2S precipitates: 2FeS + S.
(3)Fe(III)錯体
Fe(Ⅲ)錯体は非常に多い。塩化物イオンとレモン黄色、硫酸イオンと黄色、チオシアン酸イオンと濃紅色の錯体を生成するが、いずれも不安定である。酢酸イオンとは[Fe(CH3COO)2(OH2)4]+のような赤い不安定な錯体を生成するが、熱する分解して水酸化物を沈殿する。フッ化物イオンとの錯体は無色[FeF(OH2)5]2+などがある。ピロリン酸、リン酸、有機のヒドロキシ化合物とも錯体を生成し、シュウ酸との錯体は緑でかなり安定である。非常に安定な錯体はフェリシアンイオン[Fe(SCN)6]2-とニトロプルシッドイオン[Fe(CN)5NO]2-でいずれも橙黄色である。
(3) Fe(III) complexes
There are many Fe(Ⅲ) complexes. Complexes of chloride ion with lemon yellow, sulfate ion with yellow, and thiocyanate ion with deep red are formed, but they are both unstable. Acetate ion forms a red unstable complex such as [Fe(CH3COO)2(OH2)4]+, which decomposes by heat and precipitates hydroxide. Complexes with fluoride ions include colorless [FeF(OH2)5]2+. It also forms a complex with pyrophosphoric acid, phosphoric acid and organic hydroxy compounds, and the complex with oxalic acid is green and fairly stable. Very stable complexes are ferricyan ion [Fe(SCN)6]2- and nitroprusside ion [Fe(CN)5NO]2-, both of which are orange yellow.
(4)有機溶媒
ペクロンとオキシンはクロロホルムや四塩化炭素で抽出される化合物を生成する。Fe(SCN)3あるいはFe(SCN)6Feは多くの有機溶媒に溶けて赤くなる。塩化物は強塩酸酸性でエーテルやケトンなどに抽出され、この際の過防物は黄色のHFeCl4およびFeCl3である。
(4) Organic solvents
Pecron and oxine form compounds that are extracted with chloroform and carbon tetrachloride. Fe(SCN)3 or Fe(SCN)6Fe dissolves in many organic solvents and turns red. Chlorides are strongly HCl acidic and are extracted into ethers and ketones, and the perprotective substances in this case are yellow HFeCl4 and FeCl3.
1.3 Feの酸化還元反応
(1)Fe(Ⅱ)/Fe(0)系
金属鉄は非常に還元性が強く酸化されやすい、特に希酸に侵されやすい。しかし、反応はいずれの方向にもおそい反応である。水の存在下で、酸素に侵され、Sb、Ag、Pbなどのイオン水溶液から金属を析出させる。アルカリ性での見かけの電位は-0.8 ~ -0.9V(水酸化鉄を飽和した10N-NaOHの溶液)であり、この電位はほぼ水素が発生する電位に近い。そこで鉄は熱時には割に速く水素を放って水に侵されていき、その際に主としてFe3O4の黒色化合物が生成する。
1.3 Redox reactions of Fe
(1) Fe(II)/Fe(0) system
Metallic iron has a strong reducing property and is easily oxidized, and particularly susceptible to dilute acid. However, the reaction is a slow reaction in either direction. In the presence of water, it is attacked by oxygen to precipitate metals from an aqueous ionic solution of Sb, Ag, Pb and the like. The apparent alkaline potential is -0.8 to -0.9V (a solution of 10N-NaOH saturated with iron hydroxide), which is close to that at which hydrogen is generated. Therefore, when iron is heated, it releases hydrogen relatively quickly and is attacked by water, and at that time, black compounds of Fe3O4 are mainly produced.
Fe(s) + 2H+ = Fe2+ + H2(g)
(2)Fe(Ⅲ)/Fe(Ⅱ)系
Fe(Ⅲ)/Fe(Ⅱ)系の標準酸化還元電位を次に示す。
(2) Fe(Ⅲ)/Fe(Ⅱ) system
The standard redox potential of the Fe(Ⅲ)/Fe(Ⅱ) system is shown below.
1)酸性溶液
1N-HClO4の溶液中では見かけの電位はpHに関係なく 0.75Vである。0.01M溶液中ではpH 2のときのFe(OH)3が沈殿し、それからpHが増すとともに見かけの電位は急速に低くなる(図Ⅲ-5)。
〇各種の酸性溶液中での見かけの酸化還元電位:
1N-HCl:0.70V、1N-H2SO4:0.68V、1N-HNO3:0.73V、
2N-HClO4:0.75V、5N-H3PO4:0.44V(pH = 0)
酸性溶液中で起こるFe3+による酸化やFe2+による還元の反応の多くはFe(Ⅲ)/Fe(Ⅱ)系のpHによって説明できる。
1) Acidic solutions
In 1N-HClO4 solution, the apparent potential is 0.75V regardless of pH. In 0.01M solution, Fe(OH)3 at pH 2 precipitates, and then the apparent potential drops rapidly with increasing pH (Fig.III-5).
〇 Apparent redox potential in various acidic solutions:
1N-HCl: 0.70V, 1N-H2SO4: 0.68V, 1N-HNO3: 0.73V,
2N-HClO4: 0.75V, 5N-H3PO4: 0.44V (pH = 0)
Most of the reactions of oxidation by Fe3+ and reduction by Fe2+ that occur in acidic solutions can be explained by the pH of the Fe(Ⅲ)/Fe(Ⅱ) system.
〇H2Sに対する作用:
2Fe3+ + H2S = 2Fe2+ + S(s) + 2H+
〇ヨウ化物イオンに対する作用:
2Fe3+ + 2I– = 2Fe2+ + I2
〇第一スズ塩に対する作用:
2Fe3+ + Sn2+ = 2Fe2+ + Sn4+
〇チオ硫酸塩に対する作用:
2Fe3+ + 2S2O3– = 2Fe2+ + S4O62-
〇Action on H2S:
2Fe3+ + H2S = 2Fe2+ + S(s) + 2H+
〇 Action on iodide ion:
2Fe3+ + 2I– = 2Fe2+ + I2
〇 Action on stannous salt:
2Fe3+ + Sn2+ = 2Fe2+ + Sn4+
〇 Action on thiosulfate:
2Fe3+ + 2S2O3– = 2Fe2+ + S4O62-
〇空気の緩慢な作用:
4Fe2+ + O2(g) + 4H+ = 4Fe3+ + 2H2O
〇過マンガン酸の作用:
5Fe2+ + MnO4– + 8H+ = 5Fe3+ + Mn2+ + 4H2O
〇硝酸塩の作用:
2Fe2+ + NO3– + 2H+ = 2Fe3+ + NO2– + H2O
Fe2+ + HNO2 + H+ = Fe3+ + NO(g) + H2O
〇Slow action of air:
4Fe2+ + O2(g) + 4H+ = 4Fe3+ + 2H2O
〇Action of permanganate:
5Fe2+ + MnO4– + 8H+ = 5Fe3+ + Mn2+ + 4H2O
〇Nitrate action:
2Fe2+ + NO3– + 2H+ = 2Fe3+ + NO2– + H2O
Fe2+ + HNO2 + H+ = Fe3+ + NO(g) + H2O
2)アルカリ性溶液
pH14で見かけの電位は -0.7Vである。中性またはアルカリ性ではFe(Ⅲ)の酸化力はなくなり、逆にI2はFe2+を酸化し、NO3–はFe(OH)2によってNH4+にまで還元されるようになる。銀、水銀、ヒ素、ビスマス、アンチモンの塩は金属まで還元される。Fe(OH)2は急速に酸素を吸収して酸化し、まず緑色になり、次に(1-x)Fe(OH)2・xFe(OH)3(0 < x < 1)が生じて黒くなり、それから錆色のFe(OH)3へと移行する。
10N-NaOH溶液ではFeO22-(またはFe(OH)42-)は空気中で急速に酸化され、水溶液ではゆっくりと酸化されて、Fe(FeO2)2の黒色沈殿を生じる。次にClO–のような酸化剤を作用させるとFe(OH)3になる。
2) Alkaline solutions
Apparent potential at pH14 is -0.7V. Under neutral or alkaline conditions, Fe(III) loses its oxidizing power, conversely, I2 oxidizes Fe2+ and NO3– is reduced to NH4+ by Fe(OH)2. Salts of silver, mercury, arsenic, bismuth and antimony are reduced to metals. Fe(OH)2 rapidly absorbs oxygen and oxidizes, first becoming green, and then (1-x)Fe(OH)2・xFe(OH)3 (0 < x < 1) occurs and becomes black. And it shifts to rusty Fe(OH)3.
FeO22- (or Fe(OH)42-) is rapidly oxidized in air in 10N-NaOH solution and slowly in aqueous solution, resulting in black precipitation of Fe(FeO2)2. Next, when an oxidizing agent such as ClO– is applied, it becomes Fe(OH)3.
3)シアン化鉄(Ⅱ/Ⅲ)
フェロシアン化イオン(ferro:第一鉄)およびフェリシアン化イオン(ferri:第二鉄)は極めて安定な錯体で、図Ⅲ-4に酸化還元電位とpHの関係を示す。pH 4以下では、フェロシアン化物水素酸HFe(CN)62-が生成し、見かけの電位は増加する。フェリシアン化物はしばしば酸化剤として働くが、その強さは生じたフェロシアン化物が不溶性塩を形成して系外に除かられるのに比例して増大する。
3) Iron cyanides (II/III)
Ferocyanide ion (ferro: ferrous iron) and ferricyanide ion (ferri: ferric iron) are extremely stable complexes, and Fig.III-4 shows the relationship between redox potential and pH. Below pH 4, ferrocyanide hydride HFe(CN)62- is produced and the apparent potential increases. Although ferricyanide often acts as an oxidant, its strength increases in proportion to the resulting ferrocyanide forming an insoluble salt and being removed from the system.
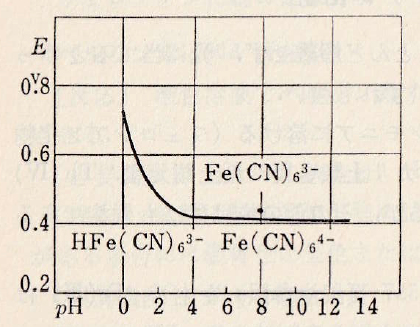
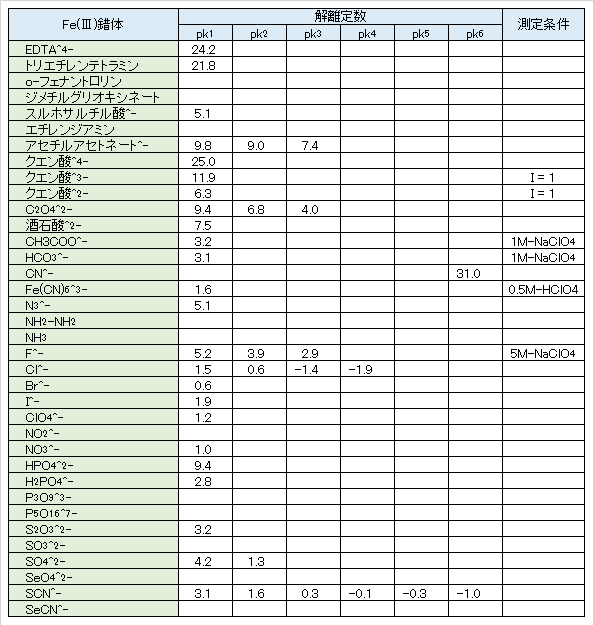
図Ⅲ-4 シアン化鉄(Ⅱ/Ⅲ)イオンの酸化還元系の見かけの電位とpHとの関係
Fig.III-4. Relationship between apparent potential of redox system of iron cyanide (II/III) ion and pH.
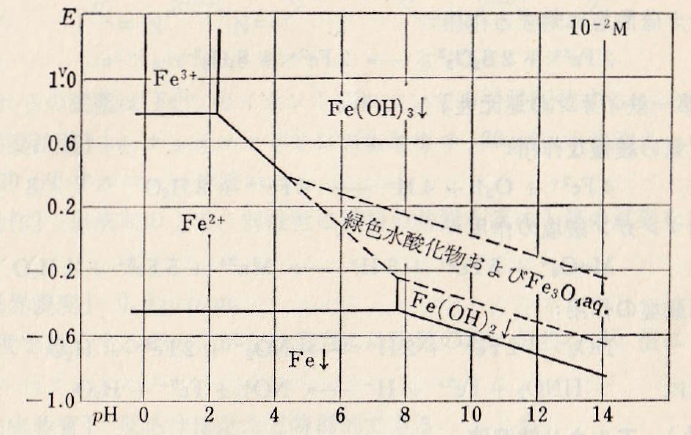
図Ⅲ-5 Feの酸化還元系の近似的な電位の見かけの電位とpHとの関係
Fig.III-5. Relation between pH and approximate apparent potential of redox system of Fe.
Ⅳ.鉄・マンガンの除去
(1)鉄・マンガン除去の意義
ここで示す水中の鉄・マンガンとは水中に溶解性だけでなく、コロイド状の鉄およびマンガンを含む。鉄・マンガンを並べて扱うのは両者が共存することが多いばかりでなく、用水への影響、由来および化学的性質、処理法などが類似しているからである。
鉄・マンガンは人体に必須な成分であるが、水に金属味を与えたり水に黄褐色~黒色の色を着け、いわゆる赤水・黒水の原因となる。この場合、鉄が多ければ黄赤~赤褐色を呈し、マンガンが多ければ黒褐~黒色を呈する。このような水は飲料に適しないばかりでなく、製氷・繊維・染色・クリーニング・醸造・清涼飲料・食品などお多くの工業にとって障害となる。そこで、鉄 0.3mg/L、マンガン 0.05mg/Lを採用している国が多い。もっとも、我が国ではマンガンの基準が 0.3mg/Lとなっているが水道法では 0.05mg/Lを基準としている。このようにマンガンの基準が厳しいのは、たとえ微量のマンガンでも塩素消毒によって酸化され、パイプ内付着蓄積したのち水流の急変によって流出するからである。
商業用水に対する鉄・マンガンの限界値は業種によって大きく異なるが一例を示すと表Ⅳ-1のとおりである。
また、鉄・マンガンの多い水には、鉄バクテリアが発生し、管壁に鉄・マンガンの酸化物をスケール状に蓄積して、通水能力著しく減少させる他、これが流出して赤水や異臭味の原因となる。一方、このような水をイオン交換樹脂に通水すると樹脂をコーティングして交換能力を劣化させる。
Ⅳ. Removals of iron and manganese
(1) Significance of removing iron and manganese
The iron and manganese in water shown here are not only soluble in water but also contain colloidal iron and manganese. Iron and manganese are treated side by side not only because they often coexist but also because they have similar effects on water, origin and chemical properties, and treatment methods.
Iron and manganese are essential components for the human body, but they give a metallic taste to water or give water a tan to black color, causing so-called red water and black water. In this case, if the amount of iron is large, the color is yellow red to reddish brown, and if the amount of manganese is large, the color is black brown to black. Not only is such water unsuitable for beverages, but it is an obstacle to many industries such as ice making, textiles, dyeing, cleaning, brewing, soft drinks and food. Therefore, many countries have adopted iron 0.3 mg/L and manganese 0.05 mg/L. However, in Japan, the standard for manganese is 0.3 mg/L, but the Water Supply Act uses 0.05 mg/L as the standard. The reason why the manganese standard is strict is that even a trace amount of manganese is oxidized by chlorine disinfection, accumulated in the pipe, and then flows out due to a sudden change in the water flow.
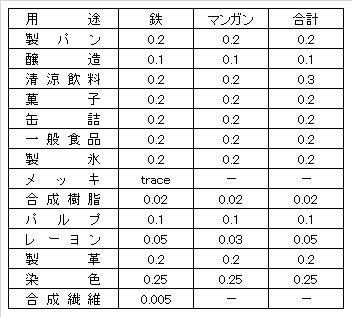
The limit values of iron and manganese for commercial water vary greatly depending on the type of industry, but an example is shown in Table IV-1.
In addition, iron bacteria are generated in water rich in iron and manganese, and oxides of iron and manganese accumulate on the pipe wall in a scale form, significantly reducing the water flow capacity, and this also flows out to cause red water and an offensive taste. On the other hand, when such water is passed through the ion exchange resin, the resin is coated and the exchange ability is deteriorated.
Table IV-1. Example of limit values for iron and manganese in industrial water (mg/L).
(2)由来と形態
鉄・マンガンが比較的多量に溶存している水は、地下水・貯水池や湖沼の底層水・鉱山廃水や酸性河川・泥炭地の水・都市近傍の汚濁河川などに見られる。また、鉄管内に対流した水にも鉄が検出されることがある。
自然水の鉄は元たどれば岩石や土壌からきたものである。すなわち鉄はマグ寝た井戸(Fe3O4)、ヘマタイト(FeO3)、リモナイト(2Fe2O3・3H2O)、パイライト(FeS2)、シデライト(FeCO3)などから、またマンガンはマンガナイト(MnOOH)、ピロルサイト(MnO2)、ハンスマンナイト(Mn2O3)、ロドクロサイト(MnCO3)、アラバンダイト(MS)が還元されて溶出したものと考えられる。たとえば、雨水は地下浸透する際に、土壌中の有機物分解によって酸素が奪われ、反対に生じた多量の炭酸ガスが与えられるが、このような無酸素条件下において有機物や硫化水素による還元作用が働くと土壌中の鉄・マンガンの酸化物は還元されてFe2O3 → FeCO3 → FeCO3となり溶存するようになる。貯水池や湖沼の底層水中の鉄・マンガンもこのようなメカニズムで溶出するものと考えられる。
また、鉱山廃水や酸性河川の鉄・マンガンは硫酸などの強酸によって鉱石中の鉄・マンガンが溶解されたもので硫酸第一鉄の形で溶存する。
一方、都市河川近傍の汚濁河川や泥炭中の鉄・マンガンは有機物と結びついた錯塩で、いわゆる有機鉄・有機マンガンとよばれている。存在状態は十分明らかでないがいずれも安定したコロイドでフミン酸やフルボ酸とキレートを形成していると思われる。
鉄管内の水にみられる鉄はいうまでもなく鉄管から溶出したものであるが、炭酸の多い水やアルカリ度が小さくpHの低い水など特に溶かしやすい、また水温の高い水を鉄と接触させると大量の鉄が溶出する。最近の国内では、水道管にはダクタイル鋳鉄管、ステンレル鋼管、樹脂ライニング鋼管や樹脂管などが用いられ、このような赤水・黒水のような事例は極めて少なくなっている。
(2) Origin and form
Water containing relatively large amounts of iron and manganese is found in groundwater, bottom water of reservoirs and lakes, mine wastewater, acidic rivers, peatland water, and polluted rivers near cities. Iron may also be detected in the water convected in the iron pipe.
Naturally, iron in natural water comes from rocks and soil. That is, iron is from mug wells (Fe3O4), hematite (FeO3), limonite (2Fe2O3・3H2O), pyrite (FeS2), siderite (FeCO3), and manganese is manganite (MnOOH), pyrrolcite (MnO2), It is considered that Hansmannite (Mn2O3), rhodochrosite (MnCO3), and arabandite (MS) were reduced and eluted. For example, when rainwater infiltrates underground, oxygen is depleted due to the decomposition of organic matter in the soil, and on the contrary, a large amount of carbon dioxide gas is generated. When it works, the oxides of iron and manganese in the soil are reduced and dissolved as Fe2O3 → FeCO3 → FeCO3. It is thought that iron and manganese in the bottom water of reservoirs and lakes also elute by this mechanism.
In addition, iron and manganese in mine wastewater and acidic rivers are those in which iron and manganese in ores are dissolved by strong acids such as sulfuric acid, and are dissolved in the form of ferrous sulfate.
On the other hand, iron and manganese in polluted rivers and peat near urban rivers are complex salts combined with organic matter, and are called organic iron and organic manganese. The state of existence is not sufficiently clear, but it is thought that they are all stable colloids and form chelates with humic acid and fulvic acid.
Needless to say, the iron found in the water in the iron pipe was eluted from the iron pipe, but it is particularly easy to dissolve water with high carbonic acid and water with low alkalinity and low pH. And a large amount of iron elutes. In recent years, ductile cast iron pipes, stainless steel pipes, resin-lined steel pipes and resin pipes are used for water pipes, and such cases of red water and black water are extremely rare.
(3)処理法
1)酸化・沈殿・ろ過法
酸化にはpH調整(アルカリ添加)、エアレーション、塩素添加(塩素ガス、次亜塩素酸ナトリウム)、過マンガン酸化カリウム添加などの中から1つまたは2つを選択・併用する。ただし、ケイ酸の多い水(Si:50mg/L以上)にエアレーションを行うとコロイド状の微細粒子となり、沈殿・ろ過で除去できなくなるので注意を要する。沈殿は普通沈殿の他、硫酸アルミニウムなどを注入する凝集沈殿法が用いられる。なお、有機鉄を除去するには酸または大量の凝集剤を注入してpHを下げる必要がある。また、水中の鉄・マンガンが少ない時は沈殿工程を省くことができる。ろ過は通常急速ろ過であるが、特殊ろ過が用いられることもある。
(3) Treatment method
1) Oxidation/precipitation/filtration method
For oxidation, select or use one or two of pH adjustment (addition of alkali), aeration, addition of chlorine (chlorine gas, sodium hypochlorite), addition of potassium permanganate, etc. However, it should be noted that when aerated with water containing a large amount of silicic acid (Si: 50 mg/L or more), it becomes colloidal fine particles that cannot be removed by precipitation/filtration. For precipitation, in addition to ordinary precipitation, a coagulation precipitation method of injecting aluminum sulfate or the like is used. In order to remove organic iron, it is necessary to inject acid or a large amount of coagulant to lower the pH. Further, when the amount of iron and manganese in the water is small, the precipitation step can be omitted. Filtration is usually rapid filtration, but special filtration may also be used.
2)接触ろ過法
特殊なろ材、たとえば、オキシ水酸化鉄(FeOOH)やマンガン砂などを用いてろ過する方法である。この場合、ろ材は一種の触媒としての働きを発揮し空気や塩素などの酸化剤を併用するとことによって、連続的にマンガンを除去できる。大量の水を確実かつ経済的に処理することが可能となる。
2) Contact filtration method
This is a method of filtration using special filter media such as iron oxyhydroxide (FeOOH) and manganese sand. In this case, the filter medium acts as a kind of catalyst, and by using an oxidizing agent such as air or chlorine together, manganese can be continuously removed. It is possible to treat a large amount of water reliably and economically.
3)鉄バクテリア法
鉄バクテリアを用いて鉄・マンガンを除去する方法である。薬品が要らず、また機能が安定しているので管理が容易であるが、大規模な水道や地表水の処理には向かない。
3) Iron bacteria method
This is a method of removing iron and manganese using iron bacteria. It is easy to manage because it does not require chemicals and its function is stable, but it is not suitable for large-scale water and surface water treatment.
4)イオン交換法
イオン状の鉄・マンガンをイオン交換体で除去することができる。イオン交換体としては無機ゼオライト、炭質ゼオライト、イオン交換樹脂などがある。ただし、除鉄だけの目的で用いられることはほとんどなく、硬水軟化や純水製造などの工程において用いられる。
なお、ゼオライトにマンガンの高級酸化物を付着させた、いわゆるマンガンゼオライトを用いて鉄・マンガンを除去する方法があるが、これは接触酸化法とイオン交換法の中間で本法の一変形と見なせる。
4) Ion exchange method
Ionic iron and manganese can be removed with an ion exchanger. Examples of ion exchangers include inorganic zeolite, carbonaceous zeolite, and ion exchange resin. However, it is rarely used for the purpose of removing iron only, and is used in processes such as water softening and pure water production.There is a method of removing iron and manganese by using so-called manganese zeolite in which a higher oxide of manganese is attached to zeolite, which can be regarded as a modification of this method between the catalytic oxidation method and the ion exchange method.
5)鉄・マンガンの封鎖
これは除去法ではないが、ポリリン酸塩(ヘキサメタリン酸塩)を注入すると鉄・マンガンは酸化されがたい錯塩を形成するので赤水・頃水の障害を防ぐことができる。この場合縮合ポリリン酸塩は鉄・マンガンが溶解している時点で注入し、よく混合する必要がある。空気や塩素酸化されたのちに注入したのでは効果はない。注入率は鉄・マンガンの約10倍程度を必要とする。
5) Blockage of iron and manganese
This is not a removal method, but when polyphosphate (hexametaphosphate) is injected, iron/manganese forms a complex salt that is difficult to oxidize, so it is possible to prevent damage to red water and surrounding water. In this case, the condensed polyphosphate needs to be injected and mixed well when iron and manganese are dissolved. It is not effective if injected after being oxidized with air or chlorine. The injection rate is about 10 times that of iron and manganese.
Ⅴ.測定法方法
クロム・マンガン・鉄の公定測定方法には、1) 吸光光度法、2) 原子吸光法、3) ICP発光分光分析法および 4) ICP質量分析法の4方式があり、さらに、原子吸光法は 2-1) フレーム原子吸光法と2-2) 電気加熱原子吸光法の2方式がある。
これらの公定測定法の概要と特徴の特徴については、カドミウム・鉛・亜鉛についてのページで説明したので省略する。しかし、上記カドミウムなどの金属は水中ではⅡ価状態であるのに対し、クロム・マンガン・鉄は環境条件(pHおよび酸化還元電位)により価数が変化するとともに共存成分の影響も大きいので、測定方法も煩雑となる。
なお、学生さんや初心者は、検水の前処理や濃縮操作を記載した別ページを参照して、本解説を読んでいただきたい。
JIS K 0102 の検索・閲覧の方法:別ページに記載してある。
V. Quantitative measurements
There are four official methods for measuring chromium, manganese, and iron: 1) absorptiometry, 2) atomic absorption spectrometry, 3) ICP emission spectroscopy, and 4) ICP mass spectrometry. Atomic absorption spectrometry is 2-1) flame atomic absorption and 2-2) electrically heated atoms.
The outline and characteristics of these official measurement methods have been explained on the page about cadmium, lead and zinc, so they are omitted here. However, while metals such as cadmium described above are in a valence II state in water, chromium, manganese, and iron have valences that vary depending on environmental conditions (pH and redox potential), and coexisting components have a large effect. The method also becomes complicated.
For students and beginners, please read this explanation by referring to another page that describes the pretreatment and concentration procedures for test water.
How to search and browse JIS K 0102: See another page.
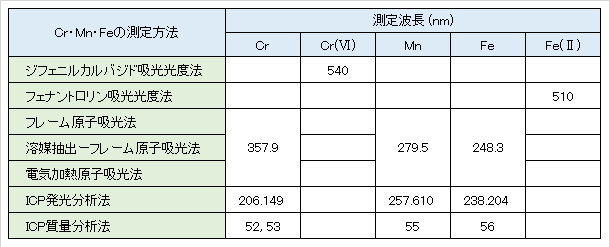
1.クロムの定量測定
環境水など通常の酸化還元状態・中性付近の水中の元素Crは、化学的性質の図Ⅰ-2に示すように、CrはCr2Cr72-またはCrO42-としてCr(Ⅵ)の形態で存在する。中性水中では、図Ⅰ-1に示すようにCr(Ⅲ)は水酸化物を形成し、水中に溶存しているその濃度は極めて低い。しかし、Cr(Ⅵ)は健康項目に指定されており、環境や水道水中の水質基準は厳しく(表Ⅰ-1)、0.05mg/L(1μmol/Lレベル)である。この基準濃度は、中性水中のCr(Ⅲ)水酸化物の溶解度レベルであり、さらに、この水酸化物はコロイド状で存在するケースが多く、これを無視できない測定領域である。
Cr(Ⅵ)の公定測定方法として、全Cr(以下、Crと略称する)と同じ方式が採用され、測定原理や定量範囲も同じである。Cr(Ⅵ)測定方法はCr(VI)をだけを対象としているのに対し、Cr測定法はCr(III)とCr(VI)の合計量を対象とする。Cr(Ⅵ)だけを測定する場合には、吸光光度法では検水を直接発色させればよい。しかし、CrおよびCr(VI)を測定する場合には、次の2つの操作が必要となる。まず、Cr(III)を酸化してCr全量をCr(VI)の形態にして測定する。次に、Cr(III)を除去した後、Cr(VI)のみを測定する。Cr(Ⅲ)の除去にはアルカリを加えてその水酸化物としての沈殿分離のみでは不十分で、Fe(Ⅲ)との共沈法が適用される。元素Crの測定原理と定量操作は複雑であり、その水中での化学的挙動を十分に理解する必要がある。
環境水・水道水あるいは工場排水についてのCr測定方法においては、その調査目的とその濃度レベルから選定する。コスト等の観点からは、多元素同時測定を行うことが望ましい。
Cr(Ⅵ)のみを測定するには、1) ジフェニルカルバジド吸光光度法を用いる。他元素との同時分析の場合は、2) ICP発光分光分析法を用いる。高感度が必要な場合は、3) ICP質量分析法を用いる。妨害物質が少ない試料の高感度測定を行う場合は、4) 電気加熱原子吸光法を用いてもよい。特定事業場や最終処分場など、比較的濃度が高い場合は、操作の簡便な 5) フレーム原子吸光法を用いる。
いずれの測定法においても、検水の適切な前処理が必要である。特に、上記の2)~5)法によってCr(Ⅵ)測定をする際に、Cr(III)が共存すれば、その除去操作が必要となる。環境水や水道水などで、Cr濃度が低く妨害成分が共存する場合には、溶媒抽出などの分離・濃縮操作が必要となることがある。
1. Quantitative measurement of chromium
Environmental water, such as elemental Cr in normal redox state and near neutral water, exists in the form of Cr(Ⅵ) as Cr2Cr72- or CrO42-, as shown in Fig.1-2 of the chemical properties. In neutral water, Cr(III) forms hydroxides as shown in Fig.I-1, and the concentration of Cr(III) dissolved in water is extremely low. However, Cr(VI) is specified as a health item, and the water quality standards for environment and tap water are strict (Table I-1) and 0.05 mg/L (1 μmol/L level). This concentration is the solubility level of Cr(III) hydroxide in neutral water, and this hydroxide is often present in colloidal form, which is a measurement region that cannot be ignored.
As the official measurement method of Cr(VI), the same method as all Cr (hereinafter abbreviated as Cr) is adopted, and the measurement principle and the quantitative range are also the same. The Cr(VI) measurement method targets only Cr(VI), whereas the Cr measurement method targets the total amount of Cr(III) and Cr(VI). When only Cr(VI) is measured, the test water may be directly colored by the absorptiometric method. However, When measuring Cr and Cr(VI), the following two operations are required. First, Cr(III) is oxidized to measure the total amount of Cr in the form of Cr(VI). Next, after removing Cr(III), only Cr(VI) is measured. In order to remove Cr(III), it is not sufficient to add an alkali and precipitate and separate it as a hydroxide, and the coprecipitation method with Fe(III) is applied. The measurement principle and quantitative operation of elemental Cr are complicated, and its chemical behavior in water needs to be fully understood.
When selecting Cr for environmental water, tap water, or factory wastewater, select it based on the survey purpose and its concentration level. From the viewpoint of cost and the like, it is desirable to perform multi-element simultaneous measurement.
To measure only Cr(VI), use the diphenylcarbazide absorptiometry. For simultaneous analysis with other elements, use 2) ICP emission spectroscopy. If high sensitivity is required, use 3) ICP mass spectrometry. When performing highly sensitive measurements on samples with few interfering substances, 4) electric heating atomic absorption method may be used. If the concentration is relatively high, such as at a specific business site or final disposal site, use the 5) flame atomic absorption method because it is easy to operate.
Appropriate pretreatment of test water is required for all measurement methods. In particular, when Cr(VI) is measured by the above methods 2) to 5), if Cr(III) coexists, it is necessary to remove it. In environmental water or tap water, when Cr concentration is low and interfering components coexist, separation/concentration operations such as solvent extraction may be necessary.
Table V-1-1-1. Legal measurement method and quantitative range of total chromium.
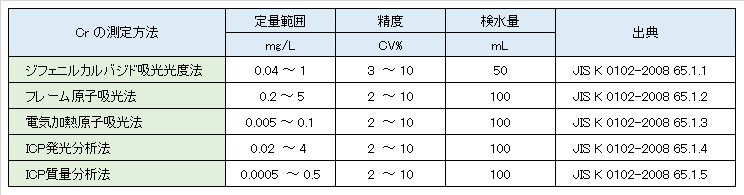
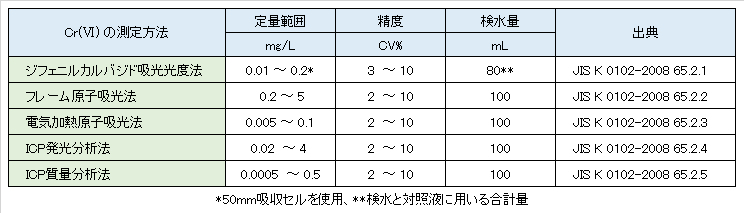
Table V-1-2. Legal measurement method and quantitative range of chromium (VI).
(1)検水の保存と前処理
1)保存
検水は、無処理で0~10℃の暗所に保存
2)前処理
a) 別ページ(重金属-定量分析の前処理)の1.金属成分溶出 (1)/(2)または2.有機物の分解(2)に沿って前処理を行う。
ただし、塩酸及び過塩素酸は使用しない。塩化物イオンとCr(VI)が共存すると加熱処理中に二塩化二酸化クロム(VI)(塩化クロミル、CrO2Cl2)となり、揮散するおそれがある。
b) Cr濃度が低く、有機物や懸濁物質がほどんどない検水中のCr(Ⅵ)を測定する場合には、Cr(Ⅲ)の除去にFe(III)共沈法を適用する。このCr(Ⅲ)除去法を用いた場合は、ジフェニルカルバジド吸光光度法で測定する。
c) Fe、その他の妨害元素が多い検水には、クペロンによる抽出法を適用する。この抽出法を用いた場合は、ジフェニルカルバジド吸光光度法で測定する。
d) Crの濃度が低く、Na、K、Mg、Caの濃度が高い検水には、トリオクチルアミンによる抽出法を適用する。この抽出法は、ICP発光分光分析法または、フレーム原子吸光法の前処理に用いることができる。
Al(Ⅲ)、Fe(Ⅲ)など、多くの金属(Ⅲ)イオンと安定な錯体M(クペレート)3を形成して水に不溶となるが(表Ⅰ-2)、有機溶媒に溶解する。Cr(Ⅵ)は酸性ではCr2O72-と、中性・アルカリ性ではCrO42-として存在し(図Ⅰ-2)、クペロンとは反応しない。
(1) Preservation and pretreatment of test water
1) Save
Untreated water is stored in the dark at 0-10℃
2) Pretreatment
a) Follow separate page (Heavy metals-pretreatment for quantitative analysis) : Pretreatment is carried out in accordance with 1. Metal component elution (1)/(2) or 2. Decomposition (2) of organic substances.
However, do not use hydrochloric acid or perchloric acid. When chloride ions and Cr(VI) coexist, chromium (VI) dichloride dichloride (chromyl chloride, CrO2Cl2) may be generated during the heat treatment and may volatilize.
b) When Cr(VI), in the test water with low Cr concentration and little organic matter and suspended solids, is measured, the Fe(III) coprecipitation method is applied to remove Cr(III). If this Cr(III) removal method is used, measure by the diphenylcarbazide absorptiometry.
c) Apply the extraction method with cuperon to test water containing a lot of Fe and other interfering elements. If this extraction method is used, use the diphenylcarbazide absorptiometry.
d) Extraction method using trioctylamine is applied to test water with low concentration of Cr and high concentration of Na, K, Mg and Ca. This extraction method can be used for pretreatment of ICP emission spectroscopy or flame atomic absorption spectrometry.
Although it forms insoluble complex M (cuperate)3 with many metal (III) ions such as Al(III) and Fe(III), it becomes insoluble in water (Table I-2), but it dissolves in organic solvents. Cr(VI) exists as Cr2O72- in acid and CrO42- in neutral/alkaline (Fig.I-2) and does not react with cuperone.
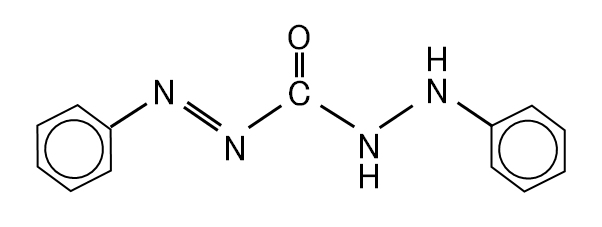
図Ⅴ-1-1 ジフェニルカルバジド(1,5-ジフェニルカルボノヒドラジド)
Fig. V-1-1. Diphenylcarbazide (1,5-diphenylcarbonohydrazide).
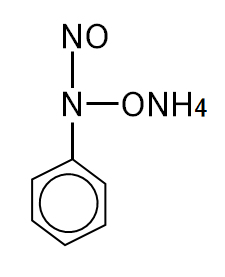
図Ⅴ-1-2 クペロン(N-ニトロソ-N-フェニルヒドロキシルアンミンアンモニウム塩)
Fig. V-1-1. Diphenylcarbazide (1,5-diphenylcarbonohydrazide).
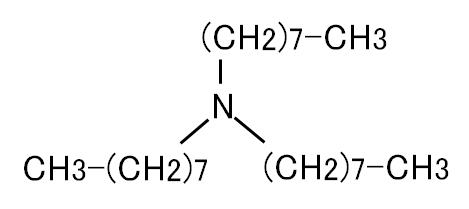
図Ⅴ-1-3 トリオクチルアミン(N,N-ジオクチルオクタンアミン)
Fig. V-1-3. Trioctylamine (N,N-dioctyloctaneamine).
(2)ジフェニルカルバジド吸光光度法
Cr(Ⅵ)の定量測定には、前述した他の4方法に加えて、ジフェニルカルバジド吸光光度法が規定されている。Cr(Ⅲ)とCr(Ⅵ)が混在する場合には、a) Cr(Ⅲ)を酸化してCr(Ⅵ)としてCrを測定し、次に、b) Cr(Ⅲ)を水酸化物沈殿として取り除き、Cr(Ⅵ)を測定する。
(2) Diphenylcarbazide absorptiometry
For the quantitative measurement oF Cr(VI), the diphenylcarbazide absorptiometry is specified in addition to the other four methods mentioned above. When Cr(III) and Cr(VI) are mixed: a) Cr(III) is oxidized to measure Cr as Cr(VI); b) Cr(III) is removed as hydroxide precipitate, and then Cr(VI) is measured.
1)概要
a) Cr(Ⅵ)の測定は、前処理した検水に直接発色液を加えて、その吸光度を測定する。
b) Crの測定においては、上記の方法で前処理した試料を硫酸酸性とし、過マンガン酸塩KMnO4を加えて加熱酸化してCr(Ⅲ)をCr(Ⅵ)にする。次に、加熱液を冷却した後、過剰のMnO4–を尿素 (NH2)2CO の存在下に亜硝酸ナトリウムNaNO2で還元してMn2+として無色の溶液とする。この溶液にジフェニルカルバジドを加えてCr(Ⅵ)と反応・発色させ、波長540nm付近の吸光度を定量する。
1) Outline
a) To measure Cr(VI), add the color-developing solution directly to the pretreated test water and measure its absorbance.
b) When measuring Cr, acidify the sample pretreated by the above method with sulfuric acid, add permanganate KMnO4 and oxidize by heating to convert Cr(III) to Cr(VI). Next, after cooling the heated liquid, excess MnO4– is reduced with sodium nitrite NaNO2 in the presence of urea (NH2)2CO3 to give a colorless solution as Mn2+. Diphenylcarbazide is added to this solution to react with Cr(VI) and develop color, and the absorbance at a wavelength of 540 nm is quantified.
2)Cr(Ⅵ)の定量操作
A) 検水の適量、Cr(Ⅵ)として 2∼50 μgを含む、例えば、25mLを 2個のビーカー(A)と(B)にとり、試料が酸性の場合には水酸化ナトリウム溶液(40g/L)で、また、アルカリ性の場合は硫酸(1+35)で中和する。
B) ビーカー(A)の溶液(測定液用)は、全量フラスコ 50 mL(A)に移し入れ、硫酸(1+9) 2.5mLを加える。
C) ビーカー(B)の溶液(対照液用)に硫酸(1+9) 2.5mLを加え、次にエタノール(95%)を少量加え、煮沸してCr(Ⅵ)をCr(Ⅲ)に還元し、過剰のエタノールを追い出す。放冷後、全量フラスコ 50mL(B)に移し入れる。
D) 全量フラスコ(A)・(B)を約 15℃に保ち、それぞれにジフェニルカルバジド溶液(10g/L)1mLずつを加え、直ちに振り混ぜ、水を標線まで加え、約5分間放置する。
E) 全量フラスコ(A)の一部を測定セルに、全量フラスコ(B)の一部を対照セルにそれぞれ移し、波長540nm付近の吸光度を測定する。
F) 同様な上記の操作によりCr標準液を用いて作成した検量線から、検水中のCr(Ⅵ)濃度を求める。
2) Quantitative operation of Cr(VI)
A) An appropriate amount of test water containing 2 to 50 μg of Cr(Ⅵ), for example, 25 mL is placed in two beakers (A) and (B), and if the sample is acidic, sodium hydroxide solution (40 g/ L) and, if alkaline, sulfuric acid (1+35).
B) Transfer the beaker (A) solution (for measurement solution) to a 50 mL volumetric flask (A) and add 2.5 mL of sulfuric acid (1+9).
C) Add 2.5 mL of sulfuric acid (1+9) to the beaker (B) solution (for control solution), then add a small amount of ethanol (95%) and boil to reduce Cr(VI) to Cr(III) and to drive off excess ethanol. After allowing it to cool, transfer it to a 50-mL volumetric flask (B).
D) Keep the volumetric flasks (A) and (B) at about 15°C, add 1 mL of diphenylcarbazide solution (10 g/L) to each, shake immediately, add water to the marked line, and leave it for about 5 minutes.
E) Transfer a part of the total volume flask (A) to the measurement cell and a part of the total volume flask (B) to the control cell, and measure the absorbance around the wavelength of 540 nm.
F) Determine the Cr(VI) concentration in the test water from the calibration curve prepared using the Cr standard solution by the same procedure as above.
3)Crの定量操作
A) 検水(2~5μgを含む)をビーカーにとり、硫酸(1+9) 3mLを加えて、加熱し白煙が生じたら、冷却して水30mLを加える。さらに加熱して溶液中の残留物を溶解する。
B) 静かに加熱し、過マンガン酸カリウム(3g/L)を1滴ずつ滴加する。溶液の赤い呈色が消えそうになったら、さらに過マンガン酸カリウムKMnO4を滴下し、常に赤みを保つようにして数分間煮沸する。[Cr(Ⅲ)を酸化してCr(Ⅵ)とし、全CrをCr(Ⅵ)とする。 ]
C) 数分間煮沸して、冷却する。冷却溶液には、MnO4–が赤みが残っていること。
D) 尿素 (NH2)2CO (200g/L) 10mLを加えた後、亜硝酸ナトリウムNaNO2(20g/L)を激しく掻き混ぜながら、赤みが消失するまで、1滴ずつ滴下する。(過剰のMnO4–をMn2+に還元する。)
E) 全量を50mLメスフラスコに移し、冷却して15℃に設定する。ジフェニルカルバジド(10g/L) 1mLを加えて直ちに振り混ぜる。
F) 標線まで水を加えて全量を50mLとして5分間静置したのち、一部の溶液を吸収セルに移して吸光度の測定を行う。
G) 空試験液として水約30mLをとり、硫酸(1+9) 30mLを加えた後、上記E)の操作を行って吸光度を測定し、検水の測定値を補正するか、または、これを対照セルに移して検水を測定する。
3) Quantitative operation of Cr
A) Place the test water (containing 2 to 5 μg) in a beaker, add 3 mL of sulfuric acid (1+9), and if heating causes white smoke, cool and add 30 mL of water. Further heating dissolves the residue in the solution.
B) Heat gently and add potassium permanganate (3g/L) drop by drop. When the red color of the solution is about to disappear, add more potassium permanganate KMnO4 and boil for a few minutes so that the redness is always maintained. [Cr(III) is oxidized to Cr(VI) and all Cr is Cr(VI). ]
C) Boil for a few minutes and cool. MnO4– should remain reddish in the cooling solution.
D) After adding 10mL of urea (NH2)2CO (200g/L), add sodium nitrite NaNO2 (20g/L) vigorously while adding it dropwise until redness disappears. (Reduces excess MnO4– to Mn2+.)
E) Transfer all the amount to a 50mL volumetric flask, cool and set to 15°C. Add 1 mL of diphenylcarbazide (10 g/L) and shake immediately.
F) Add water up to the marked line to bring the total volume to 50 mL and let stand for 5 minutes, then transfer a part of the solution to the absorption cell and measure the absorbance.
G) Take approximately 30 mL of water as a blank test solution, add 30 mL of sulfuric acid (1+9), and then perform the procedure in E) above to measure the absorbance and correct the measured value of the sample water, or use this as a control. Transfer to the cell and measure the test water.
4)共沈によるCr(Ⅲ)の除去
検水中にクロム(Ⅲ)が含まれるときは,次の操作により、Cr(Ⅲ)を水酸化物としてFe(Ⅲ)の水酸化物とともに共沈させ、ろ過して取り除く。
A) 試料の適量(500 mL以下)をとり、硫酸アンモニウム鉄(Ⅲ)溶液*(5mg/L)1mLを加えてかき混ぜる。
*鉄アンモニウムみょうばん:Fe(NH4)(SO4)2・12H2O 5gを硫酸(1+1) 1 mLに溶かし、水で 100 mLとしたもの。
B) アンモニア水(1+4)を加えて微アルカリ性とした後、アンモニア臭がほとんどなくなるまで静かに煮沸する。沸騰近くの温度に保って沈殿を熟成させ後、ろ紙5種Aでろ過し、温硝酸アンモニウム溶液(10 g/L)で洗浄する。(沈殿に付着したCrO42-を完全に洗い出す。)
C) ろ液と洗液とを合わせ、塩酸又は硝酸を加えて 0.1∼1 mol/Lの酸性溶液にして、測定液とする。
この酸性溶液は、吸光光度法のみでなく、他の方法によるCr(Ⅵ)の測定にも適用できる。
4) Removal of Cr(III) by coprecipitation
When chromium (III) is contained in the test water, Cr(III) is co-precipitated with hydroxide of Fe(III) as hydroxide by the following procedure and filtered to remove.
A) Take an appropriate amount (500 mL or less) of the sample and add 1 ml of ammonium iron(III) sulfate solution* (5 mg/L) and stir.
*Iron-ammonium alum: Add 5 g of Fe(NH4)(SO4)2·12H2O in 1 mL of sulfuric acid (1+1), and make it up to 100 mL with water.
B) After adding ammonia water (1+4) to make it slightly alkaline, boil gently until there is almost no ammonia odor. After keeping the temperature near boiling, aging the precipitate, filter with filter paper type 5A and wash with warm ammonium nitrate solution (10 g/L). (Completely wash out the CrO42- adhered to the precipitate.)
C) Combine the filtrate and the washing solution, add hydrochloric acid or nitric acid to make an acidic solution of 0.1 to 1 mol/L, and use this as the measurement solution.
This acidic solution can be applied not only to absorption spectrophotometry but also to Cr(VI) measurement by other methods.
5)留意事項
a) 前処理で多量の硫酸が添加されている場合には、加熱蒸発し、硫酸の白煙を発生させて硫酸を除去した後、硫酸(1+9) 3mLを加える。この硫酸白煙の発生の際には強熱してはならない。硫酸クロム(Ⅲ)の無水物が生成して、不溶化する。硫酸ナトリウム 20mg程度を加えておくと、不溶化を防ぐことができる。また、過塩素酸と硝酸で有機物を分解する方法は使用しない。塩化物イオンが共存するとクロムが二塩化二酸化クロム(CrO2Cl2、塩化クロミル)をとして揮散するおそれがある。
b) 発色時の硫酸濃度は、0.1mol/L程度が適当である。
c) 発色時の液温は約15℃に保つ。発色は 2~3分程度で最高になり、その後、徐々に退色するが、5~15分程度ほとんど一定である。
d) ジフェニルカルバジド溶液の調整にはアセトンが用いられている。ジフェニルカルバジドを溶液を添加したら、直ちに振り混ぜて、高濃度アセトンによるCr(Ⅵ)の還元を防止する。
e) モリブデン、バナジウム、水銀などが妨害する。モリブデンは 0.1mgまで影響しない。水銀は塩化物イオンを添加することによって妨害を回避できる。また、バナジウムは発色後、10~15分経過してから吸光度を測定すれば、その影響は無視できる。
f) 検水が鉄を含む場合には、鉄が増えてくるにつれて吸光度は低下するが、発色液50mL中約1mgで一定となる(約 20%低下する)。このことから、あらかじめ一定量の鉄を加えて、検量線の作成および検水の測定を行う。
あるいは、ジフェニルカルバジド添加前に、二リン酸ナトリウム溶液(同水和物Na2HPO4・12H2O 5gを水に溶かして 100mLとする)2mLを加えると、鉄 2.5mgまでは影響しない。鉄がクロムより少ない場合には、無視してよい。
鉄、その他の妨害が多いばあにはクペロン抽出法によって鉄などを除去する。
g) クロムの濃度が低く、有機物および懸濁物がほとんど含まれていない場合には、500mL以下の検水をとり、検水 100mLにつき硫酸 2mLを加えて加熱し、煮沸して放冷する。これに硫酸アンモニウム鉄(Ⅱ)(5mg/L、FeNH4(SO4)2・6H2Oの3.5gを硫酸 5~7滴を加えた水 100mLに溶かしたもの)1mLを加えてよくかき混ぜ、さらに硝酸 2mLを加えて、煮沸して鉄(Ⅱ)を酸化する。この溶液をしばらく放置した後、アンモニア水(1+4)を加えて中和し、アンモニア臭を認めなくなるまで煮沸し、約 80℃に約 20分間保ち、水酸化鉄(Ⅲ)の沈殿を熟成する。
沈殿をろ紙 5種Aを用いてろ別し、温硝酸アンモニウム溶液(10g/L)で 5~7回、ろ紙上の沈殿を洗浄する。残存する沈殿に硫酸(1+5) 5mLを加えて溶かし、ろ紙は温水で洗い、以下、3) Crの定量操作-B)に示す過マンガン酸化リム滴下以降の操作を行う。ただし、検量線を作成する場合には、標準液にそれぞれFe(Ⅲ) 5mgを加えておく。
5) Notes
a) If a large amount of sulfuric acid was added in the pretreatment, evaporate by heating to generate white smoke of sulfuric acid to remove sulfuric acid, and then add 3 mL of sulfuric acid (1+9). Do not ignite when generating this white smoke of sulfuric acid. Anhydrous chromium (III) sulfate is formed and becomes insoluble. Insolubilization can be prevented by adding about 20 mg of sodium sulfate. Also, the method of decomposing organic matter with perchloric acid and nitric acid is not used. When chloride ions coexist, chromium may volatilize as chromium dichloride chromium dioxide (CrO2Cl2, chromyl chloride).
b) Appropriate concentration of sulfuric acid at the time of color development is about 0.1mol/L.
c) Keep the liquid temperature at about 15℃ during color development. Color development reaches its maximum in about 2 to 3 minutes, and then gradually fades, but is almost constant for about 5 to 15 minutes.
d) Acetone is used to prepare the diphenylcarbazide solution. Immediately after adding the solution of diphenylcarbazide, shake to prevent reduction of Cr(VI) by concentrated acetone.
e) Molybdenum, vanadium, mercury, etc. interfere. Molybdenum has no effect up to 0.1 mg. Mercury can avoid interference by adding chloride ions. The effect of vanadium can be neglected if the absorbance is measured 10 to 15 minutes after color development.
f) When the test water contains iron, the absorbance decreases as the amount of iron increases, but it becomes constant at about 1 mg in 50 mL of the coloring solution (decrease by about 20%). Therefore, a certain amount of iron is added in advance to prepare a calibration curve and measure water.
Alternatively, add 2 mL of sodium diphosphate solution (dissolve 5 g of the same hydrate Na2HPO4·12H2O in water to make 100 mL) before adding diphenylcarbazide, and iron up to 2.5 mg will not be affected. If iron is less than chromium, it can be ignored.
Remove iron, etc. by the cuperon extraction method if there is much interference.
g) When the concentration of chromium is low and almost no organic matter or suspension is contained, take 500 mL or less of test water, add 2 mL of sulfuric acid to 100 mL of test water, heat, boil, and allow to cool. To this, add 1 mL of ammonium iron(II) sulfate (5 mg/L, 3.5 g of FeNH4(SO4)2·6H2O dissolved in 100 mL of water containing 5 to 7 drops of sulfuric acid), stir well, and add 2 mL of nitric acid. And boil it to oxidize iron (II). After leaving this solution for a while, neutralize it by adding aqueous ammonia (1+4), boil it until no smell of ammonia is observed, and keep it at about 80℃ for about 20 minutes to age the iron (III) hydroxide precipitate. To do.
The precipitate is filtered off using filter paper type 5A, and the precipitate on the filter paper is washed 5 to 7 times with warm ammonium nitrate solution (10 g/L). To the remaining precipitate, add 5 mL of sulfuric acid (1+5) to dissolve it, wash the filter paper with warm water, and perform the addition of permanganese oxide described in the step B) of 3) Cr quantitative operation and do the steps C) to G). However, when preparing a calibration curve, add 5 mg of Fe(III) to each standard solution.
(3)フレーム原子吸光法
1)概要
前処理した検水をアセチレン-空気フレーム中に噴霧し、クロムによる原子吸光を波長357.9nmで測定して定量する。
Crを求める場合には、上記(2) ジフェニルカルバジド吸光光度法で記載した硫酸酸性で過マンガン酸によりCr(Ⅲ)をCr(Ⅵ)に酸化して測定する。Cr(Ⅵ)は、上記(2)-4) 共沈によるCr(Ⅲ)を除去した検水を原子吸光測定して、Cr(Ⅵ)を定量する。
(3) Flame atomic absorption method
1) Outline
Spray the pretreated test water in an acetylene-air flame and measure the atomic absorption by chromium at a wavelength of 357.9 nm for quantification.
When Cr is obtained, it is measured by oxidizing Cr(III) to Cr(VI) with permanganic acid under the sulfuric acid acidity described in (2) Diphenylcarbazide absorptiometry. As for Cr(VI), Cr(VI) is quantified by atomic absorption measurement of the test water from which Cr(III) was removed by coprecipitation in (2)-4) above.
2)操作
前処理した検水を 0.1~1mol/Lの塩酸または硝酸酸性の一定量の溶液として、原子吸光分析装置のフレーム中に噴霧する。
2) Operation
Spray the pretreated sample water into the flame of the atomic absorption spectrometer as a fixed amount of 0.1 to 1 mol/L hydrochloric acid or nitric acid.
3)溶媒抽出―原子吸光法
Cr(Ⅵ)は第4級アンモニウムイオンと安定なイオン対を形成し、MIBKや酢酸ブチルに抽出される。
Cr濃度が低い検水に抽出を妨害する物質が含まれていない場合には、Cr(Ⅲ)は酸化剤によってCr(Ⅵ)に酸化した後、トリオクチルアミン-酢酸ブチル溶液による溶媒抽出を行ってCrを濃縮した後、原子吸光を測定する。
A) 検水の適量を 100mLのビーカーにとり、硫酸(1+2) 2mLを加え、過マンガン酸カリウム溶液(3g/L)を 5~7滴、滴下して加熱する。過マンガン酸イオンの色が消えそうになったら、さらに上記過マンガン酸溶液を滴下し、常に検水溶液の色が微赤を保つように 5~7分間煮沸する。
B) 流水で冷却し、これを分液漏斗に移し、水を加えて約 100mLとする。トリオクチルアミンの酢酸ブチル溶液(30g/L) 20mLを加え、約10分間激しく振り混ぜた後、放置してブチル相(上層)と水相(下層)に分離させる。
C) ブチル相を取り出し、そのままフレームに噴霧して、原子吸光度を測定してCrを定量する。
抽出溶媒として酢酸ブチルの代わりに、4-メチル-2-ペンタン(MIBK)を用いてもよい。
3) Solvent extraction – Atomic absorption method
Cr(VI) forms a stable ion pair with quaternary ammonium ions and is extracted with MIBK and butyl acetate.
If the sample water containing a low concentration of Cr does not contain any substances that interfere with extraction, Cr(III) is oxidized to Cr(VI) by an oxidizing agent and then solvent extracted with a trioctylamine-butyl acetate solution. After concentrating Cr by the solvent extraction, the atomic absorption is measured.
A) Transfer an appropriate amount of test water to a 100mL beaker, add 2mL of sulfuric acid (1+2), add 5 to 7 drops of potassium permanganate solution (3g/L) and heat. When the color of permanganate ion is about to disappear, further drop the above permanganate solution and boil for 5 to 7 minutes so that the color of the test solution always remains slightly red.
B) Cool with running water, transfer to a separatory funnel, and add water to make approximately 100 mL. Add 20 mL of a solution of trioctylamine in butyl acetate (30 g/L), shake vigorously for about 10 minutes, and then leave it to separate into a butyl phase (upper layer) and an aqueous phase (lower layer).
C) Take out the butyl phase, spray it directly onto the flame, and measure the atomic absorption to quantify Cr.
4-methyl-2-pentane (MIBK) may be used as the extraction solvent instead of butyl acetate.
4)留意事項
a) アセチレン-空気フレームでは、多燃料フレームに設定すると感度は高くなるが、Fe、Niなどの共存成分による干渉も増加する。硫酸ナトリウム、二硫酸カリウム、またはふっ化水素アンモニウムを1%程度添加するとよい。
小燃料フレームでは、感度はかなり減少するが、共存成分による干渉も小さくなる。また、アセチレン-一酸化二窒素フレームでは妨害の大部分は解消する。
b) フレーム中のクロム原子の分布は一様でないので、バーナーを上下させて、最高の吸光度の一に設定する。
4) Notes
a) In the acetylene-air frame, the sensitivity becomes higher when the multi-fuel frame is set, but interference due to coexisting components such as Fe and Ni also increases. It is advisable to add sodium sulfate, potassium disulfate, or ammonium hydrogen fluoride at about 1%.
In a small fuel frame, the sensitivity is considerably reduced, but the interference by coexisting components is also small. Also, the acetylene-nitrous oxide flame eliminates most of the interference.
b) Since the distribution of chromium atoms in the frame is not uniform, move the burner up and down to set it to one of the highest absorbances.
(4)電気加熱原子吸光法
1)概要
前処理した検水を0.1~1mol/Lの硝酸酸性の一定量の溶液とし、その一定量(例えば、10~50μL)をマイクロピペットで発熱体に注入し、乾燥(100~120℃、30~40秒)したのち、灰化(500~600℃、30~40秒)し、次に原子化(2,400~2,900℃、5~10秒)し、波長357.9nmの吸光度を測定してクロムを定量する。
(4) Electric heating atomic absorption method
1) Outline
Pre-treated test water is used as a fixed amount of 0.1 to 1 mol/L nitric acid, and a fixed amount (eg, 10 to 50 μL) is injected into the heating element with a micropipette and dried (100 to 120°C, 30 to After 40 seconds), ash (500 to 600°C, 30 to 40 seconds), then atomize (2,400 to 2,900°C, 5 to 10 seconds), and measure the absorbance at a wavelength of 357.9 nm to quantify chromium.
2)注意事項
a) この測定法は簡便なものであるが、共存する酸、塩基、アルカリ・アルカリ土類金属の影響を受けるので、これらの共存成分が少ない検水に適用する。
b) 乾燥・灰化・原子化の条件は、装置によって異なる。また、検水の注入量や共存塩類によっても異なることがある。
2) Notes
a) This measurement method is simple, but since it is affected by coexisting acids, bases, and alkali/alkaline earth metals, it should be applied to water samples containing few coexisting components.
b) Drying, ashing and atomization conditions vary depending on the equipment. Also, it may differ depending on the injection amount of test water and coexisting salts.
(5)ICP発光分光分析法
前処理した検水を、0.1~0.5mol/Lの塩酸または硝酸酸性の一定量の溶液とし、検水導入部を通してICP中に導入して、Crによる発光を波長206.149nmで測定・定量する。
Cr濃度が低い場合には、上記(3) フレーム原子吸光法の3)溶媒抽出-原子吸光法に準じて抽出操作し、有機相をプラズマ中に導入して定量してもよい。この場合、プラズマトーチとして有機溶媒用を用いる。
(5) ICP emission spectroscopy
The pretreated test water is used as a solution of 0.1 to 0.5 mol/L hydrochloric acid or nitric acid, and is introduced into the ICP through the test water introduction part, and the emission of Cr is measured and quantified at a wavelength of 206.149nm.
When the Cr concentration is low, extraction may be carried out in accordance with the above 3) Solvent extraction-atomic absorption method in (3) Flame atomic absorption method, and the organic phase may be introduced into plasma for quantification. In this case, a plasma torch for an organic solvent is used.
(6)ICP質量分析法
検水を前処理し、これに内部標準物質溶液を加えたのち、0.1~0.5mol/L硝酸酸性の一定量の溶液とし、ICP中に導入して、クロムイオン(m/z:53、52、50)と内部標準物質イオンそれぞれの質量/電荷数(m/z)におけるイオン電流を測定し、その比を求めてクロムを定量する。
ただし、ICP質量分析法については、本サイトに抜粋してあるので、当該項目をクリックして参照されたい。
(6) ICP mass spectrometry
After pretreating the sample water and adding the internal standard substance solution to it, make a fixed amount of 0.1 to 0.5 mol/L nitric acid acidic solution and introduce it into the ICP to remove chromium ions (m/z: 53, 52 , 50) and the internal standard substance ion, and measure the ion current at the mass/charge number (m/z), and calculate the ratio to quantify chromium.
However, ICP mass spectrometry is extracted from JIS(Japanese Industrial Standards) text to this site, so click on the relevant item to refer to it.
2.マンガン・鉄の定量測定
マンガン・鉄の定量測定には、他の重金属と同様に、1) 吸光光度法、2) 原子吸光法、3) ICP発光分光分析法、4) ICP質量分析法の4種類があり、さらに原子吸光法は 2-1) フレーム原子吸光法と 2-2) 電気加熱原子吸光法とに分けられる。
吸光光度法は、操作が煩雑で、分析に長時問を要するため、現在ではあまり用いられていないが、鉄(Ⅱ)と鉄(Ⅲ)の分別分析が必要な場合に有効な分析方法である。
フレーム原子吸光法は、比較的操作が容易で精度も優れているため、鉄分析法の主流となっている。ただし、水質法に基づく水質基準値の1/10の低濃度(マンガン:0.005mg/L、鉄:0.03mg/L)まで測定するためには、溶媒抽出法などを用いて分離・濃縮する必要がある。
電気加熱原子吸光法は、フレーム原子吸光法より高感度が得られるが、共存する酸や塩類による干渉が大きい。最近では、ICP発光分光分析法がマンガン・鉄分析の有力な測定法として利用されている。この方法は、精度、感度ともフレーム原子吸光法と同程度かそれ以上であり、定量範囲が広く、多元素同時分析が可能である点が原子吸光法より優れている。ただし、フレーム原子吸光法より妨害に弱いともいわれている。
吸光光度法を除く他の測定方法は、カドミウム・鉛・亜鉛で述べた方法と同様である。本節では、マンガン・鉄の検水の前処理と測定上特に留意すべき事項、および吸光光度法による鉄の定量測定について解説する。
2. Quantitative measurements of manganese and iron
Similar to other heavy metals, there are four types of quantitative measurement of manganese and iron: 1) absorptiometry, 2) atomic absorption spectrometry, 3) ICP emission spectroscopy, 4) ICP mass spectrometry. Atomic absorption method is deivided into
2-1) flame atomic absorption method and Electric heating atomic absorption method.
The absorptiometric method is not used so often because it is complicated to operate and requires a long time for analysis. However, it is an effective analysis method when the separation analysis of iron (II) and iron (III) is required.
The flame atomic absorption spectrometry is the mainstream of iron analysis because it is relatively easy to operate and has excellent accuracy. However, in order to measure concentrations as low as 1/10 of the water quality values based on the Water Quality Standards (manganese: 0.005 mg/L, iron: 0.03 mg/L), it is necessary to separate and concentrate using solvent extraction method, etc.
Although the electric heating atomic absorption method can obtain higher sensitivity than the flame atomic absorption method, interference by coexisting acids and salts is large. Recently, ICP emission spectroscopy has been used as a powerful measurement method for manganese and /or iron analysises. This method is similar to or better than the flame atomic absorption method in accuracy and sensitivity, has a wide quantification range, and is superior to the atomic absorption method in that it enables simultaneous multi-element analysises. However, it is said that it is weaker than the flame atomic absorption method.
Other measurement methods except the absorptiometry are the same as those described for cadmium, lead and zinc. In this section, we will explain the matters to be especially noted for the pretreatment and measurement of manganese and/or iron sample waters, and the quantitative measurement of iron by absorptiometry.
Table V-2-1. Official measurement methods and quantitative range of manganese.
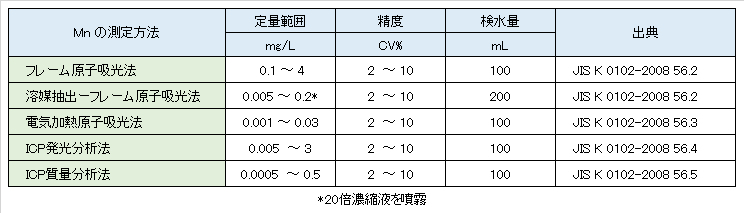
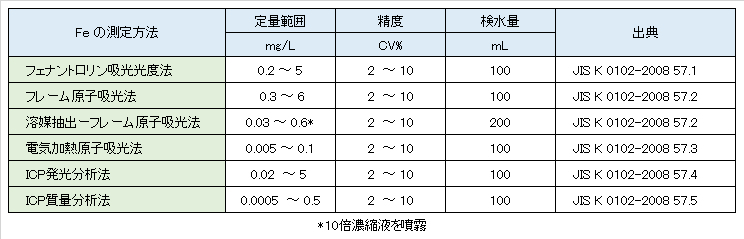
Table V-2-2. Official measurement methods and quantitative range of iron.
(1)前処理
溶解性マンガン・鉄を測定する検水は、試料を採取後、直ちにろ紙5種Cを用いてろ過し、懸濁物を除去する。ろ液に塩酸または硝酸を加えて、一定量の0.1~1mol/L酸性溶液とする。
ろ過するとき、はじめのろ液約50mLを捨てる。ろ過した検水を保存するときには、硝酸を加えてpHを約1とする。
(1) Pretreatment
For the test water to measure soluble manganese and iron, immediately after collecting the sample, filter it using filter paper type 5C to remove the suspended matter. Add hydrochloric acid or nitric acid to the filtrate to make a fixed amount of 0.1 to 1 mol/L acidic solution.
When filtering, discard about 50 mL of the first filtrate. When storing filtered test water, add nitric acid to bring the pH to approximately 1.
(2)測定上の留意事項
1)フレーム原子吸光法
a) マンガン・鉄ともに、シリカが多量に含まれている検水では、フレーム内で安定なケイ酸塩が形成され、元素の原子化が妨害される。検水に、ケイ酸干渉抑制剤としてカルシウムまたはマグネシウムを200mg/L程度となるよう添加する。
b) 鉄の濃度が低く、加えて、干渉物質がほとんど含まれていない検水については、下記の 3) 留意事項 – a)に示すアルミニウム共沈濃縮を行い、原子吸光を測定する。
c) マンガンの濃度が低い検水は、鉄共沈法により濃縮する。
鉄共沈法では、ろ過した検水の適当量をビーカーにとり、約90℃に加熱し、Fe(NH4)(SO4)2・12H2O(鉄アンモニウムミョウバン、2mg-Fe/L)5mLと過酸化水素H2O2(30%)5~10mLを加え、かき混ぜながらNH3(1+1)水またはNaOH溶液(100g/L)を加え、Fe(OH)3沈殿に不溶性Mn化合物を捕集する。沈殿をろ紙5種Aを用いてろ過し、温水で洗う。沈殿をできるだけすべて元のビーカーに移し、ろ紙に付着した沈殿は少量のH2O2(1+10)を加えた塩酸(1+2)溶液の少量に溶かし、ろ紙は温水で洗浄する。ろ液と洗液を加え、0.1~1mol/Lの塩酸性溶液の一定量とする。
(2) Notes on measurement
1) Flame atomic absorption method
a) When both manganese and iron contain a large amount of silica, a stable silicate is formed in the flame and the atomization of elements is disturbed. Calcium or magnesium as a silicic acid interference suppressor is added to the test water so as to be about 200 mg/L.
b) For test water with low iron concentration and almost no interfering substances, perform the aluminum coprecipitation concentration described in 3) Notes – a) below and measure the atomic absorption.
c) Concentrate the test water with low manganese concentration by the iron coprecipitation method.
In the iron coprecipitation method, put an appropriate amount of filtered test water in a beaker, heat to about 90°C, and add 5 mL of Fe(NH4)(SO4)2·12H2O (ammonium iron alum, 2 mg-Fe/L) and hydrogen peroxide. Add 5 to 10 mL of H2O2 (30%) and add NH3(1+1) water or NaOH solution (100 g/L) with stirring to collect the insoluble Mn compound in the Fe(OH)3 precipitate. The precipitate is filtered using filter paper type 5A and washed with warm water. Transfer all the precipitate to the original beaker, dissolve the precipitate adhering to the filter paper in a small amount of hydrochloric acid (1+2) solution containing a small amount of H2O2 (1+10), and wash the filter paper with warm water. Add the filtrate and washing solution to make a fixed amount of 0.1 to 1 mol/L hydrochloric acid solution.
Mnは図Ⅱ-1・図Ⅱ-2・図Ⅱ-4に示すように酸性で可溶性のMn2+は、アルカリ性ではMn(OH)2の沈殿を生じるが、直ちに酸化されてMnO2(中間体としてMn3O4やMn2O3を含む)として不溶性酸化物を形成する。MnO2は、強い酸化剤であるH2O2により可溶性のMnO4–に酸化されて溶出する。
As shown in Fig.II-1, Fig.II-2 and Fig.II-4, Mn2+, which is acidic and soluble, precipitates Mn(OH)2 when it is alkaline, but it is immediately oxidized to MnO2 (including Mn3O4 and Mn2O3 as intermediates), and form insoluble oxides. MnO2 is oxidized to soluble MnO4– by the strong oxidant H2O2 and eluted.
2)電気加熱原子吸光法・ICP発光分光分析法・ICP質量分析法
フレーム/電気加熱・原子吸光法の測定波長:Mn 279.5nm、Fe 248.3nm
重金属に関するこれらの測定方法には共通するする事項が多いので、カドミウム・鉛・亜鉛のページを参照。詳細はJIS K 0102の56(Mn), 57(Fe)を参照。
ただし、ICP発光分光分析法およびICP質量分析法については、本サイトに抜粋してあるので、当該項目をクリックして参照されたい。
2) Electric heating atomic absorption spectrometry/ICP emission spectroscopy/ICP mass spectrometry
Measurement wavelength of flame/electric heating atomic absorption: Mn 279.5nm, Fe 248.3nm
Since there are many common items in these measuring methods for heavy metals, refer to the page of cadmium, lead and zinc. For details, see JIS K 0102 56(Mn), 57(Fe).
However, ICP emission spectroscopy and ICP mass spectrometry are excerpted on this site, so click on the relevant item for reference.
(3)フェナントロリン吸光光度法による鉄の定量測定
1)概要
微酸性溶液中で塩化ヒドロキシルアンモニウムNH3OHClと1,10-フェナントロリン(図Ⅲ-2、以下、’1,10-‘は省略)を加えた後、酢酸アンモニウムNH4CH3CO2を加えてpH4~5に調節し、生成する橙赤色のFe(Ⅱ)錯体の吸光度を測定する。
(3) Quantitative measurement of iron by phenanthroline absorption spectrophotometry
1) Outline
After adding hydroxylammonium chloride NH3OHCl and 1,10-phenanthroline (Fig. III-2, hereafter, ‘1,10-‘ is omitted) in a slightly acidic solution, add ammonium acetate NH4CH3CO2 to adjust the pH to 4 to 5 to generate. Measure the absorbance of the orange-red Fe(II) complex.
2)定量操作
A) 別ページに記載の前処理 1.金属成分の溶出-(1)を行った検水の適量(Feとして20~500μgを含む)をビーカーにとり、硝酸(1+1) 1~2mLを加えて煮沸する。
B) 水を加えて 50~100mLとした後、NH3水(1+1)を加えて微アルカリ性とする。これを数分間煮沸してFe(OH)3沈殿を生成させ、しばらく放置する。
C) 沈殿が沈降したら、ろ紙5種Aでろ過し、温水で 3~4回洗浄する。沈殿を元のビーカーに洗い入れ、塩酸(1+1) 4mLを加え、加熱して溶かし、先のろ紙でろ過して、同時にろ紙に付着しているFe(OH)3沈殿を溶かす。ろ紙を温水で 5~7回洗う。
D) ろ液と洗液を合わせて、水を加えて70mLとした後、NH3OHCl溶液(100g/L)1mLを加えて振り混ぜる。
E) フェナントロリン溶液(1g/L)5mLを加えて振り混ぜ、続いてNH4CH3CO2(500g/L)を 10mLを加えて振り混ぜ、放冷する。
F) 全量を100mLメスフラスコに移し、水を標線まで加えて約20間放置する。
G) この溶液の一部を測定セルに移し、波長510nm付近の吸光度を測定する。
H) 空試験液として、水約50mLとり、硝酸(1+1)1~2mL加えて、B)~G)の操作を行って、測定値を補正するか、対照液とする。
I) 検量線と測定値から、検水中の濃度を求める。
2) Quantitative operation
A) Pretreat according to 1. Elute metal components-(1) on anather page. Put an appropriate amount of this test water (containing 20 to 500 μg as Fe) in a beaker, add 1 to 2 mL of nitric acid (1+1), and boil.
B) Add water to make 50 to 100mL, and add NH3 water (1+1) to make it slightly alkaline. This is boiled for several minutes to form a Fe(OH)3 precipitate, which is left for a while.
C) If the precipitate settles, filter with filter paper type 5A and wash with warm water 3 to 4 times. The precipitate is washed into the original beaker, 4 mL of hydrochloric acid (1+1) is added, heated to dissolve, and filtered with the above filter paper, and at the same time, the Fe(OH)3 precipitate adhering to the filter paper is dissolved. Wash the filter paper with warm water 5 to 7 times.
D) Combine the filtrate and the washing solution, add water to make 70 mL, then add 1 mL of NH3OHCl solution (100 g/L) and shake.
E) Add 5 mL of phenanthroline solution (1 g/L) and shake, then add 10 mL of NH4CH3CO2 (500 g/L), shake, and allow to cool.
F) Transfer the whole amount to a 100mL volumetric flask, add water up to the marked line, and leave it for about 20 minutes.
G) Transfer a part of this solution to the measuring cell and measure the absorbance around wavelength 510nm.
H) As a blank test solution, take approximately 50 mL of water, add 1 to 2 mL of nitric acid (1+1), and perform steps B) to G) to correct the measured value or use it as the control solution.
I) Obtain the concentration in the test water from the calibration curve and the measured value.
3)留意事項
a) Feの量が極めて微量(Fe 20μg以下)の場合には、硫酸カリウムアルミニウムAlNH4(SO4)2・12H2O 0.1gを加えて溶かし、再びNH3(1+1)を加えて微アルカリ性として、Al(OH)3の水酸化物と共沈させて、Feを捕集する。このとき、塩酸には溶けにくくなるので塩酸をさらに加えて、液量が5mL程度になるまで加熱濃縮する。次に、水で液量を約70mLとして、(+)-酒石酸ナトリウムNa2C4H4O6・4H2O(ロシェル塩)0.1gを加えて、上記④以降の操作を行う。
b) 発色時のpHは約4.8とする。塩酸の濃度が高いときには、フェナントロリン溶液を加えた後で、NH3(1+1)を加えて調節する。
3) Notes
a) When the amount of Fe is extremely small (Fe 20 μg or less), add 0.1 g of potassium aluminum sulfate AlNH4(SO4)2·12H2O to dissolve it, and add NH3(1+1) again to make it slightly alkaline to make Al (Fe is collected by co-precipitation with the hydroxide Al(OH)3. At this time, since it becomes difficult to dissolve in hydrochloric acid, hydrochloric acid is further added, and the mixture is heated and concentrated until the liquid volume becomes about 5 mL. Next, adjust the liquid volume to about 70 mL with water, add 0.1 g of (+)-sodium tartrate Na2C4H4O6·4H2O (Rochelle salt), and perform the procedure from D) above.
b) The pH during color development should be about 4.8. When the concentration of hydrochloric acid is high, phenanthroline solution is added, and then NH3(1+1) is added to adjust.
4)Fe(Ⅱ)の分別測定
Fe(Ⅱ)は大気中の酸素によって容易に酸化されるので、検水採取直後に測定を行うか、出来ない場合には、採取現場で発色操作まで実施した後、持ち帰って吸光度を測定する。
A) 検液をろ紙5種Cによりろ過する。このろ液の適量(鉄として20~500 ㎍ を含む)を100mLメスフラスコに移し、フェナントロリン溶液(1g/L) 5mLを加えた後、NH4CH3O2(500g/L)を加え、pHを約5に調整する。
B) 窒素脱気した酸素を含まない水を標線まで加え、約20分間放置する。
C) 以下、上記2)-G)~I)の操作を行って、Fe(Ⅱ)の定量測定を行う。
4) Separate measurement of Fe(II)
Fe(II) is easily oxidized by oxygen in the atmosphere. Therefore, measure immediately after sampling water, or if it is not possible, carry out the coloring operation at the sampling site and take it back to measure the absorbance.
A) Filter the test solution with filter paper type 5C. Transfer an appropriate amount of this filtrate (containing 20 to 500 ㎍ as iron) to a 100 mL volumetric flask, add 5 mL of phenanthroline solution (1 g/L), and add NH4CH3O2 (500 g/L) to adjust the pH to about 5.
B) Add nitrogen-deaerated oxygen-free water up to the marked line and leave it for about 20 minutes.
C) Follow steps 2)-G) to I) above to perform quantitative measurement of Fe(II).
参考文献
1) Charlot, G.: Les Reactions Chemiques En Solution, Masson(1969)
2) Cotton, F.A., G. Wilkinson: Advanced Inorganic Chemistry, John Wiley & Sons(1972)
3) Ewing, G.W: Instrumental Methods of Chemical Analysis, McGraw-Hill(1975)
4) 大木 道則:化学事典,東京化学同人(1994)
5) 国土交通省水質連絡会:河川水質試験方法(案)2008年度版
6) 産業環境管理協会:新・公害防止の技術と法規2016 水質編
7) 床野 利之,脇田 久伸 (編集):入門機器分析化学,三共出版(1988)
8) 電気化学会(編集):電気化学測定マニュアル 基礎編、丸善出版(2002)
9) 並木 博(編集):詳細 工場排水試験方法 JIS K 0102-2013、日本規格協会(2018)
10) 用水廃水便覧編集委員会:用水廃水便覧,丸善(1973)
General References
1) Charlot, G.: Les Reactions Chemiques En Solution, Masson(1969).
2) Cotton, F.A., G. Wilkinson: Advanced Inorganic Chemistry, John Wiley & Sons (1972).
3) Ewing, G.W: Instrumental Methods of Chemical Analysis, McGraw-Hill (1975).
4) Mikinori Oki, et al. (editors): Encyclopedia of Chemistry, Tokyo Kagaku Dojin (1994).
5) Ministry of Land, Infrastructure, Transport and Tourism Water Quality Liaison Meeting: River water quality test method (draft) 2008 version.
6) Japan Environmental Management Assciation for Industry: New Pollution Control Technology and Regulations 2016 Water Quality.
7) Toshiyuki Tono, Hisanobu Wakita (editors): Introductory Instrumental Analytical Chemistry, Sankyo Publishing (1988).
8) The electrochemical Society of Japan (edit): Electrochemical measurement manual, basic edition, Maruzen Publishing (2002).
9) Hiroshi Namiki (editor): Detailed explanation – Industrial wastewater test methods JIS K 0102 : 2013, Japanese Standards Association (2018).
10) Handling Wastewater Handbook Editorial Committee: Water Wastewater Handbook, Maruzen Publishing (1973).
掲載:2018年12月04日
更新:2018年12月12日
更新:2020年08月28日(英語版を追加)
Posted: December 4, 2018
Updated: December 12, 2018
Updated: August 28, 2020 (English version added.)
