Water science – Basic properties of water
村上定瞭(水浄化フォーラム), Sadaaki Murakami (Water & Solutions Forum)
Basic properties of water
1. Three states of water
2. Water molecule
3. Water structure
Water and solutes
Water and living body constituents
Constituent elements of human body, seawater and crust
1.水の三態
(1)固体・液体・気体
一般に物質は、温度や圧力によって、個体・液体・気体の3つの状態をとる。固体は定まった体積と形を持つ。液体は定まった体積を持つが、形は定まっていない。気体は体積も形も定まっていない。物質の状態は分子間相互作用によって区別されている。固体は分子間の相互配置が定まっており、液体では近接分子は接触しているが相互配置は定まっていないのに対し、気体では分子はかなり離れていて、分子間相互作用はそれぞれの運動にほとんど影響を及ぼしていない。
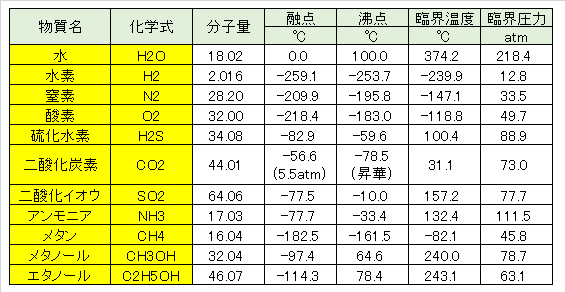
地球の地表環境では、水は個体・液体・気体の3つの状態で存在している。分子量の小さい他の物質に比べて、1気圧における水の融点・沸点は極めて高い値であり、水の分子間相互作用が極めて大きいことを示している。
1. Three states of water
(1) Solid, liquid and gas
Generally, a substance takes three states of solid/liquid/gas depending on temperature and pressure. Solids have a fixed volume and shape. Liquid has a fixed volume, but its shape is not fixed. Gas has no fixed volume or shape. The states of substances are distinguished by intermolecular interactions. In a solid, the mutual arrangement between molecules is fixed, in a liquid, neighboring molecules are in contact but the mutual arrangement is not fixed, whereas in gas, the molecules are far apart, and the intermolecular interaction is caused by each movement which has little effect.
In the earth’s surface environment, water exists in three states: solid, liquid, and gas. Compared to other substances with small molecular weight, the melting point and boiling point of water at 1 atm are extremely high, indicating that the intermolecular interaction of water is extremely large.
Table 1 Melting points and boiling points of substances.
(2)高温高圧水−超臨界水
水を密封容器に入れて、加熱すると、水の性質が著しく変化する。圧力が高くなると気体の密度が増加し、ついには液体と同じ密度となり、気体と液体の境界が消失する。この状態を超臨界という。境界が消失する点を臨界点といい、純水では374℃、22MPaである。
図2Bに示すように、200〜300℃付近では、水のイオン積が大きくなり、酸・アルカリの性質が強くなり、反応性の溶媒となる。電解質をよく溶かしたり、イオン反応や加水分解反応を進行させる。
一方、超臨界水は誘電率・イオン積が小さく、有機溶媒の性質を示し、非極性有機物を溶かすようになり、反対に無機塩類などの電解質は析出する。任意の割合で酸素と混合し、液中で燃焼が起こる。流動性が増し分子拡散速度も高くなり、溶けた物質の反応速度が増加する。
(2) High Temperature High Pressure Water-Supercritical Water
When water is placed in a sealed container and heated, the properties of water change significantly. The higher the pressure, the higher the density of the gas until it becomes the same density as the liquid, and the boundary between the gas and the liquid disappears. This state is called supercritical. The point where the boundary disappears is called the critical point, which is 374°C and 22 MPa for pure water.
As shown in Fib.2B, in the vicinity of 200 to 300° C., the ionic product of water becomes large, the properties of acid and alkali become strong, and it becomes a reactive solvent. It dissolves electrolytes well and promotes ionic reactions and hydrolysis reactions.
On the other hand, supercritical water has a small permittivity-ion product, exhibits the properties of an organic solvent, and dissolves non-polar organic substances. On the contrary, electrolytes such as inorganic salts are deposited. Combining with oxygen in any proportion, combustion takes place in the liquid. The fluidity increases, the molecular diffusion rate also increases, and the reaction rate of the dissolved substance increases.
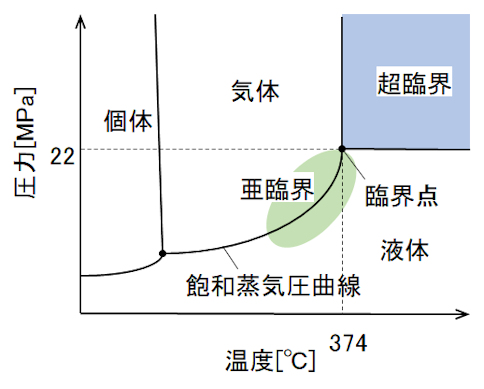
図2A 水の状態図
Fig.2A Water state diagram.
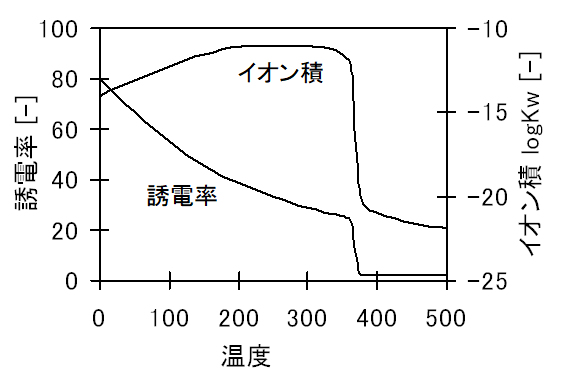
図2B 各温度における水の誘電率とイオン積
Fig.2B Dielectric constant and ionic product of water at each temperature.
2.水分子
(1)分子構造
気体の水分子はH2Oで示され、酸素原子に水素原子が2個結合している。
水素原子1Hの電子配置1s1、酸素原子8Oの電子配置は1s22s22p4であり、結合に関与する電子は水素1s1、酸素の外殻電子2s22p4である。ここで、酸素の外殻原子軌道は混成軌道sp3を形成し、正四面体の各頂点方向へ展開している。この4つ頂点方向の2つと水素原子s軌道がそれぞれの電子を共有して分子軌道を形成し、水分子が生成する。残る2つ頂点方向に展開している軌道には、それぞれ2つの電子がペアーを形成している。
理想的な正四面体の中心と2つ頂点を結ぶ角度は109°であるが、H-O-Hの角度は104.5°となっている。H-Oの原子間距離は0.96Åで、O原子の半径1.4Å、H原子の半径1.2Åとなっている。
2. Water molecule
(1) Molecular structure
Gas water molecule is shown by H2O, and two hydrogen atoms are bonded to oxygen atom.
The hydrogen atom 1H has an electron configuration of 1s1 and the oxygen atom 8O has an electron configuration of 1s22s22p4, the electrons involved in the bond are hydrogen 1s1 and the oxygen outer shell electron 2s2 2p4. Here, the outer shell atomic orbital of oxygen forms a hybrid orbital sp3 and expands toward each vertex of the tetrahedron. Two of these four apexes and the hydrogen atom s orbital share each electron to form a molecular orbital, and a water molecule is generated. Two electrons each form a pair in the remaining two orbits extending in the direction of the apex.
The angle between the ideal tetrahedron center and the two vertices is 109°, but the H-O-H angle is 104.5°. The interatomic distance of H-O is 0.96 Å, the radius of O atom is 1.4 Å, and the radius of H atom is 1.2 Å.
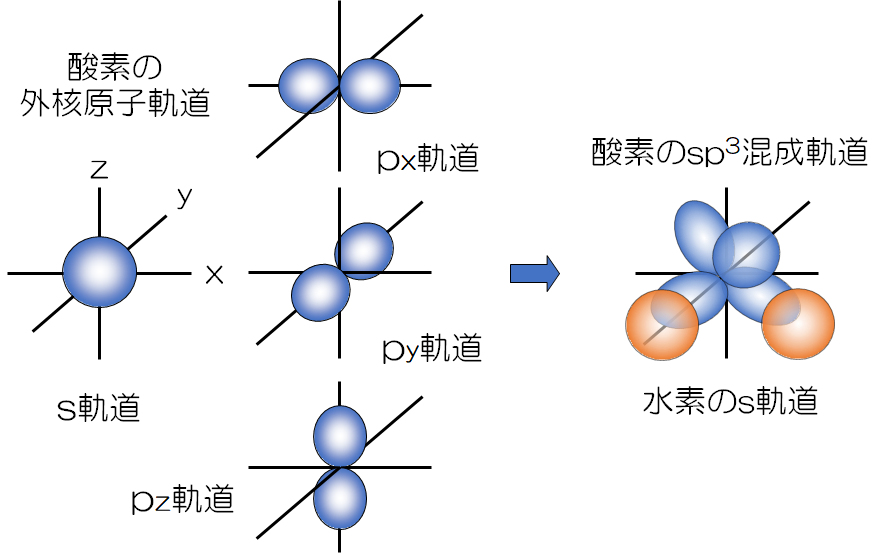
図3 酸素と水素の原子軌道から水分子の分子軌道の生成
Fig.3 Generation of water molecule molecular orbitals from oxygen and hydrogen atomic orbitals.
(2)極性分子
水分子を構成する酸素原子と水素原子は、2つの電子を共有しているが、電子を引き付ける力(電子親和力)は酸素原子が大きい。このため、共有電子は、酸素原子の電子密度が高く、水素原子の電子密度が低くなって、酸素原子は電気的にマイナス、水素原子はプラスとなっている。直線分子であれば極性を示さないが、水分子は極性を有することなる。
(2) Polar molecule
Oxygen atom and hydrogen atom which compose water molecule share two electrons, but oxygen atom has a large electron attracting force (electron affinity). Therefore, the shared electrons have a high electron density of oxygen atoms and a low electron density of hydrogen atoms, so that oxygen atoms are electrically negative and hydrogen atoms are positive. A linear molecule does not show polarity, but a water molecule has polarity.
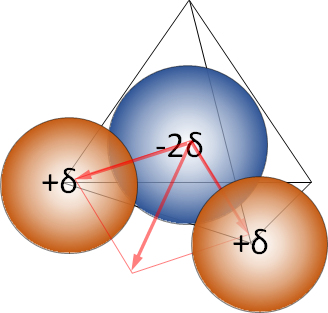
図4 水分子の分極 Fig.4 Polarization of water molecules.
(3)水素結合
窒素7N、酸素8Oやフッ素9Fの核外電子配置は、それぞれ2s2p3、 2s22p4、 2s22p5であり、水素との化合物NH3、H2O、HFには、結合に関与していない電子対はそれぞれ1対、2対、3対ある。これらの各原子の電子対の一つは、分子同士が接近すると他分子の水素原子を介して弱い結合ができる。例えば、H3N・・H-O-H、H2O・・H-O-H、HF・・H-O-H、H3N・・H-NH2、H-F・・H-Fなど(-:共有結合、・・:水素結合)。
水素結合エネルギーは数〜数10kJ/molで、共有結合エネルギーは数100kJ/molで、気体状態では、分子の運動エネルギーが大きく分子間を結びつけることはないが、分子が集合した状態(液体や固体)では周りの分子に拘束され、水素結合が大きな役割を果たすこととなる。水素結合は静電力と異なり立体的な方向性を有しており、分子間に隙間をつくっている。
(3) Hydrogen bond
Nitrogen7N, oxygen 8O and fluorine 9F have 2s2p3, 2s22p4, and 2s22p5, respectively. These compounds with hydrogen, NH3, H2O, and HF, have one, two, and three electron pairs that are not involved in the binding, respectively. One of the electron pairs of each of these atoms forms a weak bond through the hydrogen atom of another molecule when the molecules approach each other. For example, H3N··HOH, H2O··HOH, HF··HOH, H3N··H-NH 2, HF··HF etc. (-: covalent bond, ··: hydrogen bond).
Hydrogen bond energy is several to several tens of kJ/mol, covalent bond energy is several hundred kJ/mol, and in the gas state, the kinetic energy of the molecules is large and the molecules do not connect to each other, but the molecules are aggregated (liquid and solids) are bound by the surrounding molecules, and hydrogen bonding plays a major role. Unlike electrostatic forces, hydrogen bonds have a steric orientation, creating gaps between molecules.
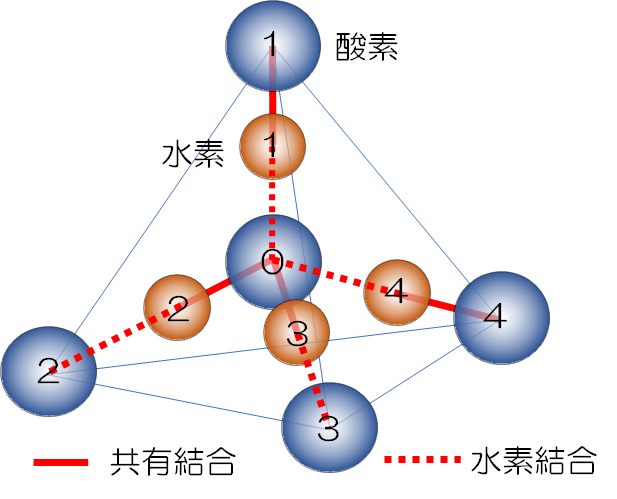
図5 水分子の水素結合 Fig.5 Hydrogen bond of water molecule.
3.水の構造
(1)氷の構造
氷は、水の結晶であり、水分子が水素結合で結びつきながら3次元的に周期的に並んだものである。しかし、氷の結晶構造には、温度・圧力によって様々な種類がある。冷蔵庫(大気圧、約0.1Mpa)できる通常の氷はⅠ相(Ih)であるが、1世紀以前、高圧下(GPaで示され、大気圧の10,000倍レベル) ではⅡ相とⅢ相であることが発見された。その後、実験・観測技術の進展により、現在では10数種類(Ⅰ、Ⅱ、・・・、X?)もの異なる結晶構造が見つかっている。
これらの結晶で共通していることは、図5に示すように、①一つの水分子を四面体の中心におくと、隣の水分子はその四面体の頂点にあり、②中心の水分子から頂点の水分子は4本の水素結合で結ばれている。③4本の水素結合のうち2つが中心の水分子に配位し、2つが頂点に位置する酸素に配位している。
この条件を満たす組み合わせは何通りもあり、この水素配置の自由度が、氷の結晶構造の種類の多さのもととなっている。氷の多形とは、水素の配置がランダムな「無秩序相」と、ある特定の配置を持つ「秩序相」(例えば、図5の水素原子2と3が中心酸素と共有結合し、この基本構造が周期的に並んでいる相→強誘電体)とがあり、現在までのところ、このいずれかに分類できる。これまで氷の各相は、無秩序相⇔秩序相が1対1で対応するペアとして認識されていたが、部分秩序相という第三の状態の存在が明らかとなり、複数の秩序相が存在可能でることが示唆された。このことから、今後、氷の多形の数がさらに増えていくことが予想されている。(引用:https://www.jaea.go.jp/02/press2016/p16070401/index.html)
3. Water structure
(1) Ice structure
Ice is a crystal of water, in which water molecules are linked in three-dimensionally with hydrogen bonds. However, there are various types of ice crystal structures depending on temperature and pressure. Ordinary ice that can be stored in a refrigerator (atmospheric pressure, approximately 0.1 MPa) is phase I (Ih), but before the first century, it was phase II and phase III under high pressure (indicated by GPa, 10,000 times the atmospheric pressure level). It was discovered. Since then, with the progress of experimental and observational technologies, more than 10 different crystal structures (I, II,…, X?) have been found today.
As shown in Fig.5, if one water molecule is placed at the center of a tetrahedron, the adjacent water molecule It is at the top, and the water molecule at the center (2) is connected to the water molecule at the top by four hydrogen bonds. (3) Two of the four hydrogen bonds are coordinated to the central water molecule, and two are coordinated to the oxygen located at the aped.
There are many combinations that satisfy this condition, and this degree of freedom in hydrogen arrangement is the source of the large variety of ice crystal structures. Ice polymorphism means “disordered phase” in which hydrogen is randomly arranged and “disordered phase” having a certain specific arrangement (eg, hydrogen atoms 2 and 3 in Fig.5 are central oxygens). There is a phase in which this basic structure is periodically arranged in a covalent bond with →ferroelectric material), and so far, it can be classified into any of these. Up to now, each phase of ice was recognized as a pair in which disordered phase ⇔ ordered phase corresponded one to one, but the existence of a third state called partial ordered phase became clear, and multiple ordered phases can exist. It has been suggested. Therefore, it is expected that the number of ice polymorphs will increase in the future.
図6 氷の構造(Ih) Fig.6 Ice structure (Ih)
(2)水の構造
液体の水は、水分子が3次元的に規則正しく並んだ構造の一部が壊れ、水分子間の平均距離が縮まっている。
マクロ的には氷の結晶構造を持ちながら、ミクロ的には柔軟な構造へ変化することである。この性質により物質を溶かしたり、溶質間の化学反応、さらには個体・液体を問わず異なる他相との界面においても様々な相互作用や化学反応に関係している。
(2) Water structure
In liquid water, part of the structure in which water molecules are regularly arranged in three dimensions is broken, and the average distance between water molecules is shortened.
It has a crystalline structure of ice on a macro level, but changes to a flexible structure on a micro level. Due to this property, it is involved in melting substances, chemical reactions between solutes, and various interactions and chemical reactions even at the interface with different phases regardless of solid or liquid.
掲載日:2017年07月03日
更新日:2017年07月06日
更新日:2020年07月03日(英語版追加)
Pubilshed: 2017/07/03
Updated: July 06, 2017
Updated: July 03, 2020 (English version added)
