村上定瞭(水浄化フォーラム)
1.セレンの概要
<形態と性質>
セレン Seは周期表の16族・4周期で、単体の核外電子配置は4s24p4で、非金属であり、両性元素でもある。イオン化傾向は小さいが、電気陰性度は大きく、各種の金属・非金属元素と反応し、その化合物は様々な性質を示す。同じ16族・3周期のイオウ S(3s23p4)、15族・同じ4周期のヒ素 As(4s24p3)と化学的性質が類似しており、天然において共存していることが多い。
セレンの単体には、金属セレン(灰色)、単斜セレン(赤色)と無定形セレン(黒色)の3種類の同素体があり、この中では金属セレンがよく知られている。金属セレンは、灰色の光沢を持った固体で、半導体性で、光に反応してその電導率が変化する。
セレン化合物の主な原子価は2価(-Ⅱ)、4価(Ⅳ)及び6価(Ⅵ)である。
無機態セレンには、金属態セレン Se(0)をはじめ、セレン化物 Se(-Ⅱ)2-、亜セレン酸 Se(Ⅲ)O32-、セレン酸 Se(Ⅳ)O42-がある。亜セレン酸イオンやセレン酸イオンは、水に溶解して、地表水や地下水とともに移動する。
有機態セレンには、揮発性のジメチルセレン CH3SeCH3や含イオウ・アミノ酸 NH2・CHR・COOHのSがSeに置き換わったセレノシステイン(R = CH2SeH)、セレノメチオニン(R = CH2CH2SeCH3)などの有機化合物がある。
<用途>
黄、赤色ガラスの製造等で古くから窯業で使われていたが、現在は、電気化学特性から高純度のものが半導体材料、光電池、整流器等に使われている。また、プラスチック、インク、染料等の顔料の他、合金、ゴム工業、殺虫剤等の薬剤や有機合成化学の酸化剤、触媒など、工業部門で広く利用されているが、最近では代替品の開発により脱セレン化も進んでいる。
国内では大手銅製錬会社およびスクラップ会社がセレンを生産している。日本は世界一のセレン生産国で、生産が内需をはるかに上回っており、多くが輸出されている。セレン生産の原料は主として非鉄金属精錬の電解スライムである。この他に複写機用セレン感光体ドラムのスクラップからも回収されている。
感光体ドラム中セレンのリサイクルシステムは確立されているのに対し、一般的なグレードの低いセレン最終製品のスクラップや廃液からの回収は、その技術が複雑でコストに見合う効果が期待できないため、リサイクルは行われていない。
セレンの単体には、金属セレン(灰色)、単斜セレン(赤色)と無定形セレン(黒色)の3種類の同素体があり、この中では金属セレンがよく知られている。金属セレンは、灰色の光沢を持った固体で、半導体性で、光に反応してその電導率が変化する。
セレン化合物の主な原子価は2価(-Ⅱ)、4価(Ⅳ)及び6価(Ⅵ)である。
無機態セレンには、金属態セレン Se(0)をはじめ、セレン化物 Se(-Ⅱ)2-、亜セレン酸 Se(Ⅲ)O32-、セレン酸 Se(Ⅳ)O42-がある。亜セレン酸イオンやセレン酸イオンは、水に溶解して、地表水や地下水とともに移動する。
有機態セレンには、揮発性のジメチルセレン CH3SeCH3や含イオウ・アミノ酸 NH2・CHR・COOHのSがSeに置き換わったセレノシステイン(R = CH2SeH)、セレノメチオニン(R = CH2CH2SeCH3)などの有機化合物がある。
国内では大手銅製錬会社およびスクラップ会社がセレンを生産している。日本は世界一のセレン生産国で、生産が内需をはるかに上回っており、多くが輸出されている。セレン生産の原料は主として非鉄金属精錬の電解スライムである。この他に複写機用セレン感光体ドラムのスクラップからも回収されている。
感光体ドラム中セレンのリサイクルシステムは確立されているのに対し、一般的なグレードの低いセレン最終製品のスクラップや廃液からの回収は、その技術が複雑でコストに見合う効果が期待できないため、リサイクルは行われていない。
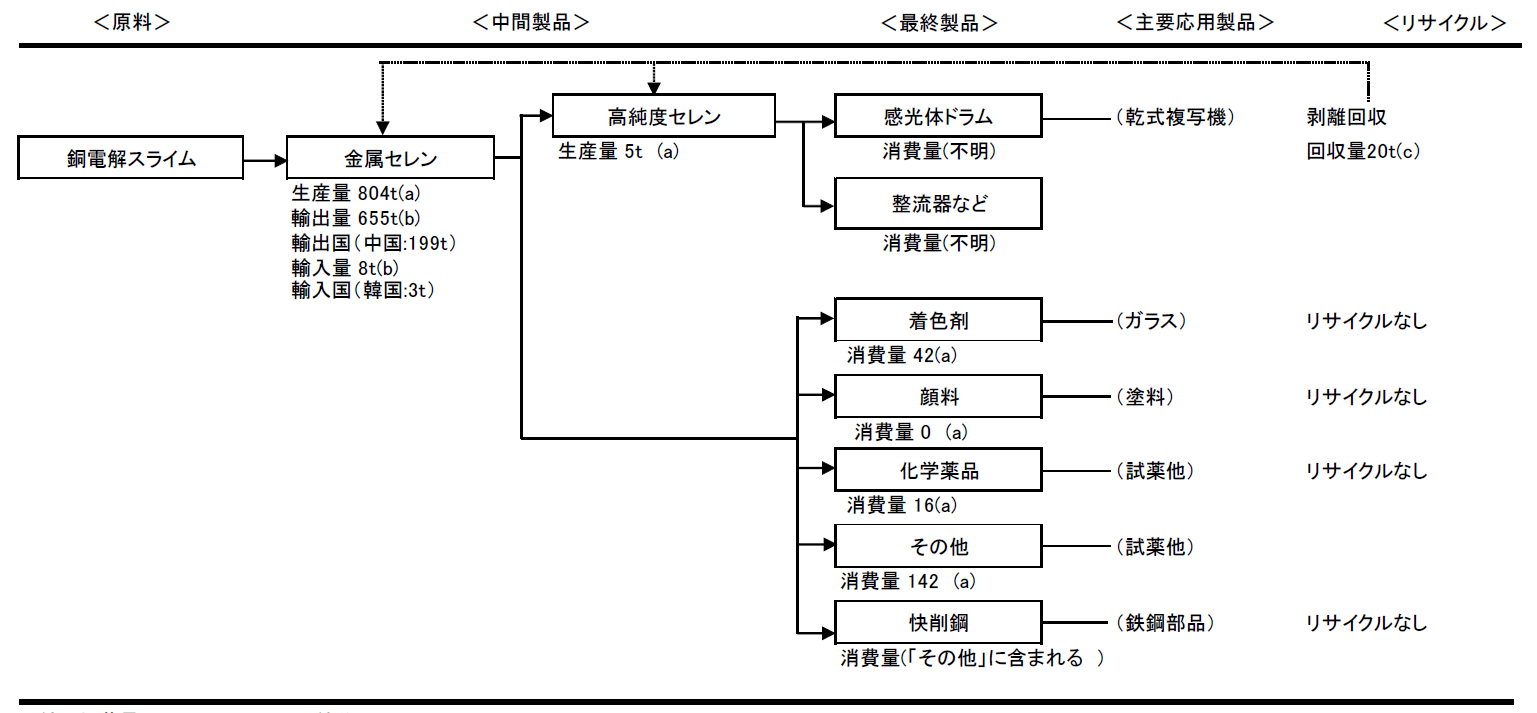
図1.1 日本におけるセレンの生産量・消費量とリサイクル(2010年) [金属資源情報、2011]
(a)日本工業協会、工業レアメタル No.127 2011、(b)日本貿易統計、(c)触媒資源化実績報告書(2010)
<自然存在>
環境水(地表水、地下水、海水などの弱酸性から弱アルカリ性の水)に含まれる溶解性セレンは、図2.3に示すように、セレン(Ⅳ) (HSeO3–、SeO32-)とセレン(Ⅵ) (SeO42-)とがあり、水に溶解性で両者とも安定である。酸素が存在する場合には、セレン酸の割合が高いことが多い。日本の地殻表層はその含有量が少なく、河川中の濃度は0.02~0.63μ.g/L、井戸水で0.06~0.16μg/Lである。
海水では、0.09μg/L程度含まれているといわれている。溶解性セレンは0.04~0.1μg/Lで、表層ではセレン(Ⅵ)が約80%を占め、セレン(Ⅳ)は水深の増大とともに徐々に増加する傾向にあり、有機態セレンは 1ng/L以下であった[甲斐, 1993]。
<毒性と適正摂取量>
セレンは生体にとって必須元素であり、その摂取可能な濃度範囲が狭いので注意を要する元素である。日本人の食事摂取基準[厚生省、2015]によれば、推奨量は18歳以上の男性30μg/日、女性25μg/日で、許容上限量は年齢により異なるが、例えば、18~29歳の男性420μg/日、女性で330μg/日となっている。
セレンには、抗酸化作用があり、過酸化脂質の分解酵素の成分が老化防止としても働き、ビタミンEの50~100倍の効果がある。その外、癌の抑制効果、シミ予防効果、消炎作用、血液凝固の抑制作用などがあるようである。
セレンの摂取欠乏の障害として、成長障害や関節炎、肝臓障害、動脈硬化などが起こりやすくなる。克山病が有名で心筋症を主とする疾患であり、中国竜江省克山地域で多発したため、この名称がつけられた。
セレン摂取過剰の慢性症状としては、疲労感、焦燥感、脱毛や爪の変化がおこるようである。急性症状では吐き気、悪心、嘔吐、うつ状態、皮膚炎、胃腸障害、呼吸困難になり、呼気のニンニク臭もおこるようである。
<環境施策上の法規制>
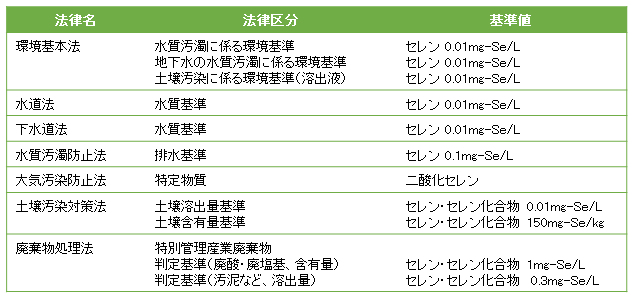
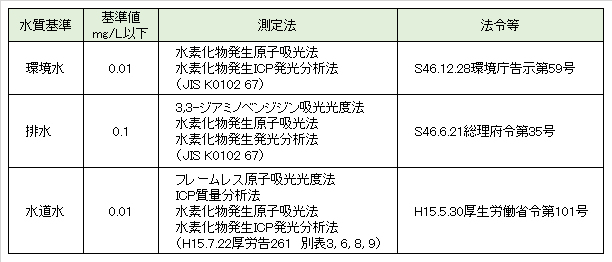
セレンは、環境基準(水質、地下水、土壌)が設定されており、セレン及びその化合物は水道水質基準、排水基準が設定されている。さらに、水生生物保全に係る水質目標を優先的に検討すべき物質に選定されている。
目次へ
2.セレンおよびその化合物の性質
本節では、水溶液中のセレン化合物の化学的性質を理解するために、他の同族元素と比較しながら説明する。セレンの重要な酸化状態は-Ⅱ、IV、VIで、特にSと類似した性質を示す。
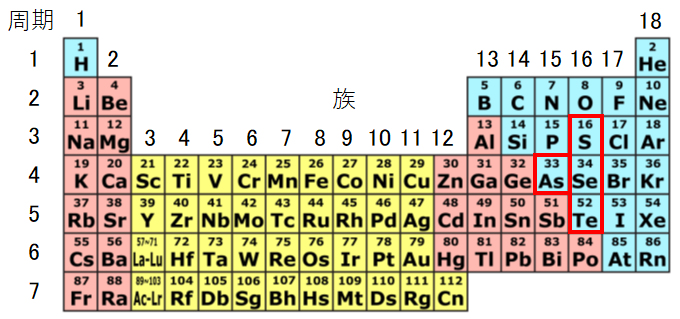
図2.1 周期律表におけるセレンおよびその同族元素
2.1 単体 Se
16族元素の標準酸化還元電位Eoは、O(g)>S(s)>Se(s)>Te(s)となっている。

2.2 Se(-II)
H2S以下の三つの水素化合物は気体で、空気中で酸化される。アルカリ塩とアルカリ土類塩は可溶性である。気体状の水素化合物は、水中に共存する多元素との分離が可能で、その定量分析に利用されている。
多硫化物 Sm2-、多セレン化物 Sem2-、多テルル化物 Tem2-は赤色である。m = 2~5で、表2.3に代表例を示すように金属塩の大部分は難溶性で、硫化物に似た性質を有する。テルル化銀 Ag2Teは硫化銀 Ag2Sよりもさらに難溶性である。
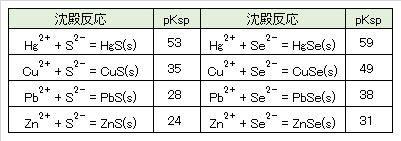
2.3 Se(IV)
後述する図2.2と図2.3に示すように、地表水(空気と触れている水の酸化還元電位の状態)中では、イオウではSO42-が安定に存在するが、セレンではSeO32-、HSeO3–およびSeO42-の解離種が共存している。
アルカリ土類金属イオンとの溶解度積を表2.5に示す。これらの金属イオン半径の大きいほど、難溶解性となっている。
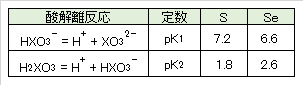
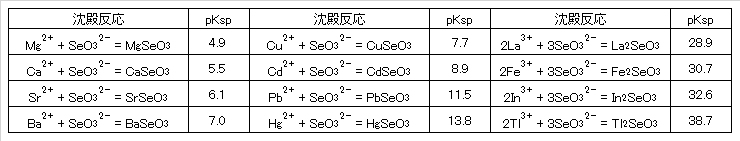
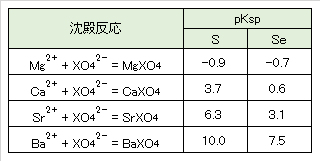
2.4 Se(VI)

2.5 酸化還元電位-pHと存在種
(1) 酸化還元反応
冷溶液で、ヒドラジン N2H2、ヒドロキシルアミン NH2OH、亜リン酸 HPO32-、次亜リン酸 HPO22-、Sn(Ⅱ)を作用すると、亜セレン酸も亜テルル酸も還元されて、赤色のセレンと黒色のテルルになる。
亜セレン酸・亜テルル酸は亜鉛粉末Znまたはテトラヒドロほう酸ナトリウム NaBH4により還元されて、H2Se・H2Teを生成する。Zn法では、5〜6mol/L塩酸酸性で40〜60秒、NaBH4法では1~2.5mol/L塩酸酸性で反応させる。これらの還元反応は水素化物発生法として、原子吸光法や発光分光分析法などによるセレン・テルルの測定に広く用いられている。
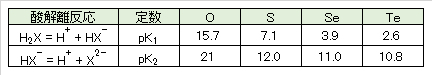
XO42-/XO32-(M = S, Se, Te)は、可逆系ではない。これらのXO42-は、極めて安定で還元することが難しい。硫酸は熱濃溶液でないと還元されない。セレン酸やテルル酸は、濃塩酸 (3 mol/L以上)で加熱処理するか(Ⅵ → Ⅳ)、非常に強力な還元剤によってのみ還元される。
亜セレン酸イオンSeO32-およびセレン酸イオンSeO42-の立体構造を図2.2に示す。SeO32-は三角錐形で、その頂点にSe4+が位置している(ClO3–、SO32-、PO33-も同形)。SeO42-は四面体形で、その体心にSe6+が位置している(ClO4–、SO42-、PO43-も同形)。
図2.2に示すように、SeO32-では、Se4+が電子e–を受け入れる空軌道が外部に拡がっているが、SeO42-ではSe6+の空軌道は4つのO2-の電子雲に遮蔽されている。以上のことから、Se4+は還元(電子移動)反応の活性化エネルギーが低いのに対し、Se6+はその活性化エネルギーが極めて高く、還元反応には上述したような厳しい条件が求められる。
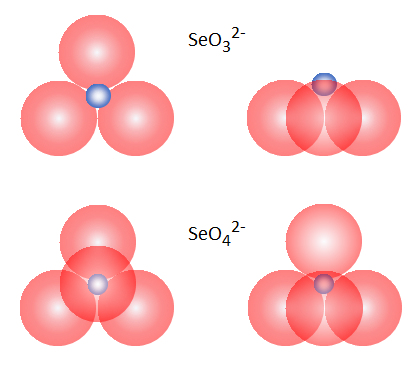
図2.2 亜セレン酸イオンSeO32-およびセレン酸イオンSeO42-の立体構造
青小球:Se4+(上段図、イオン半径 0.50Å)、Se6+(下段図、イオン半径 0.44Å);赤大球:酸素イオンO2-(イオン半径 1.40Å);左図:C3軸方向から見た図、右図:C3軸に対し垂直方向から見た図
注)上記のイオン半径はセレン化合物の結晶(塩や鉱石)での平均的な値であり、SeO42-の半径は3.3Åとなるが、水溶液中のSeO42-の有効半径は約 4Åとなっており、セレン酸イオンの酸素原子と水分子との水素結合が考えられる。なお、Al3+(0.51Å)やFe3+(0.64Å)(結晶中イオン半径)の水中における有効半径は約9Åであり、配位水(d = 3.8Å)に加えて、数層の水和分子で囲まれているいることが分かる。
(2) 酸化還元電位-pH
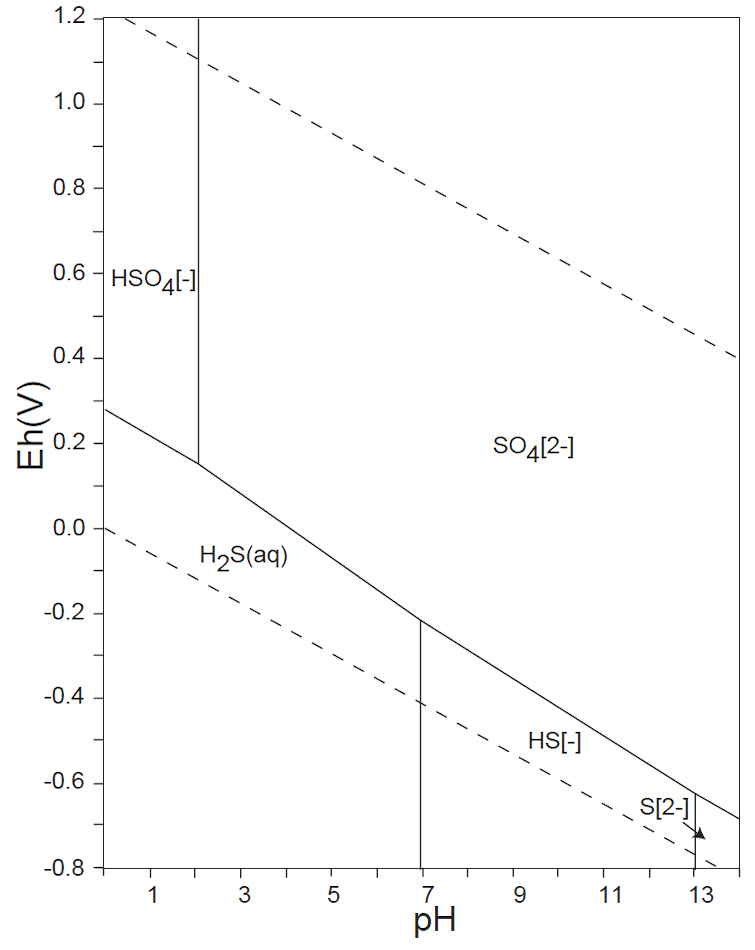
図2.3 イオウS化合物の水中の存在種
点線は、水の電気分解が起こる標準酸化還元電位を示す。以下、同様。
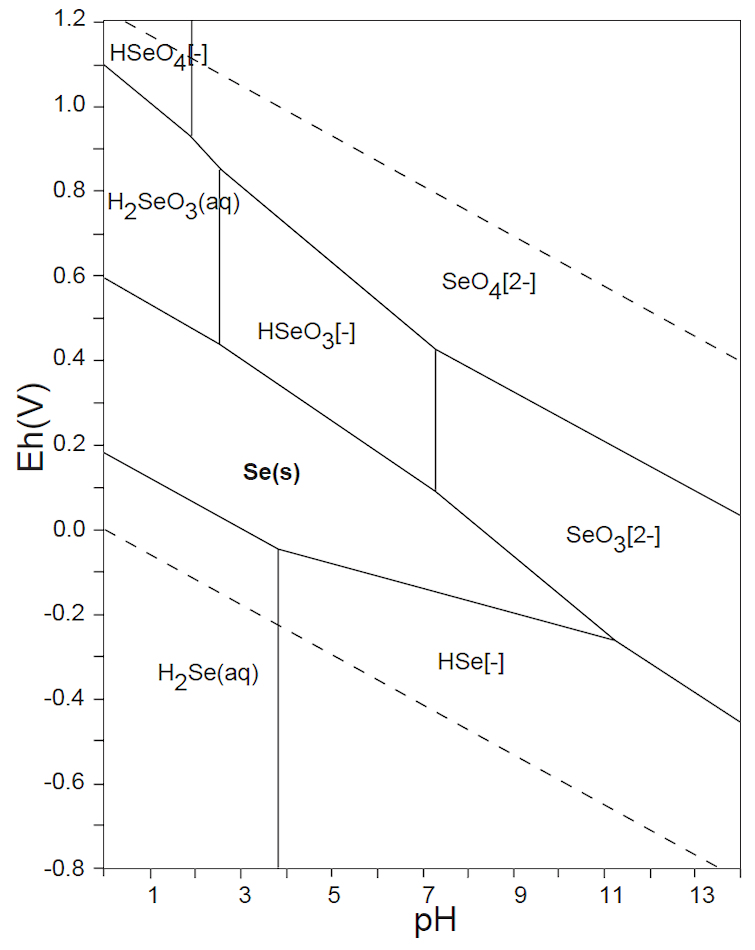
図2.4 セレンSe化合物の水中の存在種
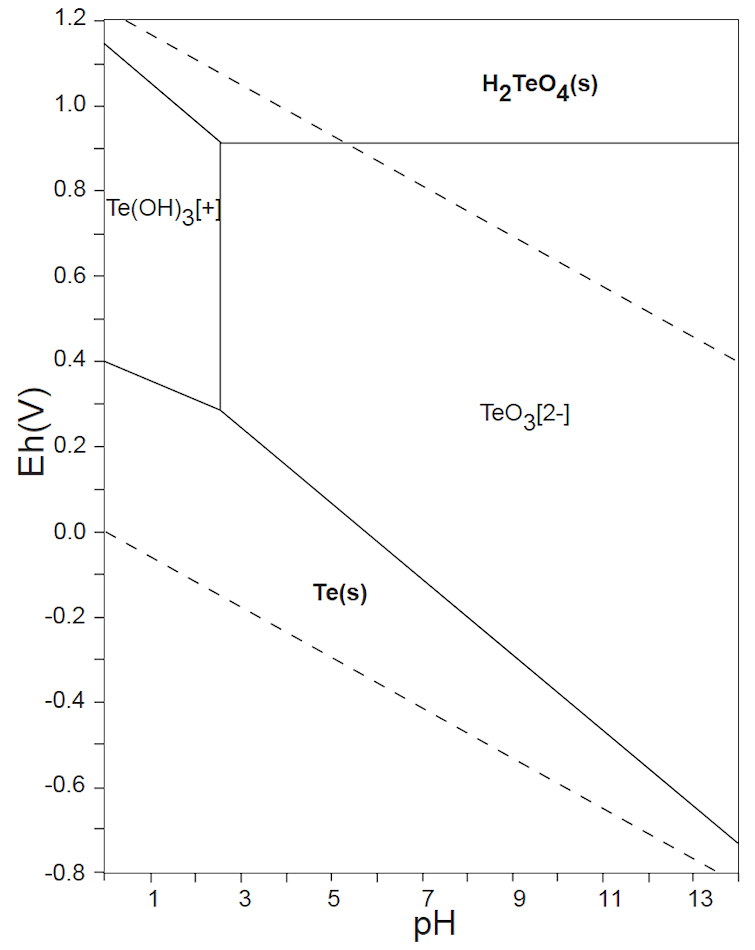
図2.5 テルルTe化合物の水中の存在種
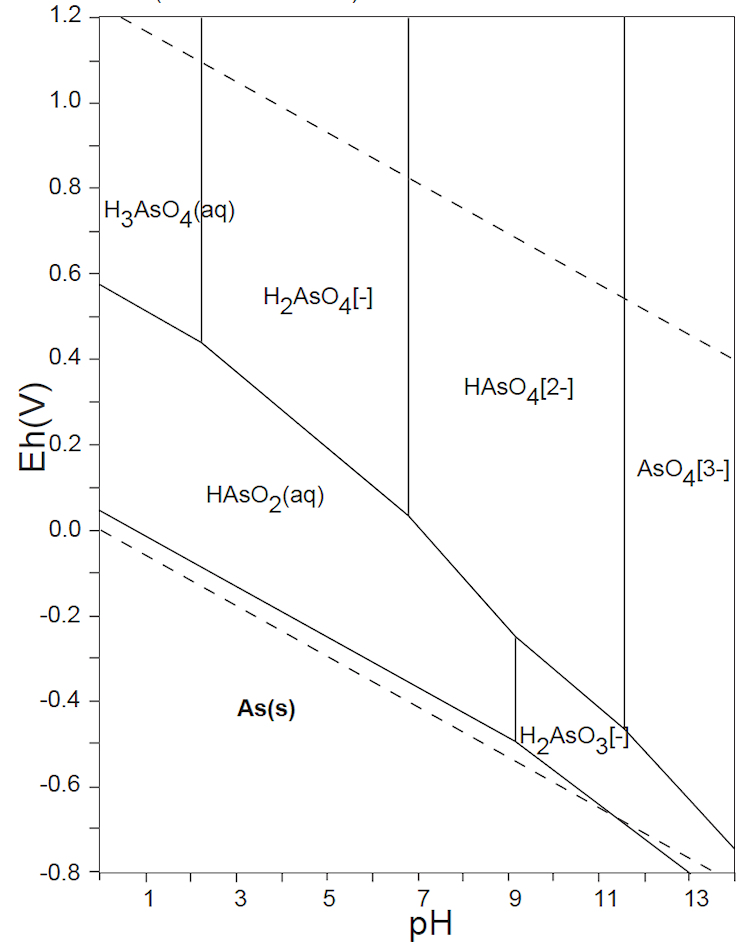
図2.6 ヒ素As化合物の水中の存在種
2.6 自然界におけるセレンの循環
<セレンの循環>
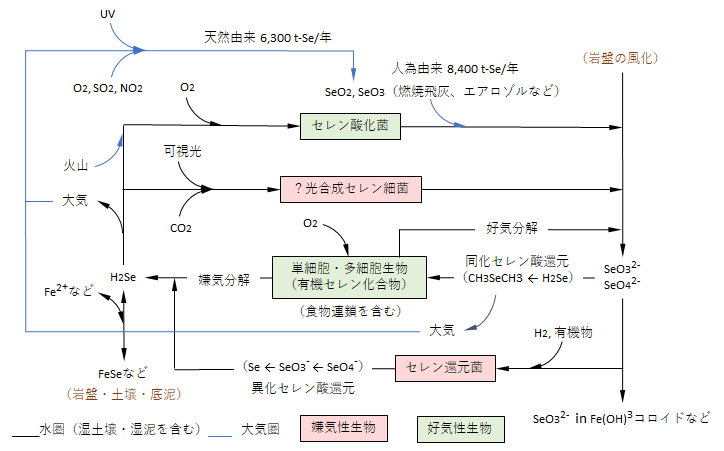
図2.7 自然界におけるセレンの循環と生物代謝
?:イオウについては光合成細菌が確認されているが、セレンについてはその存在は不明である。
イオウは自然界に多量に存在し生物の必須元素であることから、生物代謝については詳しく分かっている。しかし、セレンは微量元素で、微生物に関しては不明なことが多い。詳しくは、文献[池, 2016]等を参照されたい。
<生物濃縮と食物連鎖>
一方、セレンを含むアミノ酸であるセレノメチオニンを用いた淡水(1μg-75Se/L)での BCF は、魚類ブルーギルで 5,000、藻類 Chlamydomonas reinhardtii で 16,000、甲殻類大型ミジンコで200,000であった [Bessel, 1993]。
その他、セレンの生物濃縮に関する研究は多数ある。自然・人為のいずれにしても、セレン濃度の高い水域や土壌に関しては、食物連鎖の中でさらに濃縮されることに留意すべきである。
3.セレンの処理
セレンの水質規制は欧米が先行し、日本では1993(平成5)年に水質項目に追加された。しかし、セレンの処理は重金属の中でも特異的といってよいくらい処理の難しい重金属である。その理由は上述のとおりセレン(Ⅵ)は難溶性塩を生成せず、共沈や吸着反応も起こりにくいためである。
セレン(Ⅳ)に還元されれば鉄塩(Ⅲ)による共沈処理が可能である。しかし、セレン(Ⅵ)のセレン(Ⅳ)への還元はJIS K 0102 : 2013 (67.1~67.4項)にもあるとおり「塩酸酸性の強酸性下で煮沸」のような強烈な条件が必要であり、還元反応の難しさが推察される。
米国では地表水にセレンが含まれ、これが水道水源として利用されることもあるため、共沈処理、吸着処理、イオン交換処理、RO処理など各種処理法についての検討例が多い。
国内でのセレン発生源は、石炭火力発電所の排煙洗浄水、銅精錬における電解スライム、下水汚泥の焼却灰、掘削工事に伴って発生す土壌や工事排水などがあげられる。発生源によって、個体・液体、含有量、共存する物質も様々な性状であり、発生源ごとに処理プロセスが異なる。本ページでは、基本的な除去法を説明し、代表的な発生源にについて、具体的な処理プロセスについて紹介する。
3.1 基本プロセス
(1)共沈法
前述のように溶解性セレンは、セレン(Ⅳ)とセレン(Ⅵ)とであるが、セレン(Ⅳ)は水酸化鉄(Ⅲ)による共沈処理が有効である。しかし、セレン(Ⅵ)に対しては効果が低く、除去率は10%以下である。アルミニウム塩は鉄塩(Ⅲ)に比べれば効果は劣るが、セレン(Ⅳ)に対し共沈効果はあるが、鉄塩(Ⅱ)に比べてもその効果は劣る。
pHの影響は大きく、中性から弱酸性にかけて共沈で処理され、90%の除去が可能である。実排水のパイロットプラントによる処理でも、セレン(IV)の除去率は80~90%の結果が得られており、この場合、最適pHは6.2以下であると報告されている。しかし、この結果は塩類濃度の低い河川水や地下水を想定した場合の処理特性である。塩類濃度の高い排水では薬注量や除去率が大幅に異なるため、実排水での事前の確認試験が必要である。
(2) 吸着法
一般的に使用される吸着剤として、活性炭の効果は認められないが、活性アルミナはセレン(Ⅳ)に対して有効である。セレン(Ⅳ) 0.2mg/L含む井戸水を活性アルミナ充填カラム2.5cmφ×23cmH、通水速度7m/hで通水した結果、処理水は0.01mg/L以下まで処理され、そのときの飽和吸着量は0.24mg-Se/g-活性アルミナでと報告されている。吸着量は少ないが、水酸化ナトリウムで再生・繰り返し使用が可能であるため、活性アルミナ吸着法は実用的技術として、今後さらに検討の必要がある。一方、セレン(Ⅵ)に対してはセレン(Ⅳ)吸着量の1/10程度であり、SO42-、HCO3–の共存イオンの妨害を受けるなど、セレン(Ⅵ)に対しての適用は難しい。
(3) イオン交換法
この法は、いずれもイオンを分離する方法である。したがって、セレンがすべて解離しイオンとして存在すれば、当然これらの方法で分離可能である。セレン(Ⅳ)又はセレン(Ⅵ)を0.1mg/Lを含む水道水を処理した例では、両処理法ともセレン(Ⅳ)およびセレン(Ⅵ)に対して除去率97%以上(測定下限値以下)の処理水を得たと報告されている。
(4) 金属鉄法
鉄(Ⅱ)塩によりセレン(Ⅵ)は金属セレンSe及びセレン(Ⅳ)への還元が可能であるが、鉄(Ⅱ)塩を多量に必要とし、実用的ではなかった。しかし、金属鉄を使用すれば、まだまだ使用量は多いといえ、これを削減することができ実用技術のレベルになっている。反応式を下記に示す。
3Fe(s) + SeO42- + 8H+ → 3Fe2+ + Se(s)+4H2O
nFe2+ + 2nOH– + Se(s) → [Fe(OH)2]n・Se
この方法による処理例として、粒状鉄を充填したカラムにセレン(Ⅵ)を0.42mg/L含む排水を塩酸酸性とし、液温 50℃、SV 15h-1で通液した。還元される比率は塩酸の添加量、すなわち鉄(Ⅱ)イオンの溶出量に比例するが、溶出液をそのままpH 9~10で凝集沈殿を行うことにより鉄(Ⅱ) 200mg/Lのときセレン(Ⅵ)は0.06mg/L、600mg/Lでは0.01mg/Lまで処理できたと報告されている。このときSO42-など共存イオンの防害を受けやすいので事前の適用試験で処理条件や処理到達値を確認する必要がある。
還元金属として、その他アルミ、銅、亜鉛などがあり、実施例が出始めている。一方、鉄(Ⅲ)塩と鉛塩から調製した吸着剤によるセレン(Ⅵ)の還元吸着処理やほう素処理に使用されるN-メチルグルカミン型イオン交換樹脂によるセレン(Ⅳ)とセレン(Ⅵ)についての吸着特性の検討例などがある。このような吸着剤・還元剤の探索や処理条件の見直しにより、適用性が広く、効果的である新たな処理技術の開発が期待されている。
(5) 微生物法
微生物を使ってセレンを処理する技術は米国、カナダで注目され、鉱山排水からセレンを回収する技術として開発された。この方法は嫌気性条件下でセレン(Ⅵ)を呼吸作用に使う微生物を利用して金属セレンSe(s)に還元する技術である。我が国では生物処理における脱窒素工程でセレン酸還元菌を馴養し、脱窒素とセレン還元を同時に行う方法が開発された。
セレン還元に対し脱窒素反応が優先するため、まずは脱窒反応が完結していることがセレン還元の前提となる。そのため脱窒素工程はかなり余裕を持った設計が必要であり、排水成分の濃度変動も影響が大きい。
3.2 セレン処理の具体例
具体的なセレン処理においては、処理対象によって共存する物質も様々で、セレン処理の阻害要因となったり、また、有害な他の物質が共存することも多く、個々の処理対象によって複雑な工程となる。以下に、代表的な具体例を紹介する。
<掲載準備中>
自然水、掘削・土壌/排水、燃焼灰中などのセレンは、イオウ、ひ素などと共存しているケースが多く、セレンを単独に処理することはない。現在、ひ素のページを準備中であるので、合わせて説明することとする。しばらく、待っていただきたい。
(1) 銅電解精錬
(2) 石炭火力発電所
(3) 切削工事
(4) 試験・研究所
(5) 不溶化
セレン(Ⅳ)に還元されれば鉄塩(Ⅲ)による共沈処理が可能である。しかし、セレン(Ⅵ)のセレン(Ⅳ)への還元はJIS K 0102 : 2013 (67.1~67.4項)にもあるとおり「塩酸酸性の強酸性下で煮沸」のような強烈な条件が必要であり、還元反応の難しさが推察される。
米国では地表水にセレンが含まれ、これが水道水源として利用されることもあるため、共沈処理、吸着処理、イオン交換処理、RO処理など各種処理法についての検討例が多い。
国内でのセレン発生源は、石炭火力発電所の排煙洗浄水、銅精錬における電解スライム、下水汚泥の焼却灰、掘削工事に伴って発生す土壌や工事排水などがあげられる。発生源によって、個体・液体、含有量、共存する物質も様々な性状であり、発生源ごとに処理プロセスが異なる。本ページでは、基本的な除去法を説明し、代表的な発生源にについて、具体的な処理プロセスについて紹介する。
pHの影響は大きく、中性から弱酸性にかけて共沈で処理され、90%の除去が可能である。実排水のパイロットプラントによる処理でも、セレン(IV)の除去率は80~90%の結果が得られており、この場合、最適pHは6.2以下であると報告されている。しかし、この結果は塩類濃度の低い河川水や地下水を想定した場合の処理特性である。塩類濃度の高い排水では薬注量や除去率が大幅に異なるため、実排水での事前の確認試験が必要である。
nFe2+ + 2nOH– + Se(s) → [Fe(OH)2]n・Se
この方法による処理例として、粒状鉄を充填したカラムにセレン(Ⅵ)を0.42mg/L含む排水を塩酸酸性とし、液温 50℃、SV 15h-1で通液した。還元される比率は塩酸の添加量、すなわち鉄(Ⅱ)イオンの溶出量に比例するが、溶出液をそのままpH 9~10で凝集沈殿を行うことにより鉄(Ⅱ) 200mg/Lのときセレン(Ⅵ)は0.06mg/L、600mg/Lでは0.01mg/Lまで処理できたと報告されている。このときSO42-など共存イオンの防害を受けやすいので事前の適用試験で処理条件や処理到達値を確認する必要がある。
還元金属として、その他アルミ、銅、亜鉛などがあり、実施例が出始めている。一方、鉄(Ⅲ)塩と鉛塩から調製した吸着剤によるセレン(Ⅵ)の還元吸着処理やほう素処理に使用されるN-メチルグルカミン型イオン交換樹脂によるセレン(Ⅳ)とセレン(Ⅵ)についての吸着特性の検討例などがある。このような吸着剤・還元剤の探索や処理条件の見直しにより、適用性が広く、効果的である新たな処理技術の開発が期待されている。
セレン還元に対し脱窒素反応が優先するため、まずは脱窒反応が完結していることがセレン還元の前提となる。そのため脱窒素工程はかなり余裕を持った設計が必要であり、排水成分の濃度変動も影響が大きい。
<掲載準備中>
自然水、掘削・土壌/排水、燃焼灰中などのセレンは、イオウ、ひ素などと共存しているケースが多く、セレンを単独に処理することはない。現在、ひ素のページを準備中であるので、合わせて説明することとする。しばらく、待っていただきたい。
4.セレンの測定
4.1 公定測定方法
吸光光度法は、操作が煩雑で、分析に長時問を要するうえに有害な試薬を使用するため、現在ではあまり用いられていない。
電気加熱原子吸光法は、共存する酸や塩類による干渉が大きく、上水試験方法しか認められていないためあまり用いられていない。
水素化合物発生原子吸光法は、精度も優れているため、セレン分析法の主流となっている。水素化合物発生原子吸光法の水素化物発生装置は、バッチ式と連続式の二種類に分けられる。原子化法として加熱セルの代わりに水素-アルゴンフレームを用いる方法もあるが、フレーム法は装置・操作条件により異なり感度が加熱セルの1/10~1/50程度とよくない。
最近では、水素化合物発生ICP発光分光分析法がセレン分析の有力な測定法として利用されている。この方法は、水素化合物発生原子吸光法と同程度の感度である。
また、水素化合物発生ICP発光分光分析法よりはるかに高感度で多元素同時分析が可能であるICP質量分析法がセレンの分析法として最近利用されつつある。この分析法で他元素との同時定量が可能なセレン質量数は、“77、82”である。なお、セレンの安定核種は6種類あり、80Se(49.62%)、78Se(23.51%)、82Se(9.39%)、76Se(8.96%)、77Se(7.65%)、74Se(0.88%)、である。
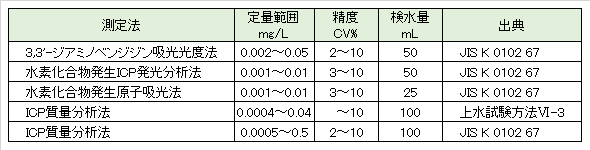
4.2 各測定方法の概要
(1) 3,3’-ジアミノベンジジン吸光光度法
前処理(下記4.4に記載、以下、同様)を行った試料の適量を50℃に加熱し、臭化カリウムと硫酸アンモニウム鉄(Ⅲ)を加えた後、アンモニア水で中和して水酸化鉄(Ⅲ)に共沈させる(セレンの分離濃縮と妨害イオンの除去)。沈殿を塩酸に溶かし、EDTA(錯体形成による妨害金属イオンの封鎖)を加えた後、アンモニア水でpH1.5~2.0(pH計を用い正確)に調整する(H2SeO3(aq)の生成)。AZをを加え、沸騰水中で約10分間加熱する。冷却後、pH 6に調整し、BSCをトルエンに抽出する。トルエン層を吸収セルに移し波長420nm付近の吸光度を測定して、検量線からセレンを定量する。
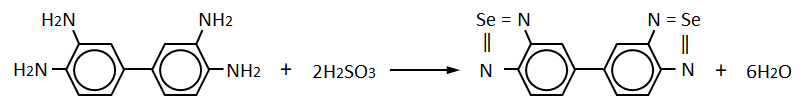
図4.1 亜セレン酸と3,3’-ジアミノベンジジンの呈色反応
(2) 水素化合物発生ICP発光分光分析法
(3) 水素化合物発生原子吸光法
(1) 試料中の有機物を分解するために硫酸-硝酸処理を行う。有機物を多く含む場合は、過塩素酸を併用するとよい。この処理によってセレンは全てSe(Ⅵ)になっている。
セレン化水素の発生はセレンの酸化数によって著しく影響され、Se(VI)からはSe(IV)からの数分の一のセレン化水素が発生するにすぎない。したがって、あらかじめSe(IV)に還元しておく必要がある。このため、塩酸(6 mol/L)酸性で、90~100℃、10分問の加熱を行う。加熱には沸騰水浴を用いるとよい。
なお、生成した塩素によってSe(IV)が再酸化されることがあるので、還元後は手早く次のセレン化水素の発生操作を行う。
(2) 発生したセレン化水素と廃液とを分離したのち、セレン化水素を含む気体を水素-アルゴンフレーム中に導入し、波長196.0nmの原子吸光を測定する。
(3) セレン化水素発生の最適塩酸濃度は2.5~5 moL/L である。
(4) Fe(Ⅲ)は10 000倍量、Cuは50倍量共存すると妨害になる。前者はシュウ酸カリウムの添加、後者はシュウ酸カリウム、塩化鉄(Ⅲ)及び塩化アンモニウムの添加で抑制される。
(5) 有機物を含まない試料には、硫酸と硝酸による処理を省略し、直ちに約6mol/Lの塩酸酸性にして加熱し、セレンを予備還元するとよい。
(4) ICP質量分析法
JIS K 0102 に記載のセレンに関するICP質量分析法については、本サイトに抜粋してあるので、クリックして参照されたい。
4.3 水素化合物発生装置
原理は、前処理によって分離・濃縮した酸化物などの水溶性多価状態の目的元素に、還元剤を加えて水素化合物を発生させ、①吸収液で捕集・発色して吸光光度法で測定するか、②キャリアガスによって原子吸光やICP発光分析の装置に導入して測定する。
図4.2に示す事例は、試料を含む反応容器に還元剤を添加・反応させ、発生した水素化合物を吸収液で捕集・発色させて吸光光度法により、測定するための装置の事例を示す。砒素・アンチモン、セレンなどの定量分析に用いられる。
図4.3に示す事例は、試料液および還元剤液を定量ポンプで反応管に送液・反応させて、発生した水素化物を固液分離し、キャリアーガスにより、原子吸光やICP発光分析の装置へ導入する事例を示す。砒素、アンチモン、セレンなどの定量分析に用いられる。

図4.2 分光光度法-水素化合物発生装置の一例
出典:https://www.sibata.co.jp/products/products1987/
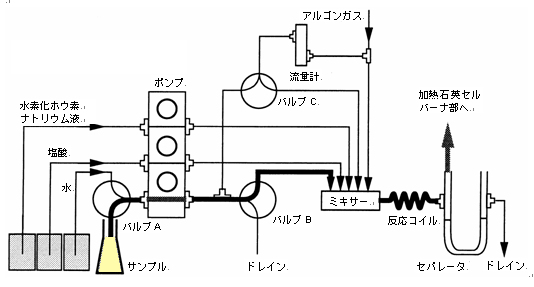
図4.3 連続式水素化合物発生装置の一例
出典:https://www.hitachi-hightech.com/hhs/products/tech/ana/aa/basic/aa_course6.html
水素化合物の濃縮装置
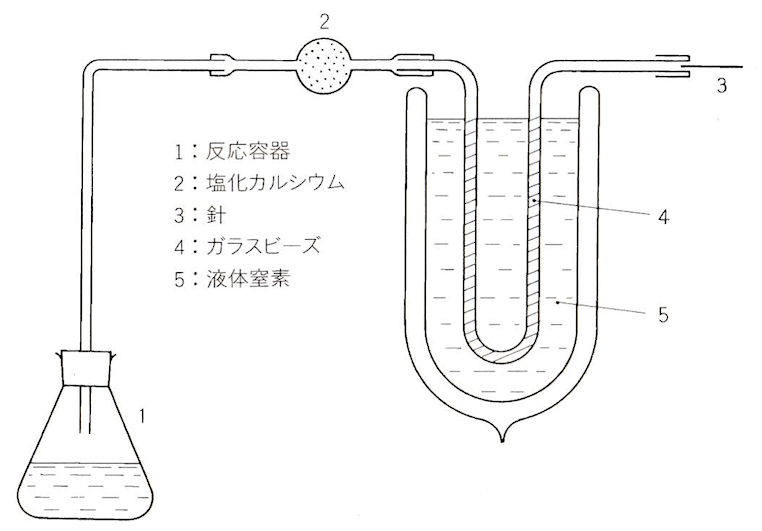
図4.4 水素化合物濃縮装置の一例 [Holak, 1968; 並木, 2018]
4.4 測定操作の注意事項
(1) 試料の保存
以下にして保存する。常温保存・1ヶ月を保存の目安とする。
(2) 前処理
① 有機物や懸濁物質を含む一般的な試料 → 硝酸・硫酸による分解 [セレン化合物 → Se(Ⅵ)]
分解後、塩酸による加熱処理よる予備還元操作を行う [Se(Ⅵ) → Se(Ⅳ)]。
② 有機物を多く含む試料 → 硝酸・硫酸・過塩素酸による分解 [セレン化合物 → Se(Ⅵ)]。
注意) 試料の前処理において、セレンの化学形態の変化に留意する。上記 2.5-(1) 酸化還元反応を参照。
(3) その他
環境基準及び水道水質基準値の設定根拠は「Longnecker(1991)、Yang(1983)、Jaffe(1976)のヒト臨床生化学的徴候から、人に対するNOAEL(無毒性量)0.004mg/lから、水の寄与率を10%、体重50kg、飲用水量21/dayとして、基準値を0.01mg/l以下とした。」とされている。
4.5 測定方法の選定
水質汚濁に係る環境基準において、水素化合物発生ICP発光分光分析法と水素化合物発生原子吸光法の2つの試験方法が指定されている。ICP質量分析法は、上水試験方法にしか指定されていない。
以上のことから、一般の環境水(河川・地下水・湖沼など)では、① 水素化合物発生ICP発光分光分析法、または ② 水素化合物発生原子吸光法を用いる。さらに妨害物質が少なく高感度測定が必要な場合は、他元素同時分析が可能な ③ ICP質量分析法が適している。
4.5 セレンの化学形態別測定
測定技術の進展により、最近では、化学形態別測定も可能な項目が増えつつあるが、形態別測定では条件設定などに十分な配慮が必要となるため、現在のところ、環境関連の法規制上の形態別測定の規定項目は少ない。
ところで、セレンについては、水中では、Se(Ⅲ)とSe(Ⅵ)の酸化物イオンが溶存種として安定に存在するが、それらの毒性に大きな差異はない。しかし、セレンに汚濁された水浄化において、Se(Ⅵ)は化学的に安定であり、基本的には厳しい条件でSe(Ⅲ)に還元した上で、様々な除去法が適用されている。
自然・人為にかかわらず、発生源については、岩盤・土壌・底泥・固形廃棄物からの溶出物であるSe2-、SeO3-やSeO42-など、生物代謝物である有機体セレン、揮発性のH2SeやCH3SeCH3(DMSe)など、化石燃料の燃焼よる飛灰やばい煙中のSeO2やSeO3など、セレン対策においては、それぞれの化学形態別測定が必要となる。本節では、上記の全てについて記載できないので、主として水浄化技術やその管理に必要な代表的な測定法について概説する。
(1) GC/LC-ICP-AES/MS法
H2SeやCH3SeCH3など沸点の高いセレン化学種に対してはGC-ICP-AES/MSが、SeO32-、SeO42-や生物代謝物である有機体セレンに対してはLC-ICP-AES/MSが、それぞれ有用である。
また、分析時に化学形態変化を避け、比較的短時間で複数の化学形態分離と同時測定ができるGC/LC-ICP-MSが、現在では、最も有用な方法となっている。
表4.3に、クロマトグラフィーとICP-MSを結合した近年の化学形態別測定法の報告例を示す。LCにおいて、イオン対逆相クロマトグラフィー(Ion-pairing Reverse Phase)は多種の化学形態の分離に優れ、イオン交換クロマトグラフィーと比較して分解能が高い特徴がある。しかし、共存物の干渉を受けやすく、実試料への適用が難しいとされ、最近では主にイオン交換クロマトグラフィー(Anion Exchange、Cation-Exchange)が多く用いられるようになった。
セレン(Ⅳ)、セレン(Ⅵ)、トリメチルセレノニウム(TMSe)、セレノシステイン(SeCys)、セレノメチオニン(SeMet)などについては、オクタデシル基とアミノ基を当モルずつ化学結合したシリカゲルを固定相とし、逆相とイオン交換の両方の性質を有するカラムで分離可能である。

Se(Ⅳ)*、Se(Ⅵ)*:① 水中のSeO32-を揮発性のpiazselenolへ変換・気化し、GC-ICP-MSで測定、② SeO42-をSeO32-へ還元した後、①の方法で測定。
(2) 他の形態別測定法
<セレンの測定に係る JIS K 0102 67の検索・閲覧>(2019年4月、現在)
日本産業標準調査会のデータベースのJIS検索ページにアクセスし、次の順に操作する。
① JIS検索ページ: JIS規格番号検索枠 JIS[K0102] に左記の赤字記号を入力
② JISリストページ: JISK0102 をクリック
③ JIS規格詳細画面: K0102_001(PDFファイル・・・) をクリック
④ K0102: 2016ダウンロード: セレンについては、pdf 画面のボトムの [295]/371 に左記の赤字頁数を入力
他元素については、目次(2~8頁)より、該当元素の [頁数+8] を上記④の赤字頁数の代わりに入力
参考文献
Charlot,G.: Les Reactions Chemiques En Solution, Masson(1969)
Cotton,F.A. & G.Wilkinson: Advanced Inorganic Chemistry, John Wiley & Sons(1972)
Gallus,S.M., K.G.Heumann, J. Anal. At. Spectrom., 11, 887(1996)
Holak, W.: Anal. chem., vol.41, 1712(1969)
Hurlbut, C.S. & C.Klein: Manual of Mineralogy, 19th Ed., John Wiley & Sons(1977)
Pauling,L.: The Nature of the Chemical Bond, Cornell University Press(1960)
Quijano,M.A., A.M.Gutierrez, M.C.Perez-Conde, C.Camara, J. Anal. At. Spectrom., 11, 407(1996)
Yang, K.L., S.J.Jiang, Anal. Chim. Acta, 307, 109(1995)
池 道彦、他:環境バイオテクノロジー学会誌、Vol.15, No.2, 71-75(2016)
海洋科学基礎講座編集委員会編:海洋生化学、東海大学出版会(1973)
金属資源情報:(独法)石油天然ガス・金属鉱物資源機構、データベース、鉱物マテリアルフロー2011 セレン(Se)(2012)
桐山 良一、桐山 秀子:構造無機化学Ⅰ~Ⅲ、共立出版(1964, 1965, 1966)
厚生省:日本人の食事摂取基準(2015年版)各論・ミネラル(微量ミネラル)
甲斐 徳久・上田 正・長友 洪太:The Journal of Shimonoseki University of Fisheries, Vol.41, No.2, pp.57-60 (1993)
並木 博:詳解 工場排水試験方法 JIS K 0102: 2013、日本規格協会(2018)
山田 秀和:ぶんせき、433-440(1994)
目次へ
掲載日:2019年08月12日
更新日:2019年08月21日
