村上定瞭(水浄化フォーラム)
2.ウイルスの特徴-構造と種類
3.ウイルスの増殖
4.ウイルスの検出
5.ウイルスと生物進化
6.ウイルスと病気
7.ウイルス感染と予防・治療
8.ウイルスと生態系
9.ウイルスの利用
参考文献
注意)本ページは、複数のサブページから構成されているので、目次を基点に閲覧してください。また、文章、図表、イラストなど適宜、修正・追加を行いますので、最終更新年月日(ページボトムに示す)を確認してください。
従前において、ヒトや農畜水産に係る動植物に係る病原性ウイルスに係る研究が中心であった。分子生物学に係る様々な測定機器や実験手法の進展により、環境中には膨大な種・数のウイルスが存在し、地球上生態系において重要な役割を担っていることが分かってきた。本websiteでは、水浄化に関わる科学と技術を扱っており、上記の病原性だけでなく、環境中ウイルスに係る知見の理解が必要である。
また、ヒトゲノムのうちウイルスが持ち込んだ可能性がある遺伝子は、全体の46%を占めており、ヒト進化や様々な働き(細胞の分化と器官
組織形成・維持、個性の発現、免疫細胞の発現など)があるのではないかと考えれている(図1)。
なお、現在、世界中で猛威を振るっているCOVID-19の病原ウイルスであるSARS-CoV-2については、別ページに記載している。
本ページでは、多くの写真・イラストなどを引用している。原著をリンクしているので、参照して理解を深めていただきことと、それらの原著者や関係機関へ御礼を申し上げる。
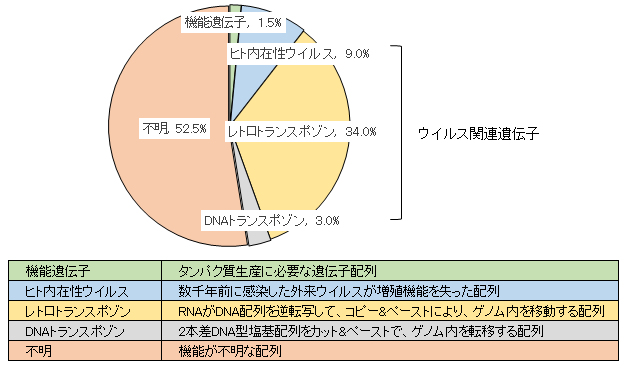
図1 ヒトゲノムのうちウイルスが持ち込んだ可能性があるの遺伝子
1.ウイルスとは
(1)宿主が必要
A) 簡単な構造
ウイルスは細胞がなく、細菌よりさらに単純な構造である。タンパク質でできた「カプシド」という殻のなかに遺伝子情報となる核酸が収められている。また、インフルエンザウイルスなど一部のウイルスには、カプシドの外に「エンベロープ」という膜で覆われているものもいる。図1-1には示していないがエンベロープ膜には、宿主細胞膜・壁上の受容体に付着するためのスパイクタンパク質(S)に加えて、Sの並びを調整したり、子ウイルスが細胞から離脱に必要なタンパク質などを含んでいる。エンベロープの有無により、ノンエンベロープウイルス(non-enveloped virus)、エンベロープウイルス(enveloped virus)と呼んでいる。
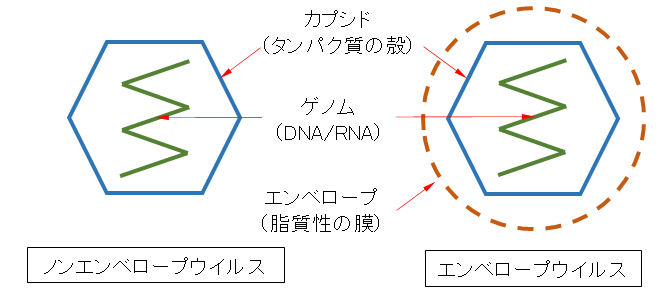
図1-1 ウイルス粒子の基本構造
B) 自活できない
ウイルスは自分の力では増殖することができない。生きた他生物(細菌、動植物)の細胞(宿主)に侵入し、宿主から細胞が増殖に必要な遺伝・構成材料を宿主から調達して、自己の複製を行う。
①細胞がない、②栄養を摂取したり、エネルギーを生産したりしない、③自力で動くことはできない、④ウイルス単体は自力で増殖できない。
C) 宿主が限定
他生物のいずれの細胞にも侵入できることはできず、特定生物またはその特定細胞(宿主という)にのみに侵入することができる。宿主細胞は、ウイルスの種類によって様々に異なる。
D) 増殖のしくみ
細胞は2分裂によって増殖するが、ウイルスは数百~数千個のコピーを一度に複製して増殖するので、増殖速度が桁違いに速い。しかし、ウイルスの中には、その遺伝子を宿主細胞のゲノムに組み込まれて、ゆっくりと増殖したり、条件が整うと発現と増殖を開始するものもいる。
(2)多種多様性と突然変異
ウイルスは、生きている宿主の細胞内で繁殖するので、宿主生物にとっては病原体となる。感染すると、宿主細胞は、元のウイルスの何千もの同一のコピー(複製)を迅速に生成する。ほとんどの生物とは異なり、ウイルスは分裂する細胞がなく、感染した宿主細胞内で新しいウイルス粒子(ビリオン)が組み立てられる。しかし、プリオンのような単純な感染性化学物質とは異なり、ウイルスは遺伝子コピー時における突然変異により進化することができる。また、宿主細胞の遺伝子を自らのゲノムに組み込んだり、自らの遺伝子を細胞ゲノムに挿入したりもする。
環境中に存在する数百万種のウイルスのうち、確認されているものは4,800種程度である。それらの起源は明らかになっていないが、プラスミド (細胞間を移動できるDNAの断片)から進化したものもあれば、一部は細菌 (バクテリア)から進化した可能性もある。
(3)分類上の論争
ウイルスが生物であるかどうかは研究者によって意見が別れている。しかし、下記の理由などから「生物である/ない」といい切れないことも事実である。
①ここ数十年において、生物が有する機能を一部もつ巨大なウイルスが発見され、様々な環境に存在(各種生物細胞内での活動やビリオンとして土壌・水中・空気中に存在)していることが分かってきた。
②ウイルスが生物の進化に深く関与していることが分かってきた。
③ウイルスの多様性により、生物とウイルスの区別ができない重複した機能を有するものが存在する。
④生物ゲノム内にウイルス遺伝子が組み込まれ、活動中・休止中や機能欠損など、生物の進化や生物の活動に利用されている。
ウイルスを生物だと主張する論者もいるが、その場合、サテライトウイルス・ウイロイド・プリオンなどをどのように位置付けるのか疑問が残る。また、細胞生物におけるトランスポゾンやプラスミドなども考慮に入れると、「疑似生命体」の地位のあいまいさは連続的であり、どこに境界線を引くのかは難しい。①自己増殖だけでなく、②自己保存(代謝機能)と③細胞構造も生物定義に加えることが適切であろう。
注)サテライトウイルス:サテライト(Satellite)とは感染性の核酸(DNAまたはRNA)で、他のウイルス(ヘルパーウイルス)が同じ細胞に感染していることで、自身の増殖が可能となる。
注)ウイロイド:ゲノムはむき出しの1本鎖環状RNAで、それを包むカプシドタンパク質はない。植物細胞に感染する。
注)プリオン:タンパク質のみで構成され、DNAやRNAはない。プリオンは細菌やウイルスが不活化される温度では、感染力が欠失することはなく、この病気にかかっている動物の肉を食べると感染する。ヒツジではスクレイピー、ウシでは牛海綿状脳症(BSE)、ヒトではクロイツフェルト・ヤコブ病という病名で知られている。プリオンは体内、特に脳に多く存在しており、正常型(α-ヘリックス型立体構造のタンパク質)は酵素分解されるが、異常型(β-シート型の堅固な立体構造のタンパク質)には分解酵素がない。正常型が異常型に接触すると、異常型へ変換され、時間とともに異常型が蓄積して脳細胞が破壊されて脳組織がスポンジ状となる。
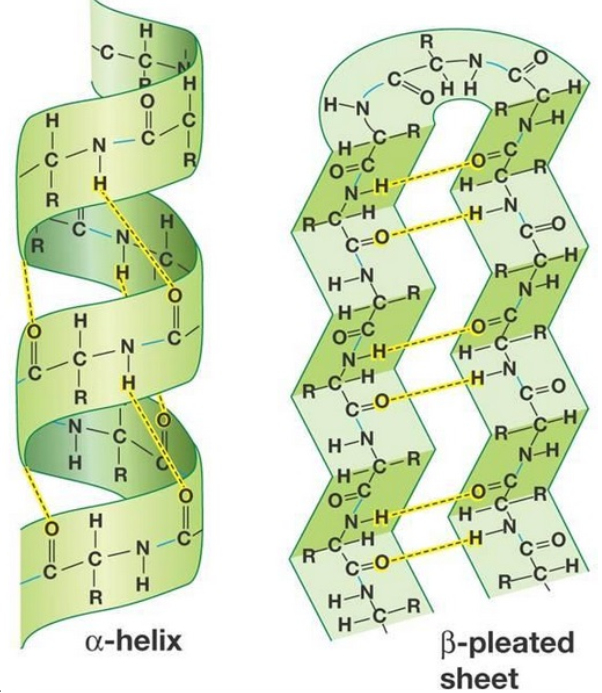
図1-2 タンパク質の二次構造
2.ウイルスの特徴―構造と種類―
また、細菌の細胞の多くは植物と同じように細胞膜・細胞壁によって区切られているが、マイコプラズマなどの一部の細菌では、例外的に細胞壁のないものもいる。
(1)ビリオンの形状と基本構造
ウイルス粒子はビリオンとも呼ばれ、カプシドと呼ばれるタンパク質の保護膜に囲まれたDNAやRNAから作られた遺伝子で構成されている。カプシドは、カプソメアと呼ばれる多くの小さな同一のタンパク質分子で構成されている。カプソメアの配置は、正二十面体 (20面体)、らせん状、またはより複雑なものがある。DNAやRNAの周りには、タンパク質でできたヌクレオカプシドと呼ばれる内殻がある。一部のウイルスは、エンベロープと呼ばれる脂質 (脂肪) 膜で覆われているので、石鹸やアルコールに対して脆弱である。
(2)大きさ
ウイルスは最小の感染性病原体の一つであり、光学顕微鏡で見るには小さすぎて、ほとんどのウイルスは電子顕微鏡でしか見ることができない。その大きさは20~300nmで、1cmまで伸ばすには、それらを30,000~500,000個並べる必要がある。それに比べて、細菌は通常、直径が約1000nm (1μm) であり、高等生物の宿主細胞は通常、数10μmである。メガウイルスやパンドラウイルスなどの一部のウイルスは、比較的大きなウイルスである。アメーバに感染するこれらのウイルスの大きさは約1000nmで、2003年に初めて発見された[La Scola, 2003]。これらのウイルスはインフルエンザウイルスの約10倍幅広く (したがって体積は1000倍)、これらの「巨大」ウイルスの発見は科学者たちを驚かせた。
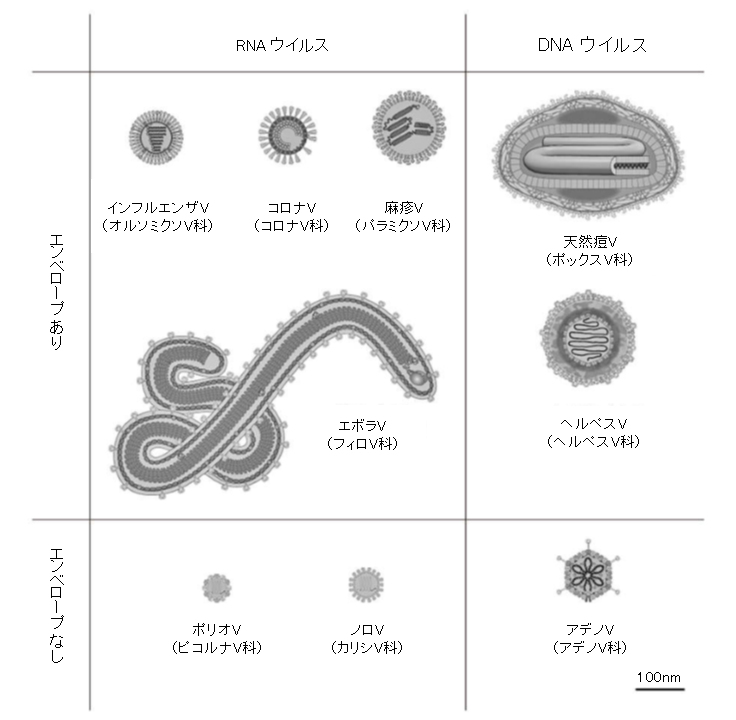
図2-1 ウイルスの基本構造と大きさ
(3)ゲノムの種類
ウイルスのゲノム(g:genome)は、一般的には、DNA(gDNA)またはRNA(gRNA)として保存されている。このゲノムには、(1) 自己を複製する酵素、(2) 宿主細胞に吸着・侵入する酵素、(3) 宿主の持つ免疫機構から逃避する酵素などをコードしている。これらの (1)~(3) の特徴は、ウイルス感染とその対策にとって、極めて重要な知見である。
ウイルスゲノムの種類によって、次の(A)~(C)に示すように増殖の仕組みが異なる。
(A) DNAウイルスは宿主DNA(dsDNA)にまぎれ込み、そのゲノムDNA(gDNA)を鋳型として、RNAポリメラーゼによってmRNAを合成し、そのmRNAからタンパク質を合成・増殖する。gDNAには2本鎖dsDNA(第1群)、1本鎖ssDNA(第2群)の2つに分類される。
(B) RNAウイルスには、(1) ゲノムRNA(gRNA)からDNAを介さずに宿主ドグマを利用して増殖するものと、(2) gRNA(ssRNA-RT)をいったん逆転写酵素によってDNA(dsDNA)へ変換し、そのDNAが宿主DNA(dsDNA)にまぎれ込み、その宿主ドグマを利用して増殖するものに分けられる。(2)を特にレトロウイルスという。
(C) gRNAは、さらに、2本鎖RNA(dsRNA)(第3群)および1本鎖RNA((±)ssRNA)に分けられる。(a) (+)ssRNAでは、ゲノムRNAがそのままmRNAとして機能し、そのまま宿主ドグマにより翻訳されて、増殖する(第4群)。(b) (-)ssRNAでは、RNAポリメラーゼにより、相補的な配列である(+)ssRNAへ変換され、これがmRNAとして宿主ドグマに組み込まれて増殖する(第5群)。
(D) レトロウイルスには、1本鎖RNA逆転写ウイルス(ssRNA-RT、第6群)と2本鎖DNA逆転写ウイルス(dsDNA-RT、第7群)がいる。第6群では、ssRNA-RTは逆転写を行ってdsDNAをつくり、それが宿主DNAにまぎれ込み、宿主のセントラルドグマを利用する。第7群では、子カプシド(gDNAを包み保護するタンパク質の殻)が生産されると同時に、RNA-RTがつくられ、これによってds(-)DNAがつくられたのち、gDNA(dsDNA-RT)が生成する。

<解説>
ウイルスは細胞外では粒子構造として存在する。即ち、ゲノム(遺伝情報)としての核酸が、タンパク質の殻に包まれている。ウイルス粒子はそれが次の宿主細胞に出会うまで、遺伝情報を保護している。
マイナス一本鎖鎖ss(-)RNAあるいは2重鎖のdsRNAを遺伝情報として持つウイルスは、次の宿主に入ってもゲノムがmRNAの構造をしていないので、遺伝子の発現が出来ない。このようなウイルスは、必ず、ウイルス粒子内にRNAポリメラーゼを発現する遺伝子を持っている。
宿主細胞に入ると、まずウイルス粒子内のポリメラーゼ遺伝子が発現し、ゲノムRNAを鋳型としてmRNAを生成し、ウイルス複製に必要な非構造タンパク質(酵素)を生成し、次いでビリオンを形成する構造タンパク質が作られる。
ウイルスの遺伝子のサイズは限られている。例えば、ポリオウイルスは約 8,000 塩基からなる。1遺伝子 1,000 塩基として、タンパク質としては8種類しか作れない。作れるタンパク質の種類は限られているので、ウイルス粒子は数種類のサブユニットタンパク質(capsomere)が会合して、タンパク質の殻が組み立てられる。
この様な会合体が安定な構造を取るには対象形の構造を取る必要がある。各サブユニットは非対象形である。非対象形のものを3次元空間に並べ安定な対象形のものを作るには、ラセン対象(
helical symmetry)または正20面対象(icosa-hedral symmetry)のいずれかである。このような殻をカプシドと云う。
ウイルスにより、カプシドがさらに細胞膜と同じ脂質2重膜に囲まれているものがある。それにウイルスのエンベロープタンパク質が突き刺さっている。
食中毒を起こすノロウイルス、小児まひを起こすポリオウイルス、風邪の症状を起こすアデノウイルスなどはエンベロープを持たない。SARSコロナウイルス、エイズウイルス(HIV)、B型・C型肝炎ウイルス、インフルエンザウイルスなどはエンベロープウイルスである。
(4)ゲノムの非分節と分節
RNA鎖・DNA鎖を問わず、また、それが1本鎖・2本鎖を問わず、ウイルスの全ゲノムが、①一つの線状鎖で構成されるものを非分節型といい、②複数の線状鎖に分かれて構成されるものを分節型という。
例えば、ヒトコロナウイルスのゲノムは一つのみのss(+)RNA鎖で構成された非分節型ゲノムであり、MERS-CoVやSARS-CoV-1/2などがこの型のウイルスゲノムである。
一方で、インフルエンザウイルス(図2-2)のゲノムは、A/B型は8分節、C/D型は7分節のss(+)RNA鎖で構成される分節型ゲノムである。例えば、A型インフルエンザの場合には、ウイルス表面の突起には、HA(ヘマチルニン)とNA(ノイラミニダーゼ)があり、HAは16種類、NAは9種類ある。この組合せでだけでもHA1~16NA1~9の144通りの亜型ゲノムがあり、亜型の遺伝子は8分節の中にそれぞれコードされている。例えば、A型インフルエンザウイルスは、もともと水鳥のカモの仲間を自然宿主として共生関係にあり、このウイルスに感染しても、普通には病気にはならない。ところが、異なる亜型ウイルスが同じ細胞に感染すると、ウイルス粒子(ビリオン)の生成過程で、他の亜型の分節が紛れ込んで新しい組合せのゲノムが生まれることがある。H5N1やH7N9などのヒトへの感染力が強く重い症状が現れる「高病原性」ウイルス亜型が知られている。
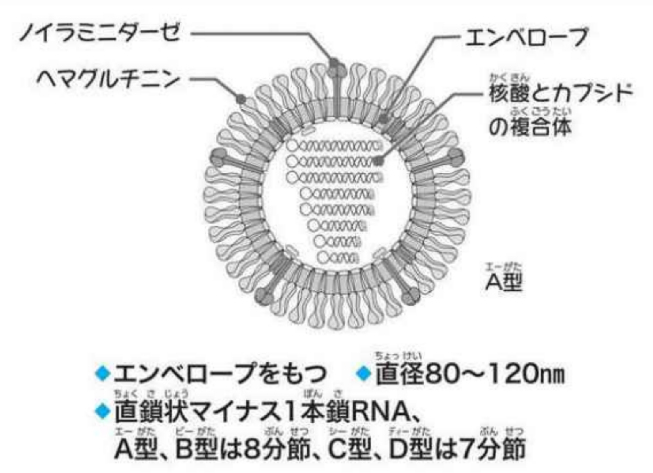
図2-2 インフルエンザウイルス
武村正春・宮沢孝幸:ずかん ウイルス(kindle版)、p.64(2020)
3.ウイルスの増殖
<解説>コロナウイルスの細胞感染とビリオン複製
1) コロナウイルスビリオンは、表面上に突起しているスパイクタンパク質(S、S1~3のサブユニットの3量体)、膜タンパク質(EおよびM)、ヌクレオカプシド(N)、および、一部のベータコロナウイルスではヘマグルチニンエステラーゼ(非表示)、で構成されている。一本・プラス鎖RNA型のウイルスゲノム(ss(+)RNA、表2-1に示す第4群)はNによってカプセル化・保護されており、MとEは、ビリオン形成プロセス中にウイルス粒子に確実に組み込まれる。S1タンパク質は宿主由来のウイルスエンベロープから突出し、以下に示す宿主細胞(以下、細胞と略称)表面の受容体に特異付着し細胞内へ侵入する。
2) コロナウイルス粒子、例えばSARS-CoV-2では、細胞膜上のアンジオテンシン変換酵素2(ACE2)にS1が結合する。細胞膜上の酵素(セリンプロテアーゼTMPRSS2)がS1を切断して、露出したS2が細胞膜へめり込み、ウイルスエンベロープEと細胞膜が融合すると、ゲノムRNA(gRNA)を包んだヌクレオカプシドが細胞質へ挿入される。ヌクレオカプシドは包を開いてg-RNA(ss(+)RNA=mRNA)を放出し、そのORF1aとORF1bの2つの大きなオープンリーディングフレーム(ORF)が宿主リボソームrRNAにより即座に翻訳される。
注)ORP(open reading frame):分子遺伝学において、ORPとは、タンパク質に翻訳される能力を持つリーディングフレームのことで、開始コドン(通常はAUG)で始まり、終止コドン(通常はUAA、UAG、UGA)で終わるコドンの連続した一続きである。
3) 生成したポリタンパク質pp1aおよびpp1bは、同時翻訳・翻訳後処理されて、ウイルス複製および転写複合体を形成する個々の非構造タンパク質(nonstructural proteins: nsps)になる。SARS-CoVにおいては、16個のnspを有し、宿主細胞の維持活動(代謝・防御機能など)を停止したり、自己のゲノム複製および構造タンパク質合成を調整したり、4)で述べる合成した各パーツ(複製ゲノムと構造タンパク質)を組み立てて(assembly)、複製ビリオンの形成環境を作り上げる。また、gRNAサイズが大きいので自己のコピーミスを修正するnspもあるが、DNA修復ほど正確ではないので変異が発生する。
4) nspsが発現すると、核周囲二重膜小胞(DMV)、回旋状膜(CM)、および開いた二重膜小球(DMS)から構成されるウイルス複製オルガネラが形成され、ウイルスゲノムgRNA複製のための微小な保護環境を構築する。
コロナウイルスmRNAに特徴的な巣状集合体を含むサブゲノムmRNA(sg-mRNA)により転写・翻訳された各種の構造タンパク質(structural proteins)は、小胞体(ER)膜に移動し、ERからゴルジへの中間コンパートメント(ERGIC)を通過する。ここで、Nがカプセル化され、それと新しく生成されたgRNAとの相互作用により、分泌小胞コンパートメントの内腔に出芽する。
5) 最後に、複製ビリオンはエキソサイトーシス(exocytosis)によって感染細胞から外へ分泌される。
注)変異と病原性:上記のS1の細胞受容体に結合する部分に1塩基でも変異が起こると、感染力に大きく影響を与えることがある。また、nspに変異が起こると、症状に大きな影響を与えることがある。したがって、感染力と無/軽/重症化とは区別する必要があろう。加えて、ヒトの免疫機構は個人差(年齢・性別も含む)が大きく、パンデミック対策は簡単ではない。
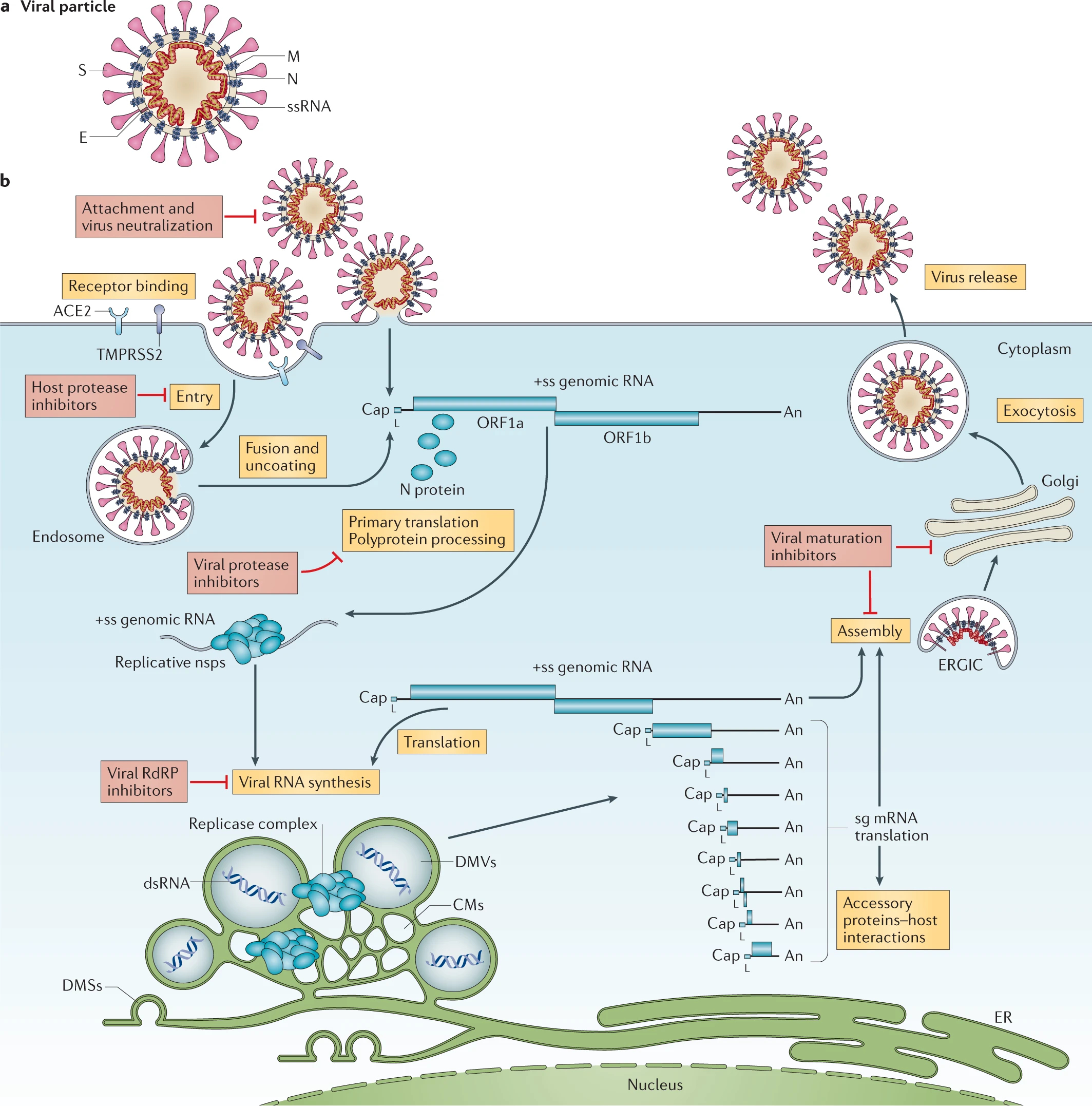
図3-1 コロナウイルスの細胞感染とビリオン複製
V’kovski, p. et al., Coronavirus biology and replication: implications for SARS-CoV-2, Nature Reviews Microbiology volume 19, pages155–170 (2021)
3.1 ウイルス粒子の細胞への付着
付着(または結合)にはウイルス側と細胞側両方にお互いを認識する物質が必要である。
例えば、AIDS(後天性免疫不全症候群)の原因である、ヒト免疫性不全ウイルスHIV(表2-1の第6群)のエンベロープタンパク質はヒトの特定T細胞(ヘルパーT細胞)上の細胞表面のマーカー分子CD4を認識し感染する。CD4分子はヒトとチンパンジーの CD4+T細胞(T細胞:Tリンパ球T lymphocyteでTは胸腺thymusの頭文字、+:Tで活性化された細胞)にしか存在しないから、HIV に感染するのはヒトかチンパンジーであり、感染する細胞はCD4+T細胞のみである。
つまり、付着は宿主・組織特異性を決める1つの段階である。最近CD4の他に2種類のサイトカイン(細胞から分泌される低分子のタンパク質で生理活性物質の総称)レセプターCD4またはCD8がHIV感染に必要なことが分かり、それぞれ、マクロファージあるいはT細胞への親和性を決めていることが分かった。また、この様なサイトカインレセプター(受容体)遺伝子を欠く個体ではHIVの感染があまり起こらないことも分かって来ている[Science 272, 1740, 1996]。
3.2 細胞内への侵入
a) 動物細胞
動物細胞には、次節に記載する細菌や植物と異なり細胞壁がなく、細胞膜のみによって細胞質が仕切られている。そのため、ウイルスの侵入には幾つかの方法がある(図3-2)。動物ウイルスの内、一部のエンベロープを持つウイルスはそのエンベロープが宿主細胞の細胞膜と融合することにより開始する。これを、エンベロープ膜融合(envelope fusion) と云う。この機構で取り込まれないエンベロープウイルスもある。この様なウイルスやエンベロープを持たないウイルスの場合には、細胞が他の物質を取り込む機構(エンドサイトーシス:endodcytosis)を利用し細胞内へ侵入する。
注)エンドサイトーシス、エキソサイトーシス:エンドサイトーシス (飲食作用) とは細胞が細胞外の物質を取り込む過程の1つ。細胞に必要な物質のあるものは極性を持ちかつ大きな分子であるため、疎水性の物質から成る細胞膜を通り抜けることができない、このためエンドサイトーシスにより細胞内に輸送される。これとは逆に、細胞膜の一部から細胞外へ小胞を形成する現象はエキソサイトーシス(開口分泌、exocytosis)と呼ばれる。タンパク質のような大きな細胞外物質(リガンド)が細胞膜上の受容体(レセプター)に結合することにより始まる。この受容体は多くの場合、細胞膜表面のクラスリンタンパク質に関連づけられている。
このクラスリンは細胞膜表面を覆い窪みを形作っている。受容体がリガンドと結合するとクラスリンに覆われた穴は深くなり細胞質の中に陥入、被覆小胞となる。細胞膜から離れた被覆小胞はすぐにクラスリンを脱離させ、初期エンドソームに融合する。初期エンドソーム内部はリソソーム同様にプロトンポンプの作用によって酸性に保たれている。ここで被覆小胞の膜内側に結合している受容体タンパク質の多くは再利用されるために細胞膜へと回帰する経路に乗る。一方、受容体に結合してエンドソーム内腔に取り込まれたリガンドは、酸性条件下で受容体のコンフォメーションが変化するに伴い乖離する。この際残りのタンパク質、その他膜構成物質等も遊離し、大半は再利用され再び細胞膜の形成に関わる。
エンドソームは後期エンドソームに成熟した後、リソソームと結合したりゴルジ体からの小胞と合体し、取り込まれたリガンドの消化などが行われる。
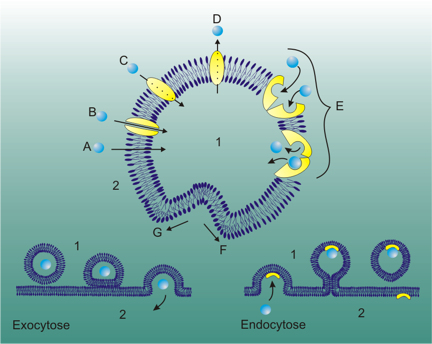
図3-3 エンドサイトーシス(飲食作用)とエキソサイトーシス(開口分泌)
https://ja.wikipedia.org/wiki/エンドサイトーシスb) 細菌
細菌に感染するウイルスをバクテリオファージと云う。細菌には細胞壁があるので、動物細胞のようにはいかない。従ってバクテリオファージは動物細胞ウイルスとは違った手段を取らなければならない。
T4ファージ(図3-4)やラムダファージは核酸の詰め込まれた頭(head)と核酸を細菌に注入するための尾(tail)がある。尾は注射器の針、頭は核酸の詰まった筒と考えれば良い。針は細胞壁を突き抜け細胞質に到達すると、ウイルスゲノムが注入される。f2 やQベータなどのRNAファージ(球形)、f1、M13、fd などのDNA ファージ(棒状)は性線毛に接着し、それぞれ線毛の側面あるいは先端からそれぞれのウイルスゲノムを宿主へ注入する。T4ファージなどは、子ファージを多数複製すると、宿主細胞を破壊(溶菌)して外部へ放出される。
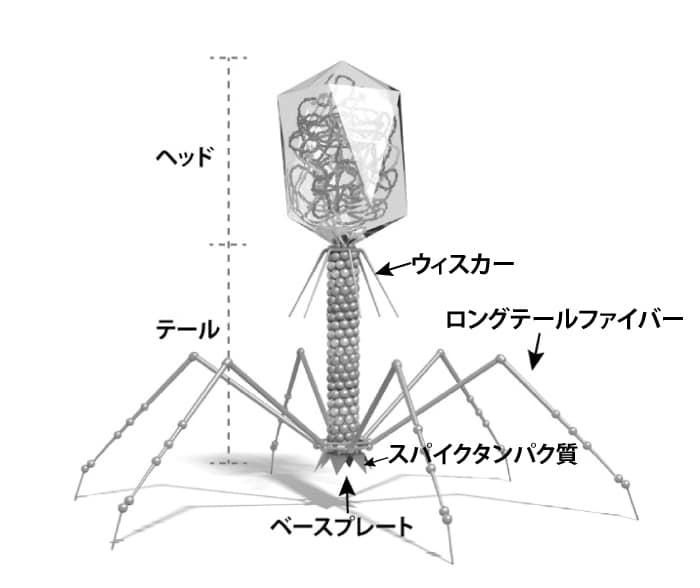
図3-4 T4ファージ
https://bacteriophage.jp/archives/1787c) 植物細胞
植物細胞は、細胞膜と細胞壁で囲まれており、ウイルスが直接に細胞内へ侵入できない。一般には、アブラムシなど口針を幼枝の先端部や茎・根などに差し込んで汁液を吸う昆虫類を介して感染する。
<解説>エンベロープウイルスの細胞侵入機構
エンベロープウイルスの細胞侵入は、細胞の表面か侵入するウイルス(MHV-JHM)、初期endosome を経由するもの(HIV)、endosome 内が酸性環境下になると侵入が成立するもの(IFV)、lysosomeでさらにcathepsinによりSタンパク質が活性化されて侵入が成立するウイルス(SARS-CoV)がある(図3-5)。SARS-CoV (図3-1)は細胞外のプロテアーゼによりSタンパク質が細胞表面で活性化され,細胞膜から直接侵入する。
a) 動物細胞
動物細胞には、次節に記載する細菌や植物と異なり細胞壁がなく、細胞膜のみによって細胞質が仕切られている。そのため、ウイルスの侵入には幾つかの方法がある(図3-2)。動物ウイルスの内、一部のエンベロープを持つウイルスはそのエンベロープが宿主細胞の細胞膜と融合することにより開始する。これを、エンベロープ膜融合(envelope fusion) と云う。この機構で取り込まれないエンベロープウイルスもある。この様なウイルスやエンベロープを持たないウイルスの場合には、細胞が他の物質を取り込む機構(エンドサイトーシス:endodcytosis)を利用し細胞内へ侵入する。
注)エンドサイトーシス、エキソサイトーシス:エンドサイトーシス (飲食作用) とは細胞が細胞外の物質を取り込む過程の1つ。細胞に必要な物質のあるものは極性を持ちかつ大きな分子であるため、疎水性の物質から成る細胞膜を通り抜けることができない、このためエンドサイトーシスにより細胞内に輸送される。これとは逆に、細胞膜の一部から細胞外へ小胞を形成する現象はエキソサイトーシス(開口分泌、exocytosis)と呼ばれる。タンパク質のような大きな細胞外物質(リガンド)が細胞膜上の受容体(レセプター)に結合することにより始まる。この受容体は多くの場合、細胞膜表面のクラスリンタンパク質に関連づけられている。
このクラスリンは細胞膜表面を覆い窪みを形作っている。受容体がリガンドと結合するとクラスリンに覆われた穴は深くなり細胞質の中に陥入、被覆小胞となる。細胞膜から離れた被覆小胞はすぐにクラスリンを脱離させ、初期エンドソームに融合する。初期エンドソーム内部はリソソーム同様にプロトンポンプの作用によって酸性に保たれている。ここで被覆小胞の膜内側に結合している受容体タンパク質の多くは再利用されるために細胞膜へと回帰する経路に乗る。一方、受容体に結合してエンドソーム内腔に取り込まれたリガンドは、酸性条件下で受容体のコンフォメーションが変化するに伴い乖離する。この際残りのタンパク質、その他膜構成物質等も遊離し、大半は再利用され再び細胞膜の形成に関わる。
エンドソームは後期エンドソームに成熟した後、リソソームと結合したりゴルジ体からの小胞と合体し、取り込まれたリガンドの消化などが行われる。

図3-3 エンドサイトーシス(飲食作用)とエキソサイトーシス(開口分泌)
https://ja.wikipedia.org/wiki/エンドサイトーシス
b) 細菌
細菌に感染するウイルスをバクテリオファージと云う。細菌には細胞壁があるので、動物細胞のようにはいかない。従ってバクテリオファージは動物細胞ウイルスとは違った手段を取らなければならない。
T4ファージ(図3-4)やラムダファージは核酸の詰め込まれた頭(head)と核酸を細菌に注入するための尾(tail)がある。尾は注射器の針、頭は核酸の詰まった筒と考えれば良い。針は細胞壁を突き抜け細胞質に到達すると、ウイルスゲノムが注入される。f2 やQベータなどのRNAファージ(球形)、f1、M13、fd などのDNA ファージ(棒状)は性線毛に接着し、それぞれ線毛の側面あるいは先端からそれぞれのウイルスゲノムを宿主へ注入する。T4ファージなどは、子ファージを多数複製すると、宿主細胞を破壊(溶菌)して外部へ放出される。

図3-4 T4ファージ
https://bacteriophage.jp/archives/1787
c) 植物細胞
植物細胞は、細胞膜と細胞壁で囲まれており、ウイルスが直接に細胞内へ侵入できない。一般には、アブラムシなど口針を幼枝の先端部や茎・根などに差し込んで汁液を吸う昆虫類を介して感染する。
<解説>エンベロープウイルスの細胞侵入機構
エンベロープウイルスの細胞侵入は、細胞の表面か侵入するウイルス(MHV-JHM)、初期endosome を経由するもの(HIV)、endosome 内が酸性環境下になると侵入が成立するもの(IFV)、lysosomeでさらにcathepsinによりSタンパク質が活性化されて侵入が成立するウイルス(SARS-CoV)がある(図3-5)。SARS-CoV (図3-1)は細胞外のプロテアーゼによりSタンパク質が細胞表面で活性化され,細胞膜から直接侵入する。
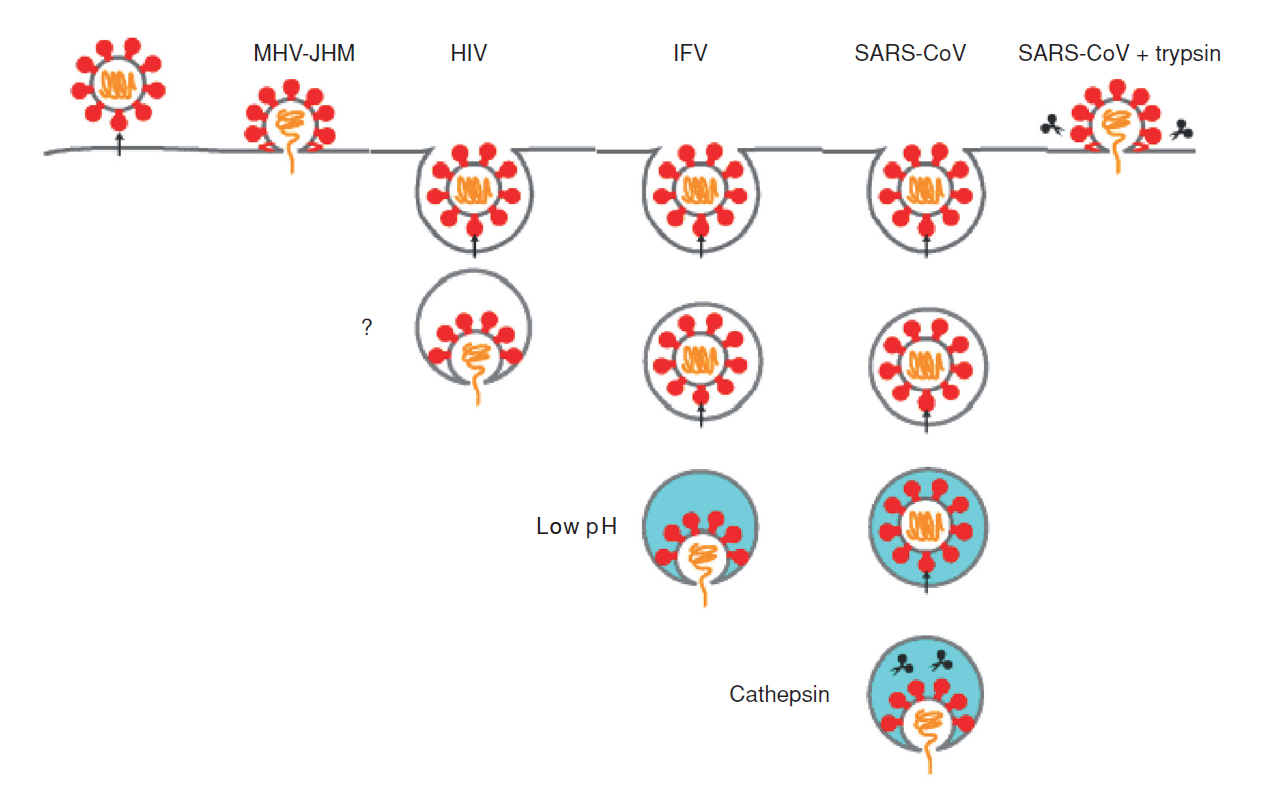
図3-5 コロナウイルスの細胞侵入機構
田口文広・松山州徳:ウイルス, 第59 巻, 第2 号, pp.215-222(2009).
3.3 ゲノムの発現と子ウイルスの複製
タンパク質の合成経路は、ウイルスゲノムのタイプにより、それぞれ異なる。表2-1に示した第1群~第7群の各ウイルスのタンパク質合成経路を図3-6に示す。
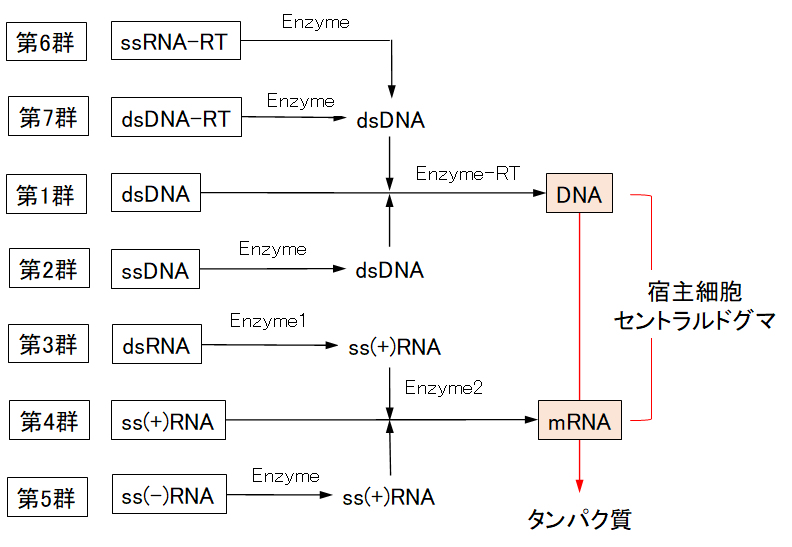
図3-6 ウイルスタンパク質の合成経路
<解説>セントラルドグマにおける転写と翻訳
生物の細胞内でタンパク質が合成される仕組みは、原核生物・真核生物で共通しており、これをセントラルドグマという。DNAを鋳型として、RNAポリメラーゼといわれる酵素によって、メッセンジャーRNA(mRNA)をつくられる。これを転写という。mRNAは最終的に組み立てられるタンパク質のポリペプチドの塩基配列(3塩基配列がそれぞれのアミノ酸を指定する)をコードしている。mRNAは移動して、リボソームRNA(rRNA)に組み込まれ、塩基配列コードに沿ってそれぞれ指定されたアミノ酸が順次結合され、ポリぺプチ(一次構造)が合成される。一次構造のポリペプチドは、二次構造→三次構造→四次構造を形成して機能性タンパク質になる。mRNAの塩基配列で指定された各アミノ酸は対応するそれぞれのトランスラーRNA(tRNA)によって供給される。
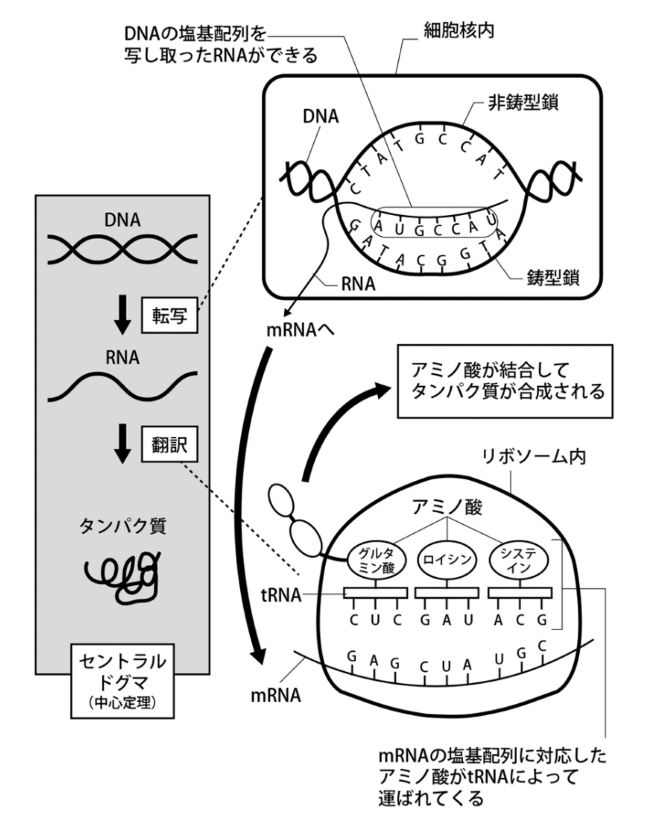
図3-7 DNAからタンパク質が合成される仕組み-セントラルドグマ-
武村正春:ヒトがいまあるのはウイルスのおかげ(kindle版)、1978/2840(2019)
<解説>スプライシング
原核生物では、鋳型DNAから転写されたRNAそのものがmRNAとして機能する。しかし、真核生物では、DNAから転写されたRNAは前駆体で、ポリペプチドの塩基配列をコードする遺伝子配列(エキソン)はイントロンといわれるアミノ酸をコードしていない介在配列により分断されている。この前駆体から、イントロンが取り除かれて具体的に機能するmRNA(成熟mRNA)へ変換される。鋳型DNA→mRNAのプロセスは全て核膜内で進行し、mRNAは核膜外へ移動してセントラルドグマによってタンパク質が合成される。
mRNAには、5’末端にキャプ(Cap)といわれる7-メチルグアノシン(MeG)と非翻訳塩基配列(UTR)、3′-末端にUTRとポリA尾部(Poly-A-tail)がそれぞれ付加される。原核生物・真核生物ともに、鋳型DNAの転写時に、mRNAに付加される。mRNAの両端に以上の付加物がないと、rRNAに組み込まれず、外来異物として直ちに分解される。また、UTRは、生物種によって異なる塩基配列を有し、自己と他者を区別している。
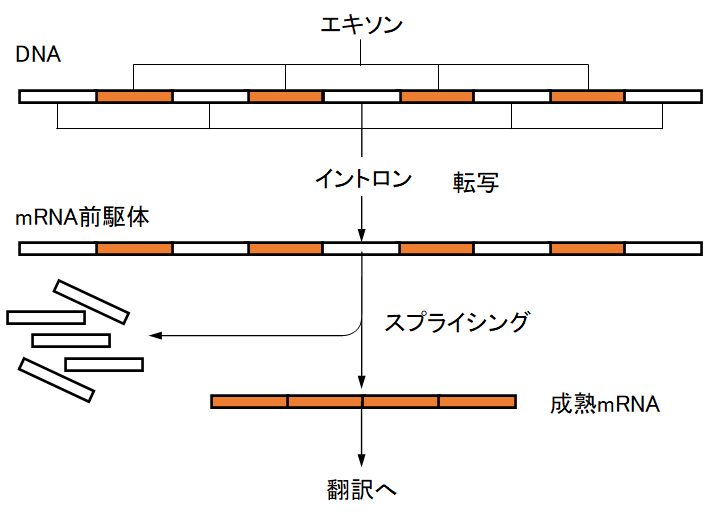
図3-8 RNAのスプライシングと成熟mRNA
<解説>変異
ウイルスは、特にRNAウイルスにおいて、急速に変異して新しいタイプを生み出す可能性がある。宿主は、そのような新しいタイプのウイルスに対して防御できないことが多い。例えば、インフルエンザウイルスは頻繁に変化するため、毎年新しいワクチンが必要になる。ほとんどの国に蔓延した2009年の豚インフルエンザのように、大きな変化がパンデミックを引き起こすこともある。多くの場合、このような変異は、ウイルスが他の動物宿主に最初に感染したときに起こる。このような「人獣共通感染症」の例としては、コウモリのコロナウイルスや、豚や鳥のインフルエンザウイルスが挙げられ、変異を起こして人に感染するようになる。
3.4 ウイルス粒子形成と細胞外への離脱
ラムダファージやポリオウイルスなどでは、核酸がカプソメア(capsomere)に包み込まれウイルス粒子が形成され、その後で細胞が融解しウイルスが放出される様に調節されている。
ラムダファージの場合、頭は頭、尾は尾として会合が起こり、次いで頭と尾が会合する(図3-9)。
それぞれの変異ファージを作製し、一つの菌では頭のタンパク質だけを作らせ、他の菌では尾だけを作らせる事ができる。カプシドに包まれるためのシグナル(cos)を持った DNA を、これらの菌の溶解液(lysate)と混ぜると感染性粒子が出来る。これをin vitro packagingという。
HIV のようなエンベロープウイルスでは、ウイルスカプシドはエンベロープタンパク質が集まっている膜の下に輸送され、そこから芽が出るように放出される(budding)。細胞は必ずしも融解しない。ここではウイルスの粒子形成と放出の過程が同時に起こる。
細菌には厚い細胞壁がある。従って、細菌の中でウイルス粒子が出来、細胞膜は壊れても、細胞壁内に閉じこめられ、外に出てこられない状況になることが予想される。つまり、細菌で増殖するバクテリオファージは何か細胞壁を壊す機構を持っている。実際、色々な機構が分かってきた。
一つの機構は、2重鎖DNAバクテリオファージに見られるもので、ファージのコードするendolysinが細胞壁を壊す現象である。しかし、endolysinが細胞壁に到達するには細胞膜を通過しなければならない。そのため、これらのファージは、endolysinを外に出すための細胞膜に発現するholinをコードしている。
第二の機構は細胞壁合成を止めることである。RNAファージであるQβファージや一本鎖DNAファージのφX174に見られる。例えば、φX174は、自身がコードするprotein-Eを細菌の細胞膜に発現させ、murein前駆体がlipid carrierへ受け渡される反応を止める[Science 292, 2263, 2001]。
(以下、執筆中)
参考文献
La Scola, B. et al.: A giant virus in amoebae. Science 299, 2033 (2003) doi:10.1126/science.1081867.
投稿掲載:2021年11月20日
最新更新:2021年12月09日
