村上定瞭(水浄化フォーラム)
解説の目的
本解説では、水質汚濁に係る環境基準・健康項目に指定されている非金属類、ほう素 B、ふっ素 F、ひ素 As、セレン Se、について取り扱う。
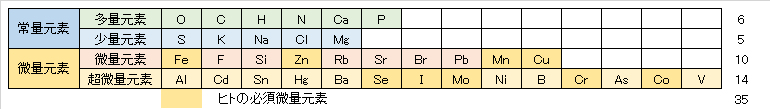
これらの元素は生体を構成する微量元素(表1)であり、水循環と食物連鎖を通じて、動植物に摂取されている。しかし、これらの摂取量が不足しても過剰となっても、動植物の生育や人の健康に障害を生じる。
環境基準および排出基準(項目によっても異なるが、概ね環境基準の10倍)を超える水質汚濁が生じた場合には、その対策が求めらる。
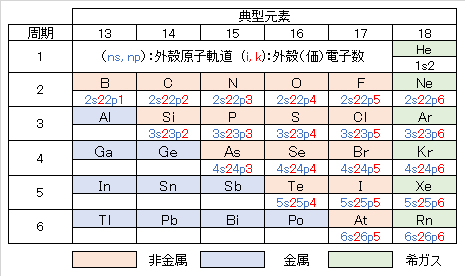
対策を計画・実施する際に、発生原因・状況の調査および対策技術の設計・施工・維持管理が必要となる。上記の健康項目の中で、元素の周期表に見られるように、外殻電子構造の類似性(表2)から、B は Be・Al・C・Si、As・Se は Si・P・Sと類似した挙動を示す。このことから、地殻(鉱床・土壌)・水(海水・地表水・地下水)・生体において、それぞれが共存した構成元素となっていることが多い。調査方法および対策技術において留意すべきことである。
また、定量測定における試料の採取・保存・分析操作(前処理・濃縮・測定機器)や対策技術においては、対象元素の物理・化学(表3)・生物学的性質に関する基礎的知識が求められる。
<解説の内容>
一連の本解説(子ページ)は、対象元素について、(1) 概要(自然界の状況、生活・工業利用、健康障害など)、(2) 物理・化学・生物学的性質、(3) 対策技術、(4) 測定方法から構成されている。
これらの元素は生体を構成する微量元素(表1)であり、水循環と食物連鎖を通じて、動植物に摂取されている。しかし、これらの摂取量が不足しても過剰となっても、動植物の生育や人の健康に障害を生じる。
環境基準および排出基準(項目によっても異なるが、概ね環境基準の10倍)を超える水質汚濁が生じた場合には、その対策が求めらる。
対策を計画・実施する際に、発生原因・状況の調査および対策技術の設計・施工・維持管理が必要となる。上記の健康項目の中で、元素の周期表に見られるように、外殻電子構造の類似性(表2)から、B は Be・Al・C・Si、As・Se は Si・P・Sと類似した挙動を示す。このことから、地殻(鉱床・土壌)・水(海水・地表水・地下水)・生体において、それぞれが共存した構成元素となっていることが多い。調査方法および対策技術において留意すべきことである。
また、定量測定における試料の採取・保存・分析操作(前処理・濃縮・測定機器)や対策技術においては、対象元素の物理・化学(表3)・生物学的性質に関する基礎的知識が求められる。
<解説の内容>
一連の本解説(子ページ)は、対象元素について、(1) 概要(自然界の状況、生活・工業利用、健康障害など)、(2) 物理・化学・生物学的性質、(3) 対策技術、(4) 測定方法から構成されている。
非金属元素の概要
目次へ
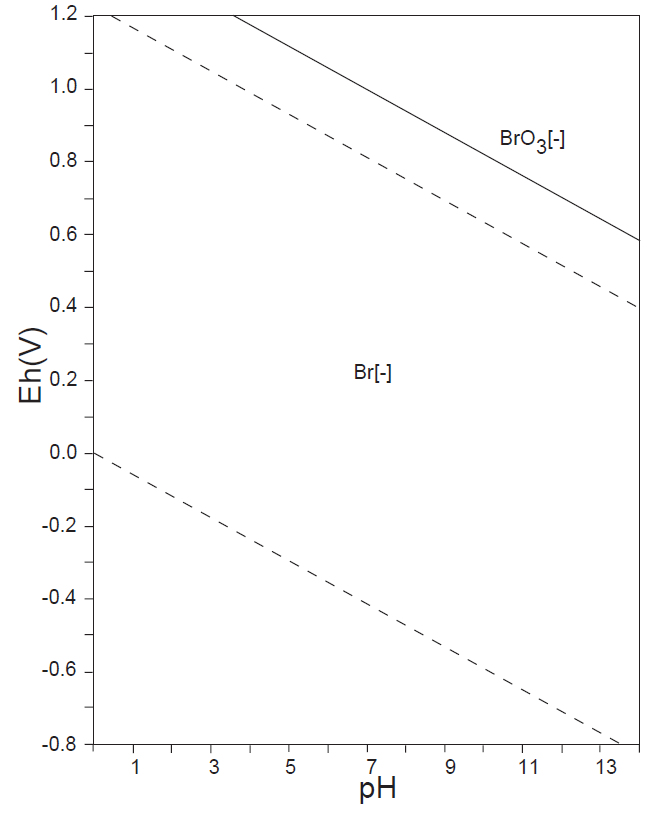
水溶液の酸化還元電位 E-pH と非金属元素の酸素酸イオンの化学形態
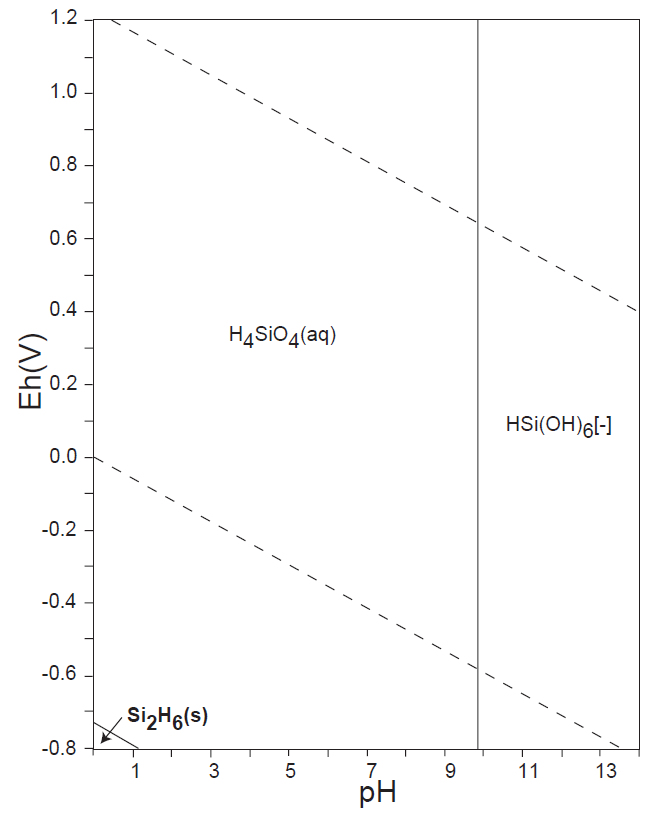
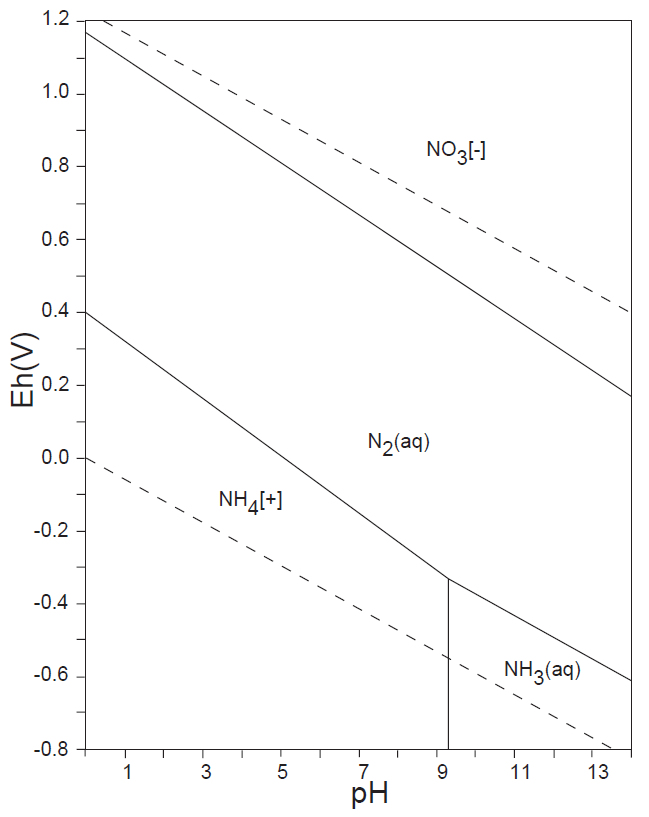
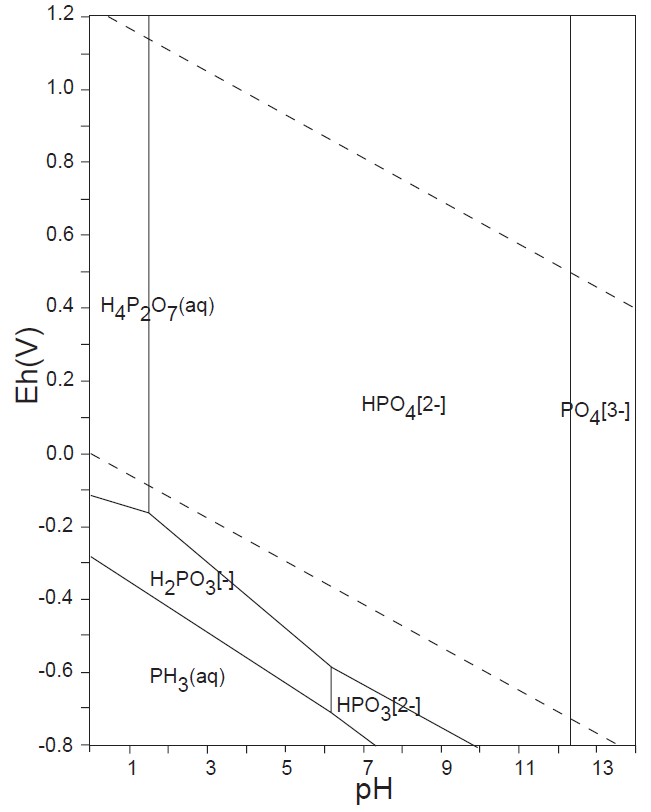
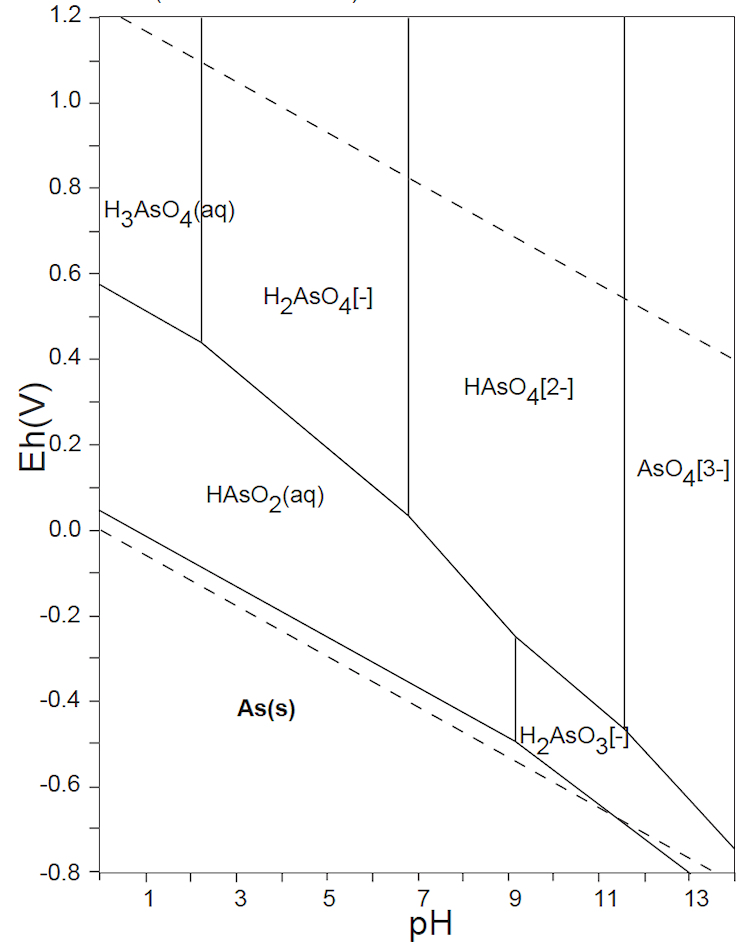
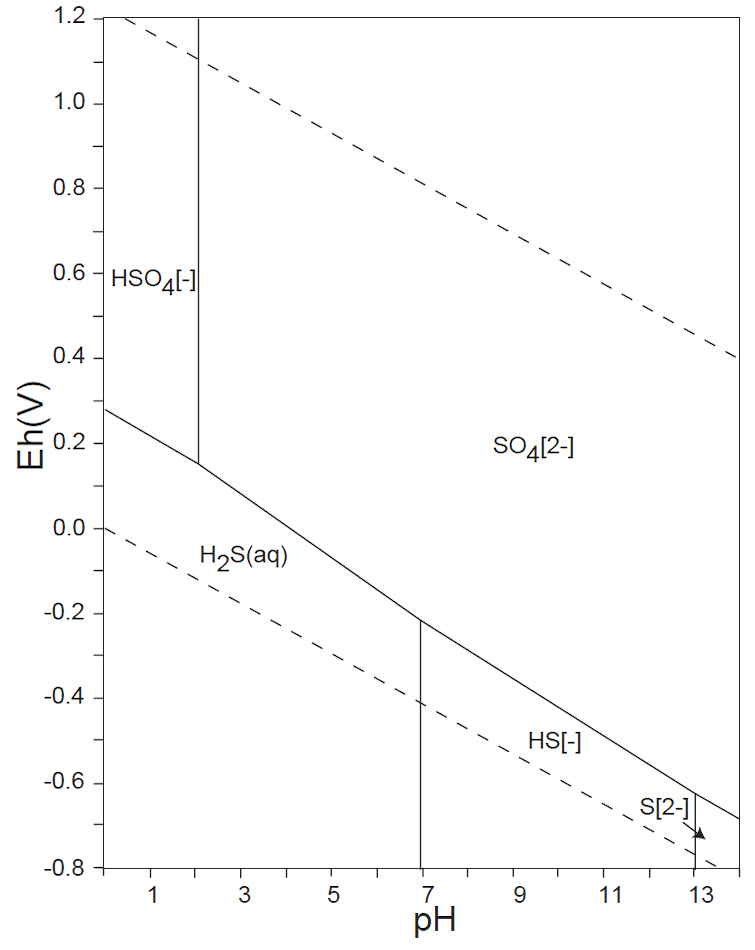
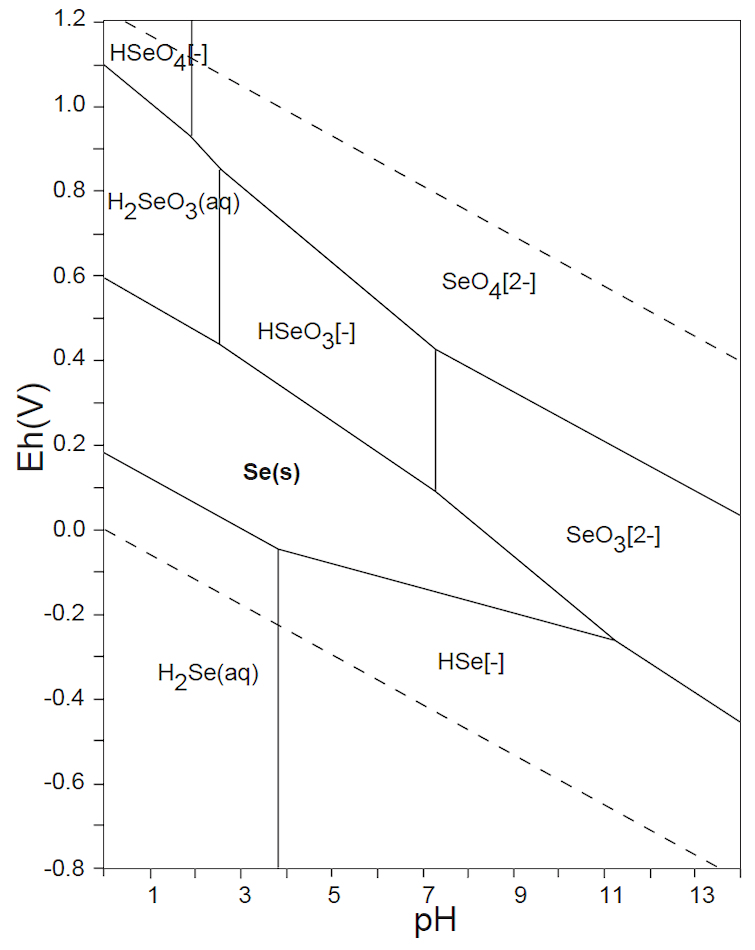
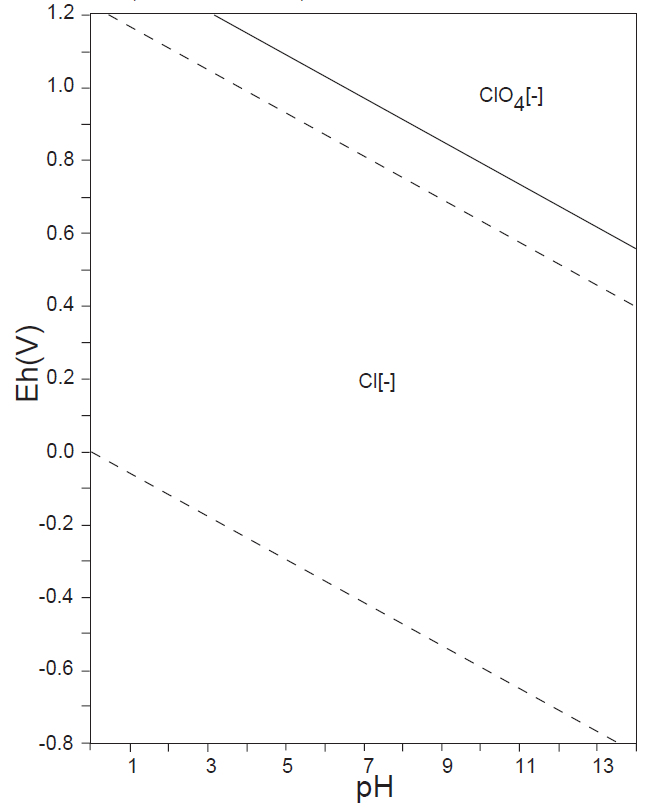
水溶液の酸化還元電位 E-pH における、本子ペ-ジで扱う主な非金属元素の酸素酸イオンの化学形態(E-pH 平衡図)を下記にしめす。下図内の点線は、水の分解(上側点線:酸素発生、下側点線:水素発生)が起こる E-pH である。
なお、この平衡図の計算・作図法については、別ページを参照されたい。
なお、この平衡図の計算・作図法については、別ページを参照されたい。
<13族> B
<14族> C、Si
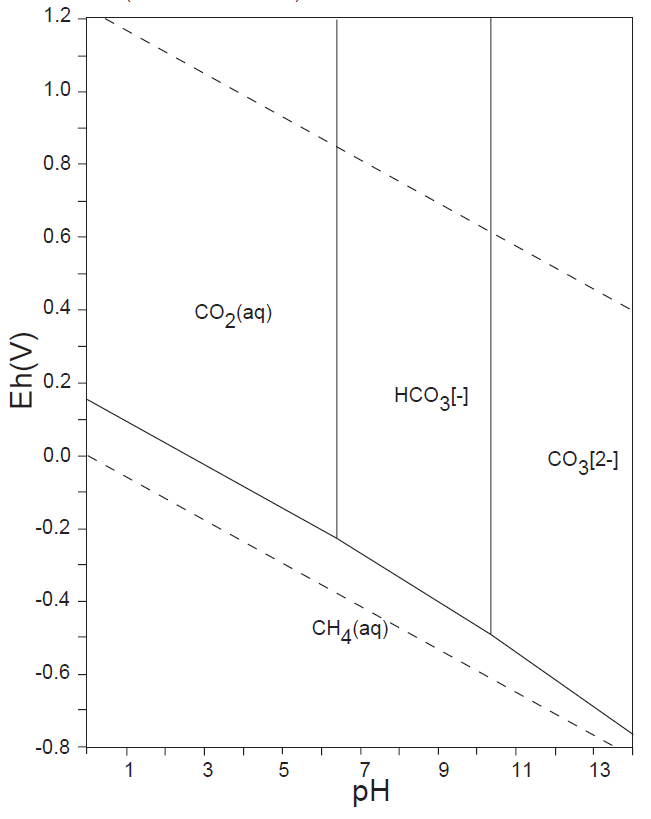
<15族> N、P、As
<16族> S、Se
<17族> Cl、Br
目次へ
水溶液中の非金属元素の特記事項
AsとSeの測定・処理の難しさ
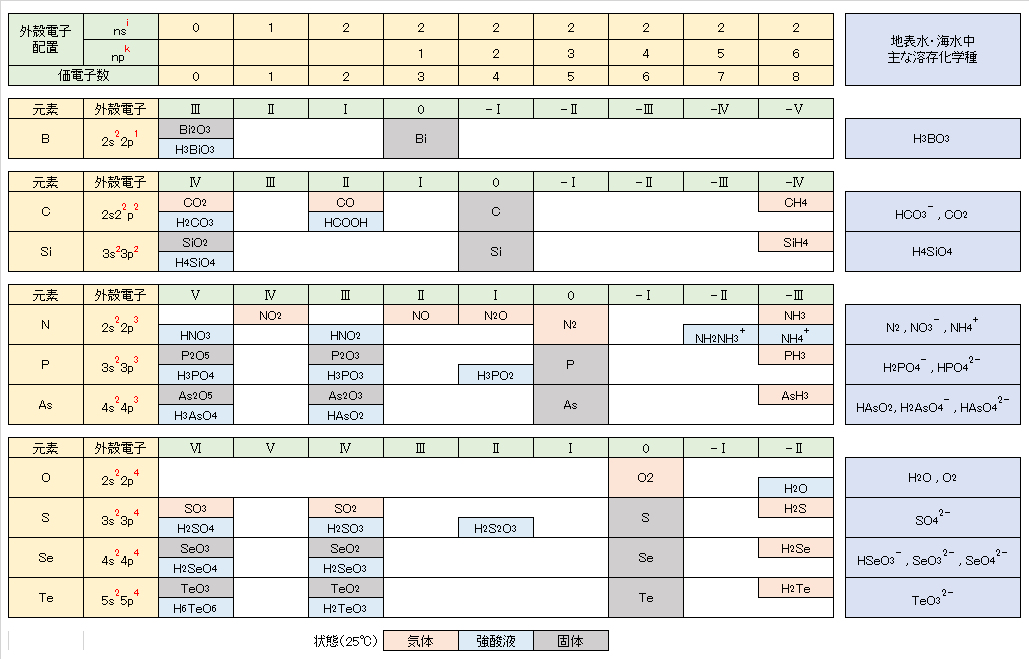
非金属元素の水溶液中(水の分解が生じない範囲内)の溶解種(化学形態)は、13族のB(Ⅲ)、14族のC(Ⅳ)、Si(Ⅳ)、15族の窒素N(0)・N(-Ⅲ)、P(Ⅴ)、16族のS(Ⅴ)、17族のCl(-Ⅰ)(他のハロゲン元素も同様)が安定に存在している。
ところが、15族のヒ素ではAs(Ⅲ)とAs(Ⅴ)、16族のセレンではSe(s)、Se(Ⅳ)およびSe(Ⅵ)が共存し、さらにそれらの各酸解離種が存在するので、E-pH の条件よって複雑な状況となっている。このことが、生体への影響や汚染水の測定操作・浄化プロセスが複雑となっている原因である。
As(Ⅴ)とSe(Ⅵ)の酸素酸イオンは、図1Dに示すように4配位四面体構造をとり、As・Se原子の電子受授反応を担う外殻電子軌道が、O2-の電子雲によってブロックされているので、極めて化学的に安定に存在している。このことから、ヒ素やセレンを含む水浄化・不溶化を難しくしている厄介な元素である。
水溶液中で、CO32-(Ⅳ)のCH4(-Ⅳ)への還元、あるいはN2(0)やNH4+(-Ⅲ)の酸化を化学的に行うことは困難で、SO42-(Ⅵ)をH2S(-Ⅱ)へ還元するには、厳しい化学的条件が必要である。しかし、生物はこれらの酸化還元反応を容易に行っている。藻類・植物はCO2(Ⅳ)を光合成反応によって還元しデンプンなどを生産する。嫌気性細菌は有機物をCH4へ還元する。硫黄還元菌は、呼吸反応によりSO42-をH2S(-Ⅱ)へ還元する。アンモニア酸化菌はNH4+をNO2–(Ⅲ)やNO3–(Ⅴ)に酸化し、また、根粒菌はN2(0)をNH4+へ還元して窒素固定を行う。
非金属元素の水溶液中(水の分解が生じない範囲内)の溶解種(化学形態)は、13族のB(Ⅲ)、14族のC(Ⅳ)、Si(Ⅳ)、15族の窒素N(0)・N(-Ⅲ)、P(Ⅴ)、16族のS(Ⅴ)、17族のCl(-Ⅰ)(他のハロゲン元素も同様)が安定に存在している。
ところが、15族のヒ素ではAs(Ⅲ)とAs(Ⅴ)、16族のセレンではSe(s)、Se(Ⅳ)およびSe(Ⅵ)が共存し、さらにそれらの各酸解離種が存在するので、E-pH の条件よって複雑な状況となっている。このことが、生体への影響や汚染水の測定操作・浄化プロセスが複雑となっている原因である。
As(Ⅴ)とSe(Ⅵ)の酸素酸イオンは、図1Dに示すように4配位四面体構造をとり、As・Se原子の電子受授反応を担う外殻電子軌道が、O2-の電子雲によってブロックされているので、極めて化学的に安定に存在している。このことから、ヒ素やセレンを含む水浄化・不溶化を難しくしている厄介な元素である。
水溶液中で、CO32-(Ⅳ)のCH4(-Ⅳ)への還元、あるいはN2(0)やNH4+(-Ⅲ)の酸化を化学的に行うことは困難で、SO42-(Ⅵ)をH2S(-Ⅱ)へ還元するには、厳しい化学的条件が必要である。しかし、生物はこれらの酸化還元反応を容易に行っている。藻類・植物はCO2(Ⅳ)を光合成反応によって還元しデンプンなどを生産する。嫌気性細菌は有機物をCH4へ還元する。硫黄還元菌は、呼吸反応によりSO42-をH2S(-Ⅱ)へ還元する。アンモニア酸化菌はNH4+をNO2–(Ⅲ)やNO3–(Ⅴ)に酸化し、また、根粒菌はN2(0)をNH4+へ還元して窒素固定を行う。
S(Ⅵ)とP(Ⅴ)の安定性
SO42-(Ⅵ)とPO43-(Ⅴ)は、水溶液中では、広いE-pH範囲で安定に存在する。
非金属イオンXの4酸素酸イオンXO4(8-z)-は表6に示すように正四面体構造として存在する。これは、Xz+とO2-のイオン半径比が0.22≦rx/ro≦0.41の範囲内にあり、正四面体が安定な構造となるからである。
酸素イオンの最外殻電子電子雲の半径を”1″とすると、この球状電子雲の4つが図1Dに示すように最接近したときの空隙の球半径は”0.225″となる。4つの酸素イオン同士がさらに接近すると、外殻電子雲が重なるので酸素イオン同士の反発が強くなり不安定となる。
表6に、各非金属イオンについて rx/ro を計算し、最適半径 0.225からの相対差 Δopt[%]は、P5+とS6+が最も少ない。以上のことから、SO42-(Ⅵ)とPO43-(Ⅴ)は広い E-pH 範囲において、極めて安定に存在することが理解できる。
SO42-(Ⅵ)とPO43-(Ⅴ)は、水溶液中では、広いE-pH範囲で安定に存在する。
非金属イオンXの4酸素酸イオンXO4(8-z)-は表6に示すように正四面体構造として存在する。これは、Xz+とO2-のイオン半径比が0.22≦rx/ro≦0.41の範囲内にあり、正四面体が安定な構造となるからである。
酸素イオンの最外殻電子電子雲の半径を”1″とすると、この球状電子雲の4つが図1Dに示すように最接近したときの空隙の球半径は”0.225″となる。4つの酸素イオン同士がさらに接近すると、外殻電子雲が重なるので酸素イオン同士の反発が強くなり不安定となる。
表6に、各非金属イオンについて rx/ro を計算し、最適半径 0.225からの相対差 Δopt[%]は、P5+とS6+が最も少ない。以上のことから、SO42-(Ⅵ)とPO43-(Ⅴ)は広い E-pH 範囲において、極めて安定に存在することが理解できる。
Cl(-Ⅰ) と Br(-Ⅰ)の安定性
ハロゲン元素 X(最外殻電子:ns2np5)は同じ周期(n)の元素の中で電陰性度が最も高く、E-pH 図に見られるように、水溶液中では電子e–を受け取ったX–(-Ⅰ)(希ガス構造電子構造:ns2np6)が安定に存在する。
HClO4(-Ⅶ)は、塩素の酸素酸の中で最も安定で、唯一、純粋な酸を単離することが可能であり、あらゆる酸の中で一番強いものである。うすいHClO4はほとんど還元されないが、70 %以上の過塩素酸と発煙硝酸の混合物は強い酸化作用を示す。
環境試料などの前処理において、有機物が存在する場合には、硝酸・過塩素酸の混酸で加熱分解する。この際に、乾固しないように、硝酸を常に共存させる。乾固すると爆発するので、常に硝酸を共存させる。
ハロゲン元素 X(最外殻電子:ns2np5)は同じ周期(n)の元素の中で電陰性度が最も高く、E-pH 図に見られるように、水溶液中では電子e–を受け取ったX–(-Ⅰ)(希ガス構造電子構造:ns2np6)が安定に存在する。
HClO4(-Ⅶ)は、塩素の酸素酸の中で最も安定で、唯一、純粋な酸を単離することが可能であり、あらゆる酸の中で一番強いものである。うすいHClO4はほとんど還元されないが、70 %以上の過塩素酸と発煙硝酸の混合物は強い酸化作用を示す。
環境試料などの前処理において、有機物が存在する場合には、硝酸・過塩素酸の混酸で加熱分解する。この際に、乾固しないように、硝酸を常に共存させる。乾固すると爆発するので、常に硝酸を共存させる。
非金属元素 Xz+ と酸素 O2- とのイオン半径比 rx/ro と酸素酸イオンの立体構造の関係
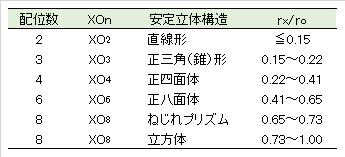
rx:非金属 Xz+ のイオン半径、ro:酸素 O2- のイオン半径
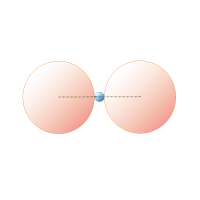
図1A 2 配位直線形
rx/ro≦ 0.15
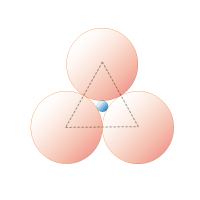
図1B 3 配位正三角形
0.15≦rx/ro≦ 0.22
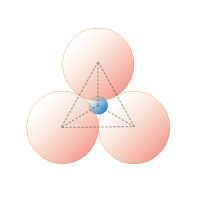
図1C 3 配位三角錐形
0.15≦rx/ro≦ 0.22
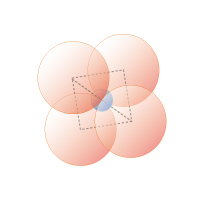
図1D 4 配位正四面体
0.22≦rx/ro≦ 0.41
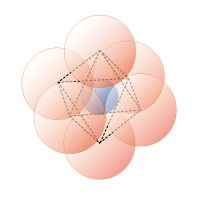
図1E 6 配位正八面体
0.41≦rx/ro≦ 0.65
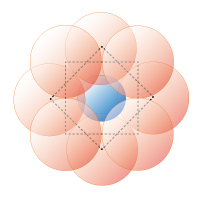
図1F 8 配位正方ねじれプリズム
0.65≦rx/ro≦ 0.73
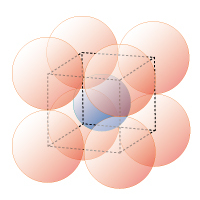
図1G 8 配位立方体
0.73≦rx/ro≦1.00
淡青球●:非金属原子、淡赤球●:酸素原子
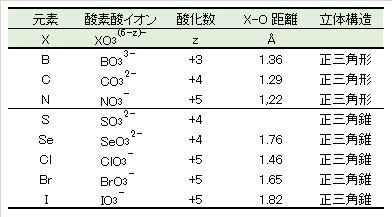
X-O 結合距離:単独酸素酸イオンの金属塩結晶の実測値を整理した値
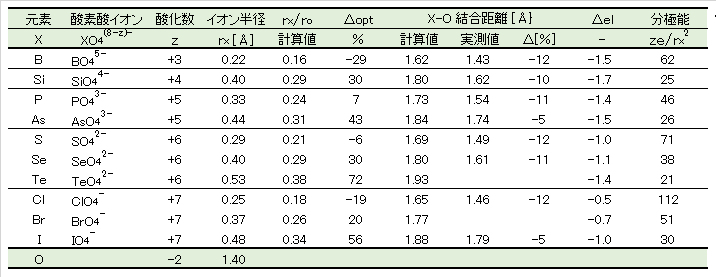
イオン半径:酸素酸塩結晶の実測値、 X-O 結合距離:計算値-イオン半径の合計値;実測値-結晶の実測値、 Δopt(正四面体の最適 rx/ro値 = 0.22 との相対差):(最適値-計算値)/(計算値)×100 [%] 、 Δ(相対差):(実測値-計算値)/(計算値)×100 [%]、 Δel:非金属元素と酸素との電気陰性度の差、 分極能:イオンの分極能 [任意単位]
目次へ
酸と塩基-静電気原子価
(1)酸と塩基
酸化物には、水に溶けると酸になるものと塩基なるものがあるが、ほとんど水と作用しないものがある。
Na2O → NaOH(溶解性)
MgO → Mg(OH)2(やや溶解性)
Al2O → Al(OH)3(難溶解性)
SiO2 → H4SiO4(難溶解性)
P2O3 → H3PO4(溶解性)
Cl2O7 → HClO4(溶解性)
OH として行動する(塩基)か、H を放す(酸)かを最も簡単に静電気領とイオンの大きさで解釈すると次のようになる。
NaOH → NaO– は起こらない。H+ が極めて小さく Na-O の結合よりも、O-H 結合のほうがはるかに強いから、NaOH → Na+ + OH– となり塩基性を呈する。
Mg(OH)2 → Mg2+ + 2OH– のほうが、Mg(OH)2 → MgO22- + 2H+ よりもずっと起こりやすい。しかし、Na+-O2- より Mg2+-O2- の引力が大きいので、Mg(OH)2 は解離しにくい。
HClO4 → ClO4 + H+は Cl7+ の電荷のために Cl-O の結合が強く、H+ は反発されやすくなる。Cl(OH)7 ができないのもこれによる。
(2)静電気原子価
Goldschmidtは、次のような実験法則を提出した。
第Ⅰ群:Cs、Rb、K、Na、Li、Ba、Sr、Ca
イオン化ポテンシャルの低い元素で、かなり高いpHでも陽イオンとして水溶液中に存在する。
第Ⅱ群:Fe、Mg、Be、La、Y、Sc、Al、Th、Ti、Si、As
アルカリ性でたやすく水酸化物として沈殿する。
第Ⅲ群:C、P、N、Se、S、Cl
電荷が大きく、陽イオンとしてイオン半径が小さいからイオンポテンシャルは極めて大きい元素である。これらは酸素酸イオンとして水溶液中に安定に存在する。
その後、Wickmanらは次に示す物理的解釈によって、上記の実験法則を説明した。
<静電気原子価>
静電気原子価 V は陽イオンの電荷 Z を配位数 C で割った量 V = Z/C として定義される。この V の大小により、次の規則が導かれる。
V<1/2 OH–のイオン結合(第Ⅰ群)
1/2≦V≦1 OH 結合(第Ⅱ群)
1<V 水素結合(第Ⅲ群)
① 第Ⅰ(OH–) 群に対する V<1/2 の場合には、四面体型の結合に区別なく、O と H の結合が強く、OH– イオンは単独に存在する。② V = 1/2 の場合、O の 1 個の -1/2 が陽イオンとの結合に用いられ、V = 1 の場合は 2 個の -1/2 が用いられる。残りの -1/2 が正電荷と結んでヒドロキシ(OH) 結合となる。
③ V>1では、O の -1/2 は 2 本以上用いられるために安定な酸素酸ができて、これらを結ぶ弱い水素結合が形成され、OH– イオンは存在しなくなる。
以上の 3 つのぐループが、上記の Goldschmidt の 3 群に相当する。具体的には、以下のように説明できる。
① 1価の陽イオンの水酸化物の結晶構造では、配位数はいずれの場合も 2 以上であるから、いずれも V<1/2 であり、OH– が存在し、水に溶けてアルカリ性を示す。2 価陽イオンの水酸化物は 6 配位のものが多い。V = 2/6 = 1/3であるので、いずれも OH– を放つ。Zn(OH)2 は 4 配位と 6 配位があり、境界線上にある。3 価陽イオンでは、La(OH)3 は 9 配位であるので、水に溶ける。
② Be(OH)2 の Be2+ は 4 配位であるので、V = 1/2 となり、事実、水に溶けない。Al(OH)3 は 6 配位であるので、第Ⅱ群に入り、水に溶けない。B(OH)3は 3 配位で V = 1 となり、第Ⅱ群に属するが、境界線上にあり水に僅かに溶けて BO32- イオンに解離する。
③ 4 価の陽イオンの中で C は陽イオンとは言い難いが、3 配位であるであるので第Ⅲ群に入る。Si は 4 配位であるので境界線上にある。6 価を例にとると、S は 4 配位であり V>1 となり、第Ⅲ群に属し安定な SO42- を形成する。Te の 6 配位のものは V = 1 で第Ⅱと第Ⅲの境界線上にあり、Te(OH)6 が存在する。
酸化物には、水に溶けると酸になるものと塩基なるものがあるが、ほとんど水と作用しないものがある。
Na2O → NaOH(溶解性)
MgO → Mg(OH)2(やや溶解性)
Al2O → Al(OH)3(難溶解性)
SiO2 → H4SiO4(難溶解性)
P2O3 → H3PO4(溶解性)
Cl2O7 → HClO4(溶解性)
OH として行動する(塩基)か、H を放す(酸)かを最も簡単に静電気領とイオンの大きさで解釈すると次のようになる。
NaOH → NaO– は起こらない。H+ が極めて小さく Na-O の結合よりも、O-H 結合のほうがはるかに強いから、NaOH → Na+ + OH– となり塩基性を呈する。
Mg(OH)2 → Mg2+ + 2OH– のほうが、Mg(OH)2 → MgO22- + 2H+ よりもずっと起こりやすい。しかし、Na+-O2- より Mg2+-O2- の引力が大きいので、Mg(OH)2 は解離しにくい。
HClO4 → ClO4 + H+は Cl7+ の電荷のために Cl-O の結合が強く、H+ は反発されやすくなる。Cl(OH)7 ができないのもこれによる。
(2)静電気原子価
Goldschmidtは、次のような実験法則を提出した。
第Ⅰ群:Cs、Rb、K、Na、Li、Ba、Sr、Ca
イオン化ポテンシャルの低い元素で、かなり高いpHでも陽イオンとして水溶液中に存在する。
第Ⅱ群:Fe、Mg、Be、La、Y、Sc、Al、Th、Ti、Si、As
アルカリ性でたやすく水酸化物として沈殿する。
第Ⅲ群:C、P、N、Se、S、Cl
電荷が大きく、陽イオンとしてイオン半径が小さいからイオンポテンシャルは極めて大きい元素である。これらは酸素酸イオンとして水溶液中に安定に存在する。
その後、Wickmanらは次に示す物理的解釈によって、上記の実験法則を説明した。
<静電気原子価>
静電気原子価 V は陽イオンの電荷 Z を配位数 C で割った量 V = Z/C として定義される。この V の大小により、次の規則が導かれる。
V<1/2 OH–のイオン結合(第Ⅰ群)
1/2≦V≦1 OH 結合(第Ⅱ群)
1<V 水素結合(第Ⅲ群)
① 第Ⅰ(OH–) 群に対する V<1/2 の場合には、四面体型の結合に区別なく、O と H の結合が強く、OH– イオンは単独に存在する。② V = 1/2 の場合、O の 1 個の -1/2 が陽イオンとの結合に用いられ、V = 1 の場合は 2 個の -1/2 が用いられる。残りの -1/2 が正電荷と結んでヒドロキシ(OH) 結合となる。
③ V>1では、O の -1/2 は 2 本以上用いられるために安定な酸素酸ができて、これらを結ぶ弱い水素結合が形成され、OH– イオンは存在しなくなる。
以上の 3 つのぐループが、上記の Goldschmidt の 3 群に相当する。具体的には、以下のように説明できる。
① 1価の陽イオンの水酸化物の結晶構造では、配位数はいずれの場合も 2 以上であるから、いずれも V<1/2 であり、OH– が存在し、水に溶けてアルカリ性を示す。2 価陽イオンの水酸化物は 6 配位のものが多い。V = 2/6 = 1/3であるので、いずれも OH– を放つ。Zn(OH)2 は 4 配位と 6 配位があり、境界線上にある。3 価陽イオンでは、La(OH)3 は 9 配位であるので、水に溶ける。
② Be(OH)2 の Be2+ は 4 配位であるので、V = 1/2 となり、事実、水に溶けない。Al(OH)3 は 6 配位であるので、第Ⅱ群に入り、水に溶けない。B(OH)3は 3 配位で V = 1 となり、第Ⅱ群に属するが、境界線上にあり水に僅かに溶けて BO32- イオンに解離する。
③ 4 価の陽イオンの中で C は陽イオンとは言い難いが、3 配位であるであるので第Ⅲ群に入る。Si は 4 配位であるので境界線上にある。6 価を例にとると、S は 4 配位であり V>1 となり、第Ⅲ群に属し安定な SO42- を形成する。Te の 6 配位のものは V = 1 で第Ⅱと第Ⅲの境界線上にあり、Te(OH)6 が存在する。
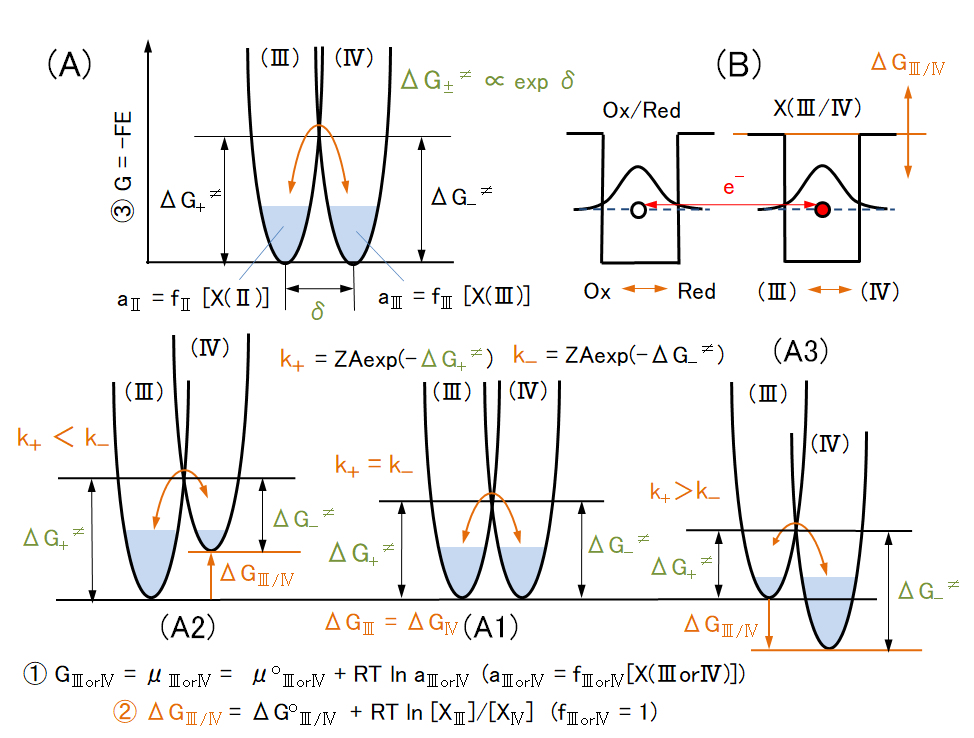
酸素酸イオンの安定性と酸化還元反応速度
非金属元素に限らず、対象元素の水浄化プロセスや測定操作などにおいて、化学形態を目的形態に変換した後、沈殿生成、吸着、還元気化などして、分離除去や分離測定を行う。
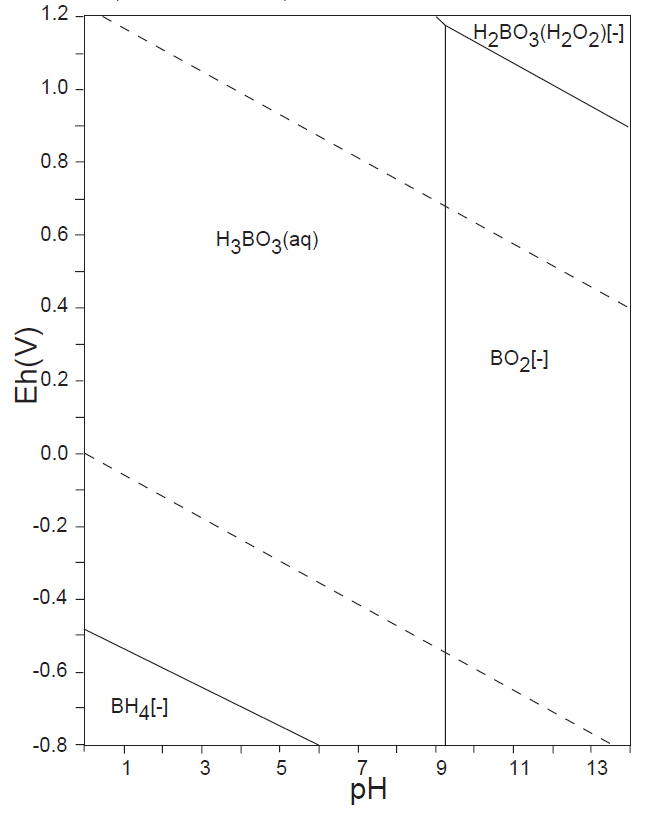
例えば、セレンは自然水中では、上図の E-pH 平衡図に示すように、Se(Ⅳ)とSe(Ⅵ)が共存する。Se(Ⅳ)については、Se(s)またはH2Se(g)への還元、Fe(Ⅲ)との共沈反応などが容易に起こる。しかし、Se(Ⅵ)は極めて安定で、反応性が低い。そこで、測定操作においては、塩酸(6mol/L)酸性にして、90~100℃、10分間の加熱をして、Se(Ⅵ)をSe(Ⅳ)に還元してから、上記の操作を行っている。
自然水では、数年~数千年あるいはそれ以上の時間をかけて、岩石の風化と元素の水への溶解、そして、自然水の E-pH に対応した化学形態となっている。ところが、測定操作や水浄化プロセスにおいては、少なくとも数分から数日の時間内に反応を完結しなければならない。このため、様々な工夫(技術開発)が行われている。
本節では、化学形態の変化、元素の酸化数の変化(酸化還元:電子移動 e– 反応)の速度について、説明する。なお、酸解離反応はプロトン H+ の移動反応であるので、瞬時に、平衡状態に達する。なお、固相中では、各元素の移動と各元素の再配置による安定な結晶構造(温度・圧力に応じた)への変化が進行する(異元素間の電子移動を伴うこともある)が、これについては、専門文献など参照されたい。
なお、以下の説明をよく理解するためには、熱力学、電気化学、量子力学、統計力学などの基礎知識が必要であるが、本サイト内の関連ページをリンクしてあるので、参照しながら説明する。これらの基礎知識は別にして、学生や初心者は、概略が理解できればよいので、必要に応じて上記の基礎知識はゆっくりと学習されればよいと考えている。
(以下、執筆中)
例えば、セレンは自然水中では、上図の E-pH 平衡図に示すように、Se(Ⅳ)とSe(Ⅵ)が共存する。Se(Ⅳ)については、Se(s)またはH2Se(g)への還元、Fe(Ⅲ)との共沈反応などが容易に起こる。しかし、Se(Ⅵ)は極めて安定で、反応性が低い。そこで、測定操作においては、塩酸(6mol/L)酸性にして、90~100℃、10分間の加熱をして、Se(Ⅵ)をSe(Ⅳ)に還元してから、上記の操作を行っている。
自然水では、数年~数千年あるいはそれ以上の時間をかけて、岩石の風化と元素の水への溶解、そして、自然水の E-pH に対応した化学形態となっている。ところが、測定操作や水浄化プロセスにおいては、少なくとも数分から数日の時間内に反応を完結しなければならない。このため、様々な工夫(技術開発)が行われている。
本節では、化学形態の変化、元素の酸化数の変化(酸化還元:電子移動 e– 反応)の速度について、説明する。なお、酸解離反応はプロトン H+ の移動反応であるので、瞬時に、平衡状態に達する。なお、固相中では、各元素の移動と各元素の再配置による安定な結晶構造(温度・圧力に応じた)への変化が進行する(異元素間の電子移動を伴うこともある)が、これについては、専門文献など参照されたい。
なお、以下の説明をよく理解するためには、熱力学、電気化学、量子力学、統計力学などの基礎知識が必要であるが、本サイト内の関連ページをリンクしてあるので、参照しながら説明する。これらの基礎知識は別にして、学生や初心者は、概略が理解できればよいので、必要に応じて上記の基礎知識はゆっくりと学習されればよいと考えている。
(以下、執筆中)
目次へ
掲載日:2019年01月04日
更新日:2019年09月23日
