村上定瞭(水浄化フォーラム)
1.殺菌の概念
2.殺菌の方法
3.殺菌の用途
Ⅱ.塩素殺菌
1.塩素の化学種と殺菌力
2.塩素の保管と失活
3.塩素の殺菌処理と副作用
4.塩素の製法
5.塩素濃度の測定
Ⅲ.オゾン殺菌
1.オゾンの性質
溶解度、分解速度など
オゾン高濃度溶解装置
(オゾン・マイクロバブル)
2.オゾンの生成
放電、紫外線、電解、原料など
3.オゾン濃度の測定
滴定、紫外線吸収、化学発光など
Ⅳ.紫外線殺菌
1.紫外線の殺菌機序
2.紫外線ランプ
3.死滅に必要な照射線量
4.紫外線の測定
Ⅴ.まとめ
参考文献等
<注意>本ページに記載している殺菌・消毒について、医・農薬(ワクチン・抗菌剤・抗真菌剤・殺虫剤・除草剤)とは、それらの作用・機序が全く異なるので、注意してください。医・農薬については、別ページにて解説の予定です。
水浄化分野で広く使われている塩素殺菌、紫外線殺菌およびオゾン殺菌について、それぞれの特徴を、表1に比較して示す。
塩素やオゾンは、細胞を変質させたり細胞膜を破って細菌を死滅させるに対して、紫外線は、水にUVを照射するだけで細菌の活動を停止させ、水質を変えることなく殺菌できる。塩素は、古くから上水・下水、プール・大衆浴場などの殺菌に活用されてきた。オゾンは殺菌のみでなく、酸化・脱色・脱臭にも広く用いられている。紫外線は水中で二酸化チタンを担持した光触媒に照射するとさらに強力な殺菌効果を発揮する。この方法は用水や循環水の殺菌処理に有効で、浴場水、プール水、メッキ水洗浄、冷却水、産業排水などの循環利用に普及しつつある。
ところで、殺菌(sterilization)とは、病原性や有害性を有する糸状菌・細菌・ウイルスなどの微生物を死滅させる操作のことである。しかし、殺菌の具体的な方法やその程度は定義されておらず、効果は保証されているものではない。殺菌方法は、電磁波(紫外線・X線など)、高温、圧力、薬理作用などを用いて細菌などの組織を破壊するか、生存が不可能な環境をつくり、病原体の除去(感染症の予防)や食品の鮮度保持などが主な目的である。対象とする細菌などによっては効果が期待できない方法もあり、人体や有用生物に対する有害、高熱や腐食による器具・装置の破損、食品風味の変質などを引き起こすこともあり、目的によって適切な殺菌方法を選択することが重要となる。
本解説では、滅菌・消毒を含めて、有害な細菌・カビ・ウイルスなどを死滅させることを、死滅の程度や量に関係なく、「殺菌」として扱うこととする。厳密な定義が必要な場合には、その都度、滅菌あるいは消毒と言及する。

I.殺菌全般
1.殺菌の概念
1.1 殺菌
1.2 消毒
1.3 滅菌
本解説で扱う殺菌、消毒、除菌等の用語の中で滅菌がもっとも厳重な方法であり、その用途は限定される。手洗いなどの際「ヒトの手指を消毒する」ことはできるが、滅菌することは技術的に不可能である。実際にヒトの手指を滅菌しようとすれば、手指の表皮細胞ごと全部殺すことになる。また、対象物をたとえ滅菌できても、外気に触れれば再び菌が繁殖することになる。例えば、カビを滅菌した状態にしたとしても、空気中に漂う胞子が着落すれば、再びカビが増殖する。
1.4 除菌
1.5 抗菌
1.6 防カビ
1.7 静菌
2.殺菌の方法
殺菌方法は、物理法と化学方法に大きく分けるとができる。
2.1 物理法
(1)高温加熱
なお、室温よりも低い温度は静菌的には働くが、0℃以下の低温でも菌そのものが死滅する殺菌効果は期待できない。
菌体(有機物)を完全に燃焼させる。最も確実な方法ではあるが、対象物も同時に喪失してしまうため、実用的とは言い難い。通常では伝染病の発生時に、病原微生物で汚染された衣服・家具などを処分する目的で用いられる。
② 火炎滅菌
ライター、ブンゼンバーナー、アルコールランプ等の火炎で対象物を直接加熱して滅菌する方法で、微生物培養時の柄付きバリ・ピンセットなどが対象となる。
③ 乾熱滅菌
滅菌用のオーブンで、180℃・30分あるいは160℃・2時間、加熱する。水分を含まない耐熱性の器具(金属製のメスやピンセット、ガラス製品)などに対して用いる。
④ 高温高圧滅菌(オートクレーブ)
オートクレーブと呼ばれる装置を用いて、飽和水蒸気中で121℃・2気圧・15分以上(通常20分)加熱する。湿熱で芽胞を死滅させるため、圧力を上げて100℃以上の温度にする。
乾熱滅菌の高温度には耐えられない樹脂製品器具やろ紙、本や書類、水分を含む培地などの滅菌に最も適している。逆に、濡れると都合の悪い器具には不向きである。また、対象物によっては、115℃・1.7気圧・30分以上の加熱でよい場合や、非常に病原性の高いもの(異常プリオン等)に対しては133℃・3気圧・1時間も加熱するケースもある。
⑤ 間欠滅菌
煮沸したあと一晩室温で放置して再び煮沸、さらにもう一晩放置後煮沸する方式である。細菌の芽胞が、増殖に適した環境になると通常の菌体に戻ることに対応する。オートクレーブでは熱分解する成分を含む培地などに用いる。実施するには単純計算で3日かかるため、最近はあまり用いられていない。
⑤ 煮沸
汚物などに接した水は、コレラ・腸チフス・赤痢などを引き起こす。また寄生虫の問題も引き起こす。それらを防ぐために、古代から現代まで、水を煮沸してから飲む、一旦沸かしてから飲む、ということが行われている。
アフリカでは現代でも多くの地域で安全な飲料水を確保することが難しく、水は飲む前に一旦沸かすことが重要である。
⑥ 熱湯消毒
台所用品、調理用品、ソフトコンタクトレンズなどに用いる。
コンタクトレンズ用の器具では、家庭で簡便に使えるようにコンセントと一体になった小型の器具などもある。
⑦ 低温殺菌(パスチャライゼーション)
100℃以下の温度(42、60、80℃など)で、やや長時間(30分~数時間)かけて加熱処理する。オートクレーブなどの滅菌処理で変質してしまう食品や牛乳などの消毒殺菌に用いられる。
⑧ 高温殺菌
蒸気を利用し、100℃以上の湿熱で加熱する。耐熱性の芽胞を死滅させることができる。
⑨ 超高温殺菌
120℃以上の湿熱で加熱する。缶詰の殺菌、LL(ロングライフ:長期保存可能)牛乳の殺菌などに用いられる。
(2)電磁波・電子線
滅菌・消毒に用いられる。照射量によっては十分な殺菌力が期待されるが物質への透過性が低いため、光の浸透しない(影になる)部分には効果がない。また、波長によって異なるが、水は紫外線を吸収してその強度が減衰し、また、懸濁物質が存在する場合には、その濃度により減衰率が急激に増加する。水面上からの紫外線照射や水中浸漬型紫外線ランプの用いる場合には、その条件と効果を検証した上で、適用する。
実験台やクリーンベンチの机表面に照射したり、スリッパや器具の保管庫、クリーンルームの消毒殺菌灯に利用される。一部の飲料の製造工程では流路に照射して殺菌することもある。300-200nmの紫外線を利用し、254nmが最も効果的である。
不完全ながら、太陽光に含まれる紫外線(図 Ⅰ-1)を用いて殺菌する方法もあり、SODIS法(solar water disinfection)と呼ばれる。災害時など飲料水の確保が困難な場合にペットボトルなどに入れた水を太陽光にさらすことで殺菌する。WHOやUNICEF、赤十字などが推奨している。煮沸と異なり必要なエネルギー、燃料が無くて済む。
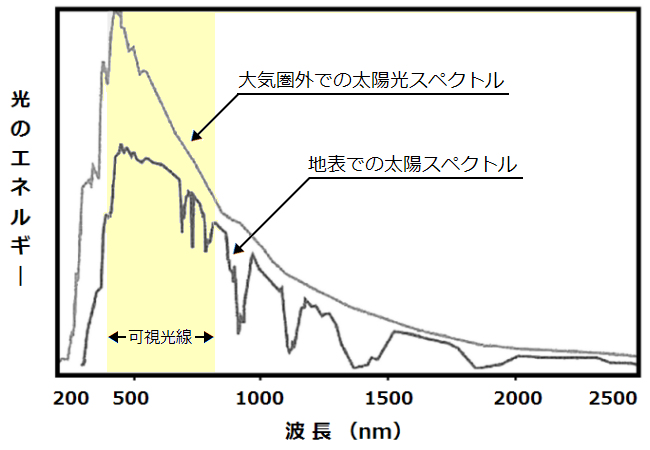
図Ⅰ-1 太陽光のスペクトル [光と色と, URL]
X線・γ線の波長とエネルギーは、別ページに記載してあるが、10nm以下の短波長の高エネルギー電磁波で、生物にとって極めて危険なものである。滅菌にも用いられ、殺菌力が強くまた物質への透過性も高い。ただし、放射性物質を取り扱う必要があるため、利用できる施設は限定される。熱に弱いプラスチック製品(注射筒・輸液用チューブなど)を大量に製造する工場などで利用される。
③ 電子線殺菌
滅菌に用いられ、カテーテルやメスなど医療器具の殺菌に利用される。物質への透過力が弱いため、小型の器物にしか応用できないが、ガンマ線より扱いやすいことから、ディスポーザブル(使い捨て)となる製品に、ガンマ線と使い分けられ、広く利用されている。
④ パルス光殺菌
GP(grading and packing)センターでの鶏卵の殺菌などに用いられる。1秒間に数~10回の間隔で高エネルギー光をフラッシュさせ、細菌やカビを瞬間的に殺菌する。欠点として、光が到達しない部分の殺菌効果は無く、食品内部もしくは、表面でも凹凸がある食品の陰になった部分の殺菌は不可能である。
なお、光子(電磁波)1個のエネルギーは波長が短いほどエネルギーが大きいが、ここでいう高エネルギー光とは照射する光子数(光量子密度:単位時間・単位面積に放射あるいは照射される光子数)が極めて大きいことを示す。
パルス光殺菌装置は、電源と光源から構成される。電源は、高電圧で、高いピークを持つエネルギーを光源ランプに供給するもので、商用の交流電源を高圧の直流に交換し,大容量 のコンデンサに充電するシステムである。光源は、コンデンサに蓄積された大容量の電気エネルギーは、スイッチ回路を通すことで非常に短時間の間にランプ(キセノンフラッシュランプなど)に送り込まれる。この高電流がランプ内部を通過することで,ランプ内部のガスが励起され、強力なパルス光が発生する。この時の電圧は数kV程度であり、ランプを保持するランプハウスには高絶縁の対応が要求される。また、使用する光を有効利用するために、反射鏡やランプの冷却システムも重要な要素として光源部分に含まれる。
キセノンフラッシュランプの光波長帯は、殺菌に有効な200~300nmの紫外線領域を豊富に含んでおり、可視光線や赤外線部分にも波長分布が広がっている。閃光パルスの発光時間は数百µs~数msと非常に短いが、この光強度のピーク値は太陽光線の数万倍にもなっており、非常に高い出力となっている。
(3)滅菌濾過
(4)高圧・真空など
滅菌または消毒に用いられ、超高圧処理による殺菌する。
② 真空パック
滅菌でも消毒でもない静菌に用いられ、好気性細菌の増殖を止めとともに死滅させる効果もあるが、嫌気性細菌には無効である。
(5)電解殺菌
(6)マイクロ・ナノバブル
(7)超音波
図Ⅰ-2 活性汚泥中の微生物群に対する超音波の照射時間と死滅効果の事例
2.2 化学法
(1)オゾン
空気中オゾンは人体に人体や動植物に対して有害な物質である。家庭用オゾン発生器については国民生活センターが2009年に、「家庭用オゾン発生器はオゾンが人体にとって危険なレベルの高濃度になる恐れがあるとして、一般の消費者は購入等を控えた方がよい」という商品テスト結果を発表している。
オゾンについては、Ⅲ部で詳述する。
(2)電解水
(3)光触媒
正孔は強い酸化力をもち、水中にあるOH-(水酸化物イオン)などから電子を奪う。このとき、電子を奪われたOH-は非常に不安定な状態のOHラジカルになる。
OHラジカルは強力な酸化力を持つために近くの有機物から電子を奪い、安定なOH-に戻る。細菌の細胞壁・膜あるいはウイルスを構成する生体有機物は電子を奪われて結合を分断されことにより細菌・ウイルスなどが死滅する。
(4)滅菌ガス
また汚染した建物の滅菌にホルムアルデヒドガス(ホルマリン燻蒸)が用いられる。ただし使用するこれらのガスは人体に有害なものが多いので、対象物へのガスの残留や、処理終了後の排気には注意を要する。
(5)殺菌剤・殺菌消毒薬
消毒剤として用いられる。細菌の細胞膜やウイルスのエンベロープの破壊、タンパク質の凝固作用による殺菌である。エタノールは細菌には70%程度、ウイルスでは100%の濃度が最も効果が高い。イソプロピルアルコールは30~50%で用いる。
② フェノール、クレゾール
消毒に用いられ、タンパク質の凝固作用によって細菌などを死滅させる。
③ 逆性石鹸(塩化ベンザルコニウム、塩化ベンゼトニウム)、両性石鹸(塩酸アルキルジアミン エチルグリシン、グルコン酸クロルヘキシジン)
消毒に用いられる。表面張力低下による細胞膜の障害、タンパク質を凝固・変性をさせ、細菌などを死滅させる。通常の石鹸と反応すると殺菌力が失われるので注意する。
④ アルキル化剤
生体高分子にあるアミノ基をアルキル化する。消毒・滅菌にはホルムアルデヒド、消毒にはグルタルアルデヒド(グルタラール)が用いられる。
⑤ ハロゲン化合物
塩素化合物:次亜塩素酸ナトリウム、二酸化塩素、さらし粉など。いわゆる酸性を示す電解水(強酸性水、微酸性電解水)の殺菌効果も、水道水中の次亜塩素酸イオンと同じである。塩素殺菌については、Ⅱ部で詳述する。
ヨウ素化合物:ヨードチンキはヨウ素をエタノールに溶かしたもので、添加物としてヨウ化カリウムが含まれている。ヨウ化カリウムは、ヨウ素を三ヨウ化物としてイオン化させ(KI + I2 → K+ + I3-)、水溶性を増すのが目的である。
ポビドンヨード、イソジン液:界面活性剤であるポリビニルピロリドンとヨウ素の結合体である。うがい薬として最もよく知られている。
上記のハロゲン化合物は、消毒用として用いられる。
⑥ 過酸化物
オゾンや過酸化水素などがある。消毒剤として用いられる過酸化水素は、3%水溶液はオキシドールとして殺菌消毒用に市販されている。
⑦ アクリノール
アクリニジウムイオンによる呼吸酵素の阻害で、消毒に用いられる。
⑧ 生石灰・消石灰
消毒剤として安価で大量に入手し得るので、水害時の土壌・建物等の消毒、家畜伝染病発生時の建物・車両・器具等の消毒に用いられる。強アルカリであれば十分であるので炭酸ナトリウム等も用いられる。
⑪ ホウ酸
消毒剤として用いられタンパク質の沈殿作用がある。眼科のみに使用されている。
⑫ 重金属化合物
消毒・防菌剤として、金属イオンを添加した各種製品の他、調理用品や配管などに銅製の製品を用いることがある。
⑬ 水銀化合物
塩化第二水銀(昇汞)は現在では用いられてはいないが、過去において消毒・殺菌剤として多用された。マーキュロクロム液は通称「赤チン」と呼ばれ、水銀イオンが細菌の酵素阻害を起こして死滅させる。
⑭ 銀化合物
銀イオンと、多くの細菌の持つ硫黄との強力な親和性を利用して殺菌する。銀イオンはごく微量でも効果を発揮するが、具体的な殺菌力に関しては諸説ある。また貴金属のため費用がやや高価であるということもあり、一般に普及しているとは言えない。
⑭ 銅化合物
銀化合物と同様の作用により殺菌する。銅は安価であるが、多量に摂取した場合や、微量でも長期間にわたり摂取した場合は人体に蓄積し悪影響があるため、広く用いられてはいない。家庭用としては排水口のゴミ受けや生ゴミ受けなどが製品化されている。
⑮ その他
トリクロサンは消毒剤として用いられ、生体分子中の塩素原子による酸化作用や細菌の脂質代謝阻害を起こして死滅させる。この他、カテキンなどのポリフェノールや、ペパーミントやユーカリなどの植物精油、「わさび」や「しょうが」などの香辛料にも殺菌効果が認められるものがある。
3.殺菌の主な用途
3.1 医療、理容など
医療器具・理容器具など、人体組織に直接触れるものの滅菌や消毒に利用される。
3.2 食品
① 飲料水・牛乳
超高温殺菌(130℃、2秒間)、高温殺菌(72~85℃、15秒間以上)、低温殺菌(62~66℃、30分間以上)の3種類がある。
② 鶏卵
卵殻にサルモネラ菌が付着することが多いため、加工食品用の卵の殺菌処理を行う。
③ 保存食
缶詰、瓶詰、レトルト食品などでは、容器に密封して加熱・加圧して殺菌する。
3.3 飲料水以外の水
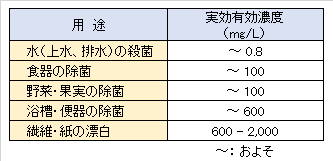
次亜塩素酸ナトリウムなどを添加することにより殺菌を行う。塩素は飲料水、プール水、浴場水、下水などの除菌をはじめ、果実・野菜の除菌、繊維や紙の漂白に使われている。一般に使用されてい12%次亜塩素酸ナトリウム溶液はNaClが11%、残留アルカリが0.5~1.2%程度含まれている。
① プール
衛生上の観点から次亜塩素酸ナトリウムを0.4〜1.0ppm保持しなくてはならない。使用の前後に、消毒槽などと呼ばれる高濃度の殺菌剤を添加した水槽に浸かることがあるが、こちらは皮膚に障害を与えるとして学校などでは使用を取りやめるところもある。
② 公衆浴場、温泉
次亜塩素酸は、その臭いやレジオネラ菌などに対して殺菌効果が不十分なため、その繁殖が問題となった。
3.4 靴
殺菌よりも消臭、乾燥を目的とする意味合いが強い。
3.5 台所用品・調理用品
熱湯による殺菌や、漂白剤、殺菌剤(次亜塩素酸ナトリウムが主成分)を用いることが多い。業務用では紫外線殺菌灯やオゾンも用いられる。
3.6 建築物・住宅
主に次亜塩素酸ナトリウムやエタノールによるカビの除去を行う。
3.7 農業
農業における殺菌剤とは、植物に対する病原性を有する微生物を死滅、あるは増殖を抑止するための薬剤をいう。野菜・果樹・観賞植物などの種・球根や育成株などを対象とする。
3.8 水洗便所用
サニタイザーは、水洗便器の洗浄管に薬剤供給装置を水洗便器の洗浄管に連結して、界面活性剤を主成分とする小便スラッジからなる尿石防止の洗浄・殺菌消毒薬として水洗便器に供給する。
Ⅱ.塩素殺菌
塩素は飲料水、プール水、浴場水、下水・浄化槽などの除菌をはじめ、果実・野菜の除菌、繊維や紙の漂白に使われている(表Ⅱ-1)。一般家庭でも広く使われている殺菌剤は、次亜塩素酸ナトリウムで、水酸化ナトリウムに塩素を反応させてつくる。
式(Ⅱ-1)より、次亜塩素酸ナトリウム溶液にはNaOClと同じモル量の塩化ナトリウムNaClが含まれている。
一般に使用されている12%次亜塩素酸ナトリウム溶液は、NaClが11%、残留アルカリが0.5~1.2%程度含まれている。この原液を適宜希釈して使用される。
<参考>安全な次亜塩素酸ソーダの取扱い
目次へ
1.水中塩素の化学種と殺菌力
ka = [H+][Cl–][HOCl]/[Cl2] pka = 3.3
HOCl ⇄ H+ + OCl– (Ⅱ-3)
ka = [H+][OCl-]/[HOCl] pka = 7.5
次亜塩素酸ナトリウムで実際に殺菌効果があるのは次亜塩素酸HOClである。次亜塩素酸イオンOCl–はHOClに比べて酸化力が弱く殺菌効果は約1/80であるとされている。したがって、塩素殺菌では、液中のHOClの存在比が殺菌力を左右する。特に、pHに大きく依存する。pH 8.5以上ではHOClが減少するので殺菌効果が低く、pH 4.5~6.0ではHOClの割合が95%以上となるので殺菌効果が高くなる。水道水基準のpH 8.6以下(pH 5.8~8.6)という数値はこれを根拠としている。
アルカリ性のNaOCl溶液に酸を加えていくとpHが低くなり、HOClの割合が増加する。したがって、アルカリ側よりpHが低い方が殺菌効果が上昇する。しかし、あまり下げすぎると有毒性の塩素ガスCl2が発生するので危険である。NaOCl水溶液のpH調整は、pHメーターを用いて低濃度の酸(塩酸、クエン酸など)をゆっくり加えてpH 6程度とするのがポイントとなる。
残留塩素とは、水中に残存する殺菌力を持った遊離塩素および結合塩素(クロラミン)をいう。結合塩素は遊離塩素に比べて1桁ほど殺菌効果が減少するが、反面、残留効果が長時間維持される。
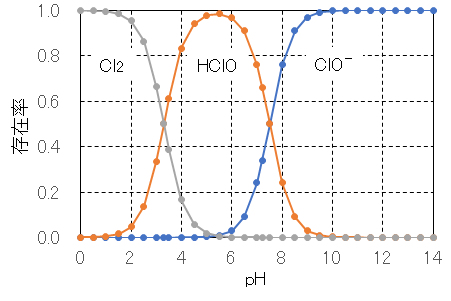
図 Ⅱ-1 密封・閉鎖系での塩素の化学種の存在率とpHの関係
pK1 = 7.3、pK2 = 3.3 [曽根, 1974]、計算法
目次へ
2.塩素の保管と失活
(1)次亜塩素酸ナトリウム
次亜塩素酸溶液中の遊離塩素は熱や光によって分解が促進されるので、次亜塩素酸溶液は冷暗所に保管するなどの配慮が必要である。実際に次亜塩素酸ナトリウムを使用するときには、使用量、保管期間(製造年月日)、希釈の程度、使用pHなどを考慮することが重要である。
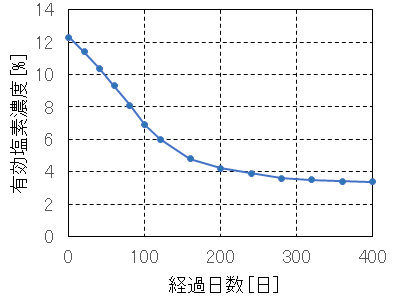
図 Ⅱ-2 次亜塩素酸ナトリウムの有効塩素濃度の経日変化例(暗所保管、温度:19~29℃)
(2)塩素化イソシアヌル酸ナトリウム
塩素化イソシアヌル酸ナトリウムの錠剤は、住宅などに設置される浄化槽の放流水の消毒に用いられ、錠剤筒に充填し、錠剤と処理水を接触させて消毒している。
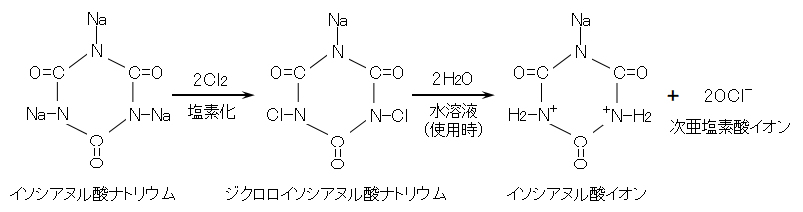
図 Ⅱ-3 ジクロロイソシアヌル酸ナトリウム
目次へ
3.塩素の殺菌処理と副作用
(1)次亜塩素酸の濃度と菌の死滅時間
飲料水の基準では残留塩素が1mg/L(1ppm)以下と定められており、実際には0.1~0.4mg/Lで管理されている。これにより、飲料水の細菌学的な衛生は保たれており、安心して水道水を飲むことができる。
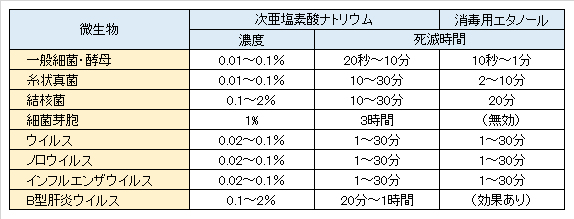
(2)副作用
4.塩素の製法
(1)電解法(水酸化ナトリウム・塩素)
電解槽の陽極室に塩水、陰極室に純水(希薄水酸化ナトリウム水)を注入して、直流の電気を流して電気分解すると、陽極側より塩素ガスが発生し、陰極側よりか性ソーダ水溶液と水素ガスが生成するが、これを気液セパレーターで分離すると、約30%濃度の水酸化ナトリウムとなる。
発生した塩素ガスは、洗浄・冷却して塩分を除去したのち、脱水を経て、ボンベに詰めた塩素ガスや液体塩素、あるいは塩素化合物などとして出荷される。
水酸化ナトリウム液は、蒸発缶でさらに濃縮して、約50%濃度の液状のものとして出荷される。
水素ガスは、塩素ガスと同様、洗浄・冷却を経て、圧縮水素としてボンベに詰めて出荷される。
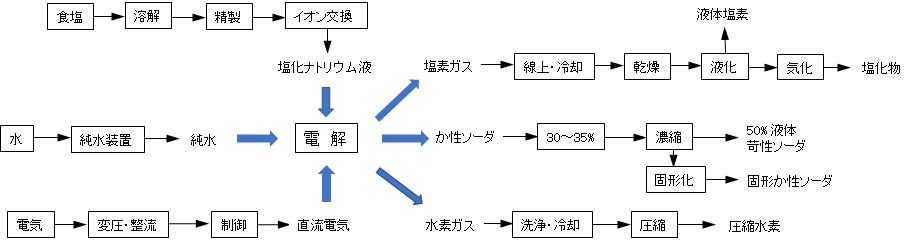
図 Ⅱ-4 電解法による塩素・水素・水酸化ナトリウムの製造工程
(2)電解ソーダ工業の製造原理
陽極として、チタンあるいはニッケルなどのベース金属板に、触媒として白金族金属酸化物などをコーティングしたものが使われる。触媒は、塩素発生電位を低下させて省エネルギー化とともに、長寿命なものが要求される。陰極にはステンレス板が用いられる。
陽極側と陰極側を、特殊な樹脂であるイオン交換膜で仕切ったものがイオン交換膜法である。このイオン交換膜は、陰イオンを遮断し、陽イオンのみを通過させる性質を持っている。
図 Ⅱ-5に示す通り、イオン交換膜法食塩電解では、陽極のある陽極室には食塩水を、陰極のある陰極室には水を注入して、これに電気を流すことにより電気分解して塩素、水酸化ナトリウム、水素を製造する。
陽極室は、食塩水の溶液で満たされているので、ナトリウムイオンNa+と塩化物イオンCl–が存在する。電極間に電気を通すとイオン移動が起きるが、ナトリウムイオンNa+はプラスイオンであるので、陽極室よりイオン交換膜を通過して陰極室に入る。一方の塩化物イオンCl–はマイナスイオンであるので、膜で透過を阻止され陽極室に留まって陽極でマイナス電荷の電子e–を放出して塩素ガス(Cl2)に変換される。
一方、陰極室では注入された水が一部水素イオンH+と水酸化物イオンOH–に電離しており、水素イオンが陰極で電子e–を得て水素ガス(H2)となる。残された水酸化物イオンOH–は、イオン交換膜で遮断されて陰極室に留まり、電気的中性を保つため、陽極室からナトリウムイオンNa+が移動して、濃厚な水酸化ナトリウムNaOH水溶液となる。
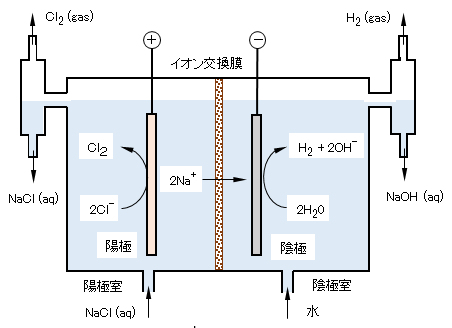
図 Ⅱ-5 イオン交換膜電解法による塩素・水素・塩化ナトリウムの製造原理
(3)海水電解法
放流水中の残留塩素の影響を考慮して、放流水中塩素が0.01mg/L(上水中の1/10)以下で管理されている。この塩素濃度と冷却設備内での滞留時間が短いことから、海水中の生物を十分に死滅させることは期待できないが、付着生物は長期間に渡って塩素に晒されることで、付着生物膜の増殖が抑制されるものと考えられている [中村, 1996]。
また、外来生物の移入・繁殖を防止する目的で、外航船にバラスト水の処理設備が義務付けられている。バラスト水の水生生物の駆除には、様々方法が認定されているが、海水電解法もその中の1つである。
海水電解の原理は、電解槽(図Ⅱ-5に示す隔膜はない)に取り付けた陽極と陰極に直流電流を印加し、海水を導入して電気分解する。上記の式(Ⅱ-1)に示すように、陽極で発生したCl2は、陰極で発生したNaOHと反応して、次亜塩素酸ナトリウムNaOClが生成する。海水のpH 8.1~8.2で緩衝力があるので、上記図Ⅱ-1から、その解離種はおよそHOCl 20%、OCl– 80%であろう。
海水電解装置は、ストレーナー、海水導入ポンプ、電解槽、直流電源装置、水素脱気塔・槽(電解液の貯留を兼ねるタンク)から構成される。システムとして、冷却水の一部を電解、その全量を戻す方式と、貯留タンクと電解槽を連結して海水を循環・電気分解し、高濃度の次亜塩素酸ナトリウム液を冷却水へ注入する方式がある。
海水中には、Ca2+、Mg2+などの濃度が高く、電極にスケールが付着する。電極板へのクロスフローの発生(回転電極や電解液循環)や定期的な酸洗浄等が必要となる。
5.塩素濃度の測定
一般に電流式残留塩素計は、水質(pH、共存物質など)による測定値への影響が大きく、定期的な校正作業が必要となる。一般的には、DPD法の測定値で残留塩素計を校正するが、この2つの測定方法では残留塩素の測定対象が異なるため、測定値も異なることがある。つまり、DPD法では残留塩素の数値であるが、残留塩素計ではゼロをしめすこともあるので注意が必要である。
(1)比色法(DPD法)
(2)吸光光度法(DPD法)
吸光光度分析法の原理・装置・操作については、本サイトの別ページ「機器分析の基礎」で、詳細に解説しているので、参考とされたい。
(3)ヨウ素滴定法
具体的な滴定方法および滴定実験については、初心者は当該項目をクリックしてダウンロードして参考にされたい。
(4)電流法(ポーラログラフ法)
DPD法で校正する場合には、DPD法の測定機器の説明書に沿って遊離残留塩素だけを正確に測定し、その値をもとに校正する。pH値以外にも検水量、金属イオン、その他の測定条件を各機器の仕様に正しく合わせる必要がある。
残留塩素濃度は、時間帯、曜日、季節、降水などによる流量変動およびpH、高度、鉄・マンガン、塩素消費量(有機物、アンモニア・硝酸性窒素)などの水質変動により変化する。目的水の残留塩素濃度を一定値に維持するためには、塩素殺菌剤の添加量を制御しなければならない。電流法は残留塩素濃度の自動計測制御に適しているが、安定した測定・制御のため測定条件を厳守するとともに、必要に応じて校正しないと測定データは信頼性に欠けるものとなる。
Ⅲ.オゾン殺菌
(1)オゾンの酸化力
①殺菌、消毒、殺藻、②着色成分の脱色、③脱臭、臭味除去、④有機物、還元性物質の酸化、⑤有害物、有毒物の無害化、⑥難分解性物質の生物易分解性化
(2)オゾンの殺菌力
表Ⅲ-0 に各微生物に対する n = 1 とした場合の Cm・t を示す。オゾンは、 0.002~2 [mg/L・min] であり、塩素系に比べて 10~1.000 倍も大きく、より強力な殺菌力を有している。

目次へ
1.オゾンの性質
(1)一般的性質
オゾンは、化学物質の中でフッ素 F2に次いで酸化力が強く、生物難分解性の有機化合物の二重・三重結合や脱水縮合部分を容易に切断して、生物分解可能な有機酸へ分解する。
➀酸素中での無声放電、②気相酸素への紫外線照射、③希硫酸水溶液を酸化鉛(Ⅲ)と白金の電極を用いる電気分解、などにより、オゾンが生成する。
上層大気中では、オゾンが高濃度で生成(オゾン層)している。このオゾン層は、太陽光中の紫外線(生物にとって有害で、人の皮膚がんなどのリスクを高める)を吸収して地上への照射量を減少させている(上記の図 Ⅰ-1)。近年、ハロカーボン(フロンガスなど)によるオゾンの分解が問題となっている。
(2)水へのオゾン溶解度
H:ヘンリー定数、p:気体オゾンの分圧、x:水溶解オゾンのモル分率
α = 1/Hは分配率と呼ばれ、気相での分圧pのオゾンと接触しているときの水中オゾンの平衡モル分率はpαとなる。オゾンのヘンリー定数についての実験式(適用範囲:温度3.5~60℃、pH 0.65~10.2)[Roth, 1981]を変換して、気体と水の両相の濃度の実用単位mg/L(ppm) を用いた分配式αは、次式で与えられる。
[OH–]:水酸化物イオン濃度[mol/L]、T:絶対温度[oK]
式(Ⅲ-2)を用いて計算したpH 7.0における分配係数と温度の関係を図 Ⅲ-1に示す。また、各温度における平衡状態におけるオゾンの気体濃度と水中濃度(pH7.0)の値をに表 Ⅲ-1示す。
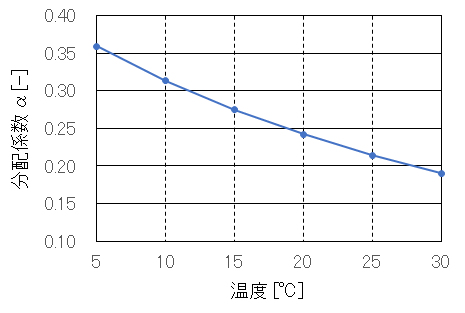
図 Ⅲ-1 各温度におけるオゾンの気体/水の分配係数の計算例(pH 7.0)
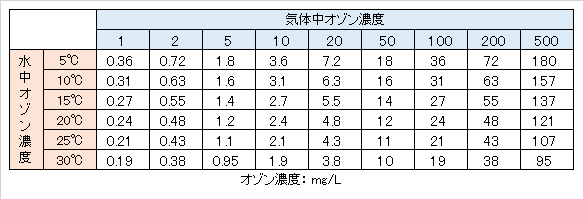
オゾン高濃度溶解装置(オゾン・マイクロバブル)
当装置は長軸方向の両壁の中心に小さな孔がある空洞楕円体(以下、楕円室と略称)で、オゾナイザーからのオゾンと循環水を長軸に対して垂直方向に導入し、その垂直円断面に沿って旋回するサイクロン流を生じさせる。この断面の状況を見ると、円壁から中心に向けて負の圧力勾配が生じ、中心近傍は相当な減圧状態となり、長軸に沿って微細な気泡の線状層(写真Ⅲ-1に動画がリンクされているが、開始直後、楕円室内に観測されるが、直ぐに外部に放散される微細気泡に覆われて見えなくなる)が発生する。
一方、楕円室の両孔の中心部から外部水が室内の減圧部(長軸近傍領域)へ侵入するとともに、孔円周に近い領域から導入水とともにオゾンの微細気泡が外部へ放散される。このような現象により、長軸に沿った減圧層で発生した微細な気相オゾン泡が、①サイクロン流と外部から侵入した水流との剪断力、および、②両壁孔において室内への侵入水と室外への放散水との剪断力によって、気泡がさらに微細化されることによるマイクロバブル発生と考えられる。このような仕組みにより、高濃度のオゾン水を得ることができる。

写真Ⅲ-1 マイクロバブル発生装置
画像をクリックすると、マイクロバブル発生状況の動画にリンク
(3)オゾン分解速度
溶存オゾンの自己分解速度は、実験式(実験範囲:液温 3~35℃、pH 2~9)[諸岡, 1978]によると、次式で示される。
oka = 4.6×1013 exp(-17.9×103/RT)
okb = 1.8×1018 exp(-20.6×103/RT)
C:オゾン濃度[mol/L]、[OH–]:OH–イオン濃度[mol/L]、
R:気体定数[ca/mol/oK]、T:絶対温度、t:時間[sec]
式(Ⅲ-3)を用いて、初期濃度 10mg/L、液温 25℃の溶存オゾンの分解速度を計算した結果を表 Ⅲ-2に示す。
式(Ⅲ-3)を無次元化すると、次式となる。
ka = oka[OH–]0.28、kb = okb[OH–]1.0
上式を積分すると、次式が得られる。
α = kb/ka/√Co
式(Ⅲ-5)を変形し、時間tを表すと次式となる。
式(Ⅲ-6)に初期濃度CoおよびCo/C = 2を代入すると溶存オゾンの半減期τが得られるとともに、所定濃度に減衰する時間を推定することができる。
初期濃度:10mg/L、液温:25℃、τ:半減期
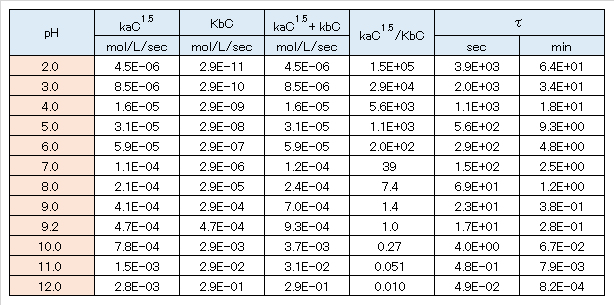
分解速度は、酸性(pH 6以下)においてはオゾン濃度の1.5次、OH–の0.28次で、アルカリ性(pH 11以上)ではオゾン濃度の1次、OH–の1次の反応である。中性から弱アルカリ性では、2つの異なる分解反応が進行し、pH 9.2において両分解反応の速度が等しい。
アルカリ性では、pH上昇に伴い急激に分解反応が進行する(図 Ⅲ-2)。酸性では、オゾン濃度が高いほど、分解反応が速く進行する。半減期は中性では数分、酸性では数十分、弱アルカリ性では数秒、アルカリ性では一瞬にして分解することが推定される。
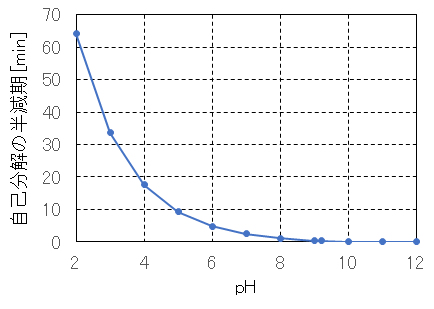
図 Ⅲ-2 pHと溶存オゾンの自己分解による半減期の計算例
初期濃度:10mg/L、液温:25℃
目次へ
2.オゾンの生成
2.1 オゾン発生
またオゾンは不安定な分子であるため、放置しておくと以下の化学式(Ⅲ-8)示すように酸素に変化する。気相中での分解反応は温度や圧力が上昇するほど速くなる。
2O3 ⟶ 3O2 (Ⅲ-8)
2.2 オゾン生成法
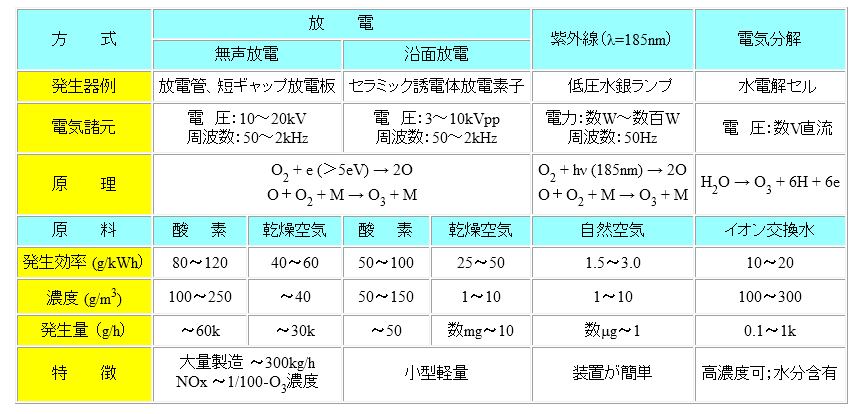
(1)無声放電方式
O + O2 + M → O3 + M (Ⅲ-10)
無声放電の一種である沿面放電型(surface discharge)が図 Ⅲ-3(B)である。誘電体を挟んで片側に面状電極、もう一方に線状電極を放電電極とする。前者の面状電極を誘電電極と呼ぶ。この両電極間に交流高電圧を印加すると放電電極と誘電体の間で放電が生じる。この際、写真 Ⅲ-1に示すように線状電極の周囲に沿って青白い放電が観察される。沿面放電式の優位点として平行空間を利用する無声放電に対して比較的簡単な構造で安定した放電が得られる。
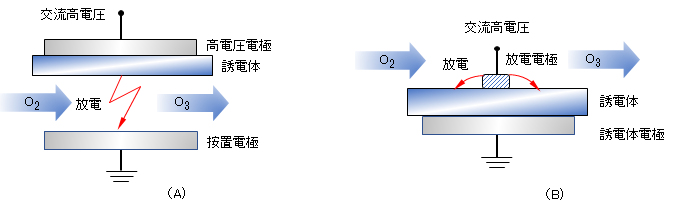
図 Ⅲ-3 無声放電によるオゾン生成の方式と原理
(A) 平行電極型放電 (B) 沿面型放電

写真 Ⅲ-1 沿面放電の様子事例 [オゾン発生装置.com, URL]
<放電モジュール>
図 Ⅲ-5は、中空状細管電極を束ねて、太い管に挿入する放電モジュール例を示す。オゾン発生量は、電極の総面積に比例するので、総面積を大きくして、大容量のオゾンを発生することができる。
ただし、放電により電極が発熱しオゾン分解も促進されるので、冷却法にも工夫がなされている。水冷が一般的であるが、液体窒素などを用いて極低温にするとオゾン発生効率が極めて向上するとの報告もある。
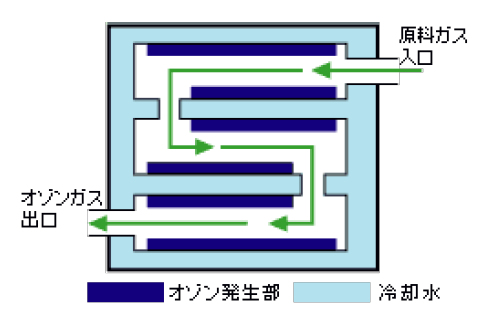
図 Ⅲ-4 連続多室型のオゾン発生器例 [岩崎電気, URL]
図 Ⅲ-5 細管電極のオゾン発生器例 [三菱電機, URL]
(2)紫外線ランプ方式
このランプは185nm及び254nmの波長の紫外線を放出するが、オゾンの生成に寄与するのは185nmの紫外線である。波長185nmの光子(エネルギー:ε= hν)を酸素分子が吸収すると、酸素原子に解離し、その酸素原子が酸素分子と結合しオゾンを生成する。
O + O2 → O3 (Ⅲ-12)
O3 + hν(λ= 254nm) → O + O2 (Ⅲ-13)
なお、オゾンは不安定で、水銀ランプから出されるもう一方の波長254nmの紫外線を吸収しやすく、吸収すると酸素原子と酸素分子に分解する。このことから、水銀ランプを用いた方法では高濃度のオゾンは得られない。なお、波長254nmの紫外線をカットする特殊なガラス管も開発されているが、高価なものとなる。
しかし、水銀ランプによるオゾン発生器は非常に簡易であるために空気清浄(殺菌、脱臭)等低濃度オゾン利用分野で普及している。
(3)電気分解方式
2.3 オゾン生成原料
(1)濃縮酸素
このほかにも、電気・化学的な方法によって水から酸素を生成するものもある。こうしたものは、電気、薬剤と水が必要となるので、コストや手間を要する。こうした電気・化学式の酸素発生装置と区別するため、ここでは「酸素濃縮」という名称で説明する。
一般的に利用されている酸素濃縮法には、圧力変動吸着法(PSA)と透過分離膜法がある。
1)圧力変動吸着法
空気中酸素の濃縮に用いる合成ゼオライトは、加圧下で窒素を選択的に吸着するので、空気中に残存する濃縮酸素をオゾン装置に供給する。ゼオライトに吸着した窒素は大気圧へ戻すと、脱着するのでゼオライトを再生できる。この方法を用いた酸素濃縮装置は、家庭でも利用できる小型の酸素吸入装置(医療用)から、上水場でのオゾン製造設備や工業用高濃度酸素の大型生産設備まで、広範に活用されている。
実用化されている空気中酸素の濃縮装置は、PSA(Pressure Swing Adsorption)方式と呼ばれ、その基本構成を図 Ⅲ-6に示す。
PSA法は、以下の吸着・脱着工程を繰り返す事によって高濃度の酸素ガスを生成できる。
圧縮機で原料の空気を大気から取り込みむ。圧縮された空気は除湿機、活性炭槽にて水分、油分等を取り除き吸着塔に送る。2塔から構成される吸着塔は、以下に示す工程で、交互に圧縮空気の注入(濃縮酸素生成)と大気圧への減圧(吸着剤の再生)を交互に繰り返す。
① 吸着塔Aへ空気導入と昇圧(吸着工程):コンプレッサーにより、原料空気は下部弁を開いたA塔に送られ、吸着圧力まで昇圧される。吸着剤に窒素ガス・炭酸ガス・水分等が吸着され、昇圧空気中に濃縮された酸素ガスが残存する。A塔昇圧の間、B塔の下部弁を開にし、大気圧まで減圧して吸着された窒素等を脱着して大気に排出する。
② バッファタンクへの酸素供給とB塔の再生(酸素供給・B塔再生工程):A塔内の濃縮酸素ガスをバッファタンクへ送気する。同時に、A-Bを連結するパイプ内オリフィスを通過した酸素ガスがB塔へ導入され、B塔内の吸着剤が効率よく再生される。
③ 両塔均圧: A塔の吸着工程、B塔の再生工程が終わると空気供給用、バッファタンク、排出用の各弁を閉める。両塔の上下にある両塔間の弁を開けて両塔を均圧にする。以後、以下を繰り返す。
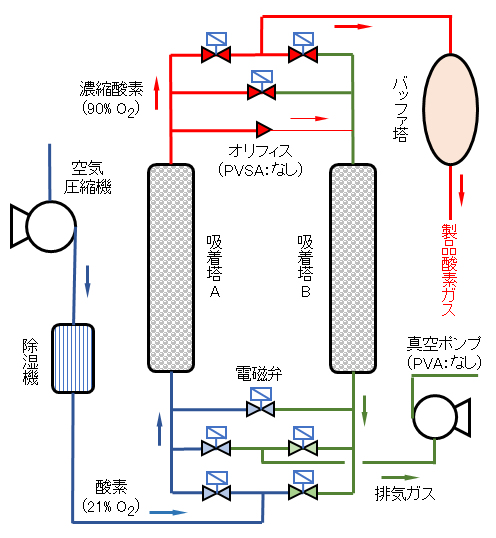
図 Ⅲ-6 PSA/PVCA酸素濃縮装置の構成図
PVA法では、空気圧縮機で0.6MPa以上に圧縮するための電力消費が高いが高圧の酸素ガスが得られるので、小規模(酸素ガス:100m3/hr程度以下)の設備として導入される。
一方、PVSA法は、ブロワで空気を0.04MPa程度に昇圧し、N2・CO2・H2Oをゼオライトに吸着させ、酸素を製品として供給する。吸着した窒素等は真空ポンプで200Torr程度まで減圧して窒素を脱着し、吸着剤を再生する。真空設備が付加して設備費は高くなるが、電力コストがPVA法より大幅に改善されるので、中大規模(酸素ガス:200m3程度以上)の設備として導入されている。
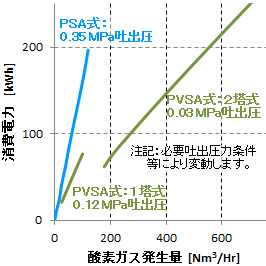
図 Ⅲ-7 PSA法とPVSA法における酸素ガス発生量と消費電力の例 [神鋼エアーテック,URL]
2)透過分離膜方式
<酸素富化膜型>
酸素富化膜では、膜に気体分子が溶け込むという性質を持った膜である。膜の出口を減圧すると、気体分子(酸素分子、窒素分子)が膜側に引っ張られて膜に溶け込み(溶解)、膜内に拡散、膜の減圧側に離脱する。そのときに、酸素のほうが窒素よりも膜を通り抜ける速度が速いため、減圧側で取り出した空気の酸素濃度が高くなる。
なお、膜には穴が開いているわけではなく、細菌やウィルスは通り抜けることができないので、清浄な高濃度酸素を得ることができるのも、酸素富化膜方式の特徴になっている。ただ、酸素富化膜は高圧にして膜に押し込むのではなく、出口側を低圧にして空気を引き出す方法であるので、比較的高価なバキュームポンプが必要となる。
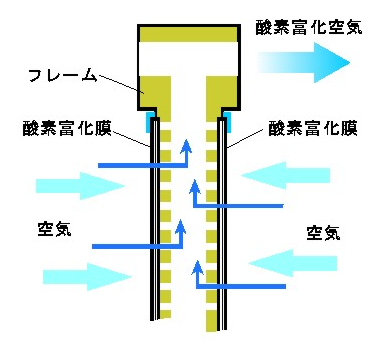
図 Ⅲ-8 酸素富化膜の原理 [ICST, URL]
<中空糸型>
酸素濃縮器用の中空糸膜は、酸素を通しやすい特性の素材が使用されている。酸素濃縮器では、一般にシリンダー状の膜モジュールを使用する。膜モジュールには、中空糸膜が束ねて収められていて、シリンダーの一方の端から圧縮空気をいれると、酸素、二酸化炭素などの分子径の小さい分子は膜の外側に排出され、分子径の大きい窒素はそのまま中空糸内を通り抜けて、中空糸の反対側から排出される。膜モジュールの側面から出てきた気体を集めると、酸素濃度の高い空気が得られる。
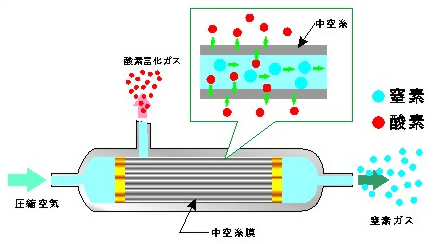
図 Ⅲ-9 酸素富化膜の中空糸型モジュールの事例 [ICST, URL]
(2)乾燥空気
騒音問題を解消するために、防音材を内部に貼り付けた防音箱による消音効果、さらには軽量化を目的とするアングル組みのスリム化、移動簡易のキャスタータイプ。低容量であれば持ち運び可能な大きさまでコンパクト化することも可能である。
集中配管や大型コンプレッサーなどによるエアー供給があれば、コンプレッサー別置型乾燥空気発生装置で手軽にクリーンエアーの低露点空気を作ることが可能となる。
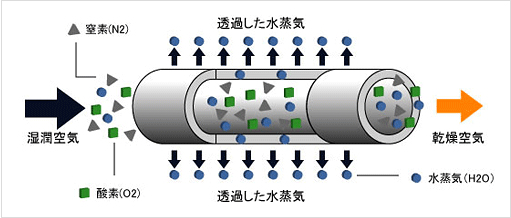
図 Ⅲ-10 空気乾燥用エアフィルターの事例 [MIHAMA, URL]
目次へ
3.オゾン濃度の測定
研究室規模では、簡便にオゾン濃度の測定が可能であるヨウ素法は古くから広く利用されている。これは、オゾンにより遊離したヨウ素をチオ硫酸ナトリウムにより還元滴定するもので、各種のオゾン分析法の校正に利用される。
産業界ではオゾンガスが特定波長の紫外線を優先的に吸収するので、この吸収率を測定する方法が広く用いられる。なお、オゾン測定用の紫外線発生管は1年程度で定期的に交換する必要がある。
(1)化学的方法
1)ヨウ素滴定法
着色が完全に消失する(終点)までのチオ硫酸ナトリウム標準液の滴下量から、オゾン濃度へ変換する。終点が近づくと検水の着色が薄くなるので、デンプン溶液を数滴加えると濃青色となり、終点では無色透明となるので、その判定が容易となる。
I2 + 2S2O32- → 2I– + S4O62- (Ⅲ-15)
気相中オゾンは、所定時間、KI溶液に吹き込み、これを上記の方法でオゾン濃度を測定し、オゾン量(検水オゾン濃度[mg/L]×検水量[L])/吹込時間[h]から単位時間のオゾン供給量を、オゾン量[mg]/吹込量[L]から気相中オゾン濃度が求まる。
<注意事項> I2は強い揮発性があるがKI溶液中では、式(Ⅲ-16)のようにI3–イオンとして溶解している。このとき、I–の濃度が高いほど、I2の揮発性を下げることができるので、十分に濃厚なKI溶液でオゾンを吸収させる必要がある。
なお、吸収液のpHによってオゾンと反応して遊離するヨウ素の量が異なる。中性では式(Ⅲ-16)に示すようにO3:I2=1:1となるが、弱アルカリ性では遊離したI2が式(Ⅲ-17)・(Ⅲ-18)に従いKIO3にまで酸化される。
3IO– → 2I– + IO3– (Ⅲ-18)
ただし、酸性では十分なH+が存在し、式(Ⅲ-19)の反応によりI2を遊離するので、中性に保つpH緩衝剤を含むKI溶液をオゾン吸収液とする。
2)オゾン試験紙
3)発色法
測定の際にはこの両端の封入を破り、一定量の試料ガスをこの管内に一定流速で通過させ、指示層の色変化の長さから濃度を測定する。オゾンの測定には、インディゴ染料を使用されている。
(2)物理的手法
1)紫外線吸収法
オゾン濃度計は、試料とゼロガス生成器を通りオゾンを分解した試料(以下、「ゼロガス」という。)の紫外線吸収量を比較し、この差からオゾン濃度を求める。
試料取入口から取り込まれた試料は、電子除湿器やフィルターで除湿と除塵を行ったあとオゾン濃度計に導入される。導入された試料は、一定の時間間隔ごとに三方電磁弁で流路を切り替えることにより、そのままの試料またはゼロガスとして交互に測定セルへ導入される。測定セルでは、低圧水銀ランプで発生させた紫外光が照射され、試料とゼロガスそれぞれの紫外線減衰量を受光センサ1で測定する。オゾンは253.7nm付近の波長を中心とした吸収スペクトルを有しているため、低圧水銀ランプの発光スペクトルがこれと重なるように紫外光を照射している。
したがって、ゼロガスは低圧水銀ランプからのオゾンによる吸収のない光量の基準となとなる。オゾン濃度は、大気試料とゼロガスが測定セルをそれぞれ通過したときの光量を比較し、これを電気信号に変換して求める。
紫外光吸光法のオゾン濃度計によるオゾン濃度は、ランバート・ベールの法則によって次式により求められる。
C:オゾン濃度、α:オゾンの吸収係数、T:測定セルの光路長、Io:ゼロガスの透過光量、Ix:試料の透過光量、A:定数
溶存オゾンもガスと同様の原理で測定できが、妨害物質や懸濁物質の影響を受けるので気相へ変換して、オゾンガスとして測定する方法もある。
<高濃度オゾンの測定>
図 Ⅲ-11に示すオゾン計が、地上オゾン濃度測定用で極めて高感度なもので、受光センサーとして光電子増倍管が使われる。オゾン発生器からのオゾン濃度の測定では、受光センサーとして、コンパクトな半導体センサが利用できる。
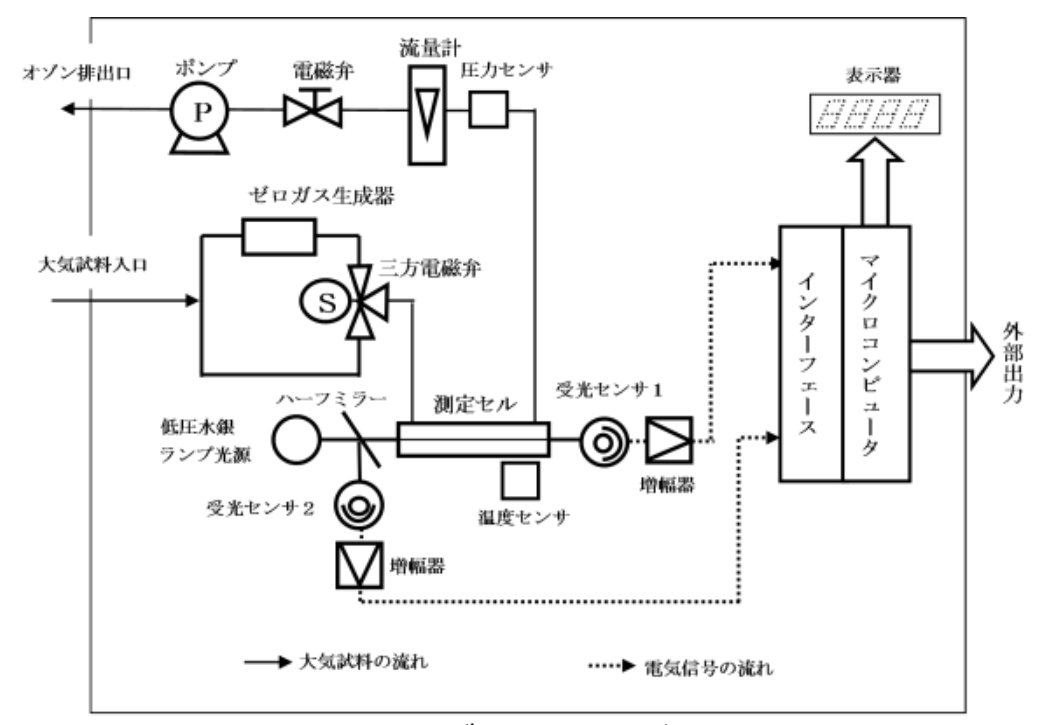
図 Ⅲ-11 紫外線吸収法による地上オゾン濃度計の系統図 [気象庁, URL]
2)半導体電気抵抗測定法
(3)物理化学的方法
1)電気化学法
2)化学発光法
化学発光法は、次の反応の化学量論係数が1.0であることに基づいている。
*NO2 →NO2 + hν (Ⅲ-22)
同様な化学発光法を応用したものとして、エチレンとオゾンを混合接触させると、これらが反応して発光する。この発光を光電子増倍管によって検出する。この気相における反応は安定であり、優れた選択性をもっている。発光スペクトルは、300~600nmに発光領域があり、極大波長は450nm付近にある。
なお、工場地帯や都市部での大気中オゾンの測定では、オゾン濃度も微量で様々な有機物質やNOxなど、オゾンと反応する物質が存在するので、その測定には注意すべき事項が多々ある。しかし、オゾナイザーの性能や生成オゾン濃度の測定では、特に問題となることはない。また、高濃度オゾンであるので、受光センサーとして光電子増倍管の代わりに半導体センサが利用できる。
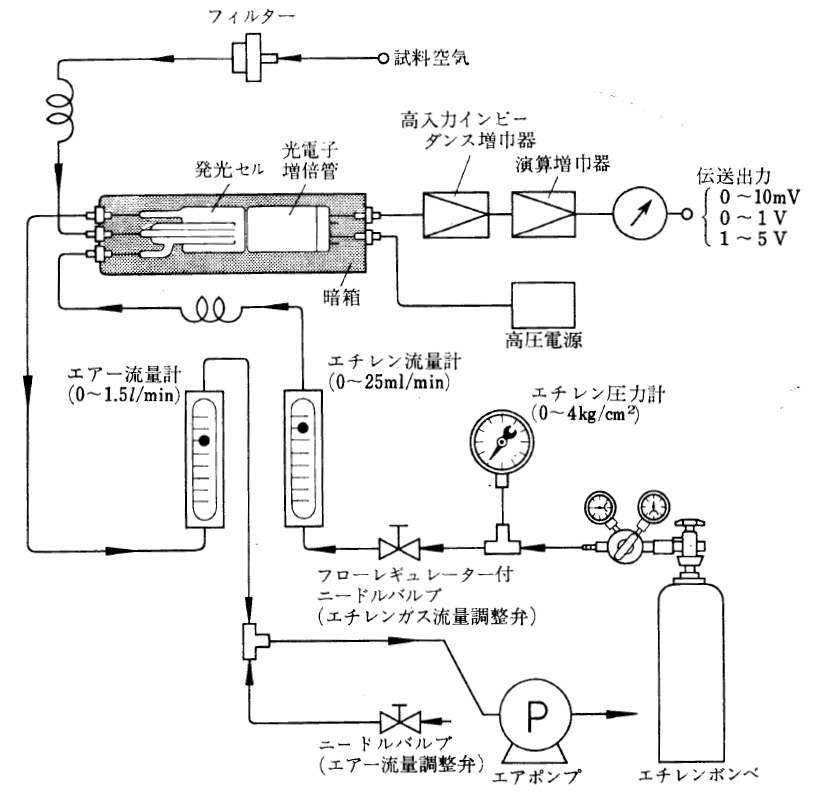
図 Ⅲ-12 化学発光法による大気中オゾン計の測定系統図 [森, 1972]
目次へ
Ⅳ.紫外線殺菌
太陽光の中には、UV-A、UV-B、UV-Cの波長の紫外線が含まれているが、そのうちUV-A・UV-Bはオゾン層を通過、地表に到達する。UV-Cは、物質による吸収が著しく、通常は大気を通過することができない。地表に到達する紫外線の99%がUV-Aである。太陽光に含まれる紫外線には強い殺菌作用がある。これは虫干しや日光消毒などの体験からよく知られている。
紫外線は化学薬品を使わないで水を殺菌できるので、水産・食品などに関する水の殺菌、超純水、プール水および排水の殺菌など、幅広い分野で使われている。本サイトでも、活魚水槽、池干し、池の殺藻などに紫外線利用例を掲載している。
図Ⅳ-1に紫外線の波長と殺菌効果を示す。紫外線の中で殺菌効果が高いのは波長の短い254nm(UV-C)である。光のエネルギーは次式で示されるように、波長が短いほどエネルギーレベルが高いことになる。
h:プランク定数、c:光の速度、λ:波長
1.紫外線の殺菌機序
紫外線を細菌に照射すれば、細菌細胞内のDNAに作用して、水和現象、ダイマー形成、分解などの光化学反応をひき起こし、その結果、菌類が死滅するものと考えられている。なかでもDNAのチミンのダイマー形成が一般的な説となされ、図Ⅳ-2に示すように、260nm付近の波長をもつ紫外線の殺菌効果が最も高いとされている。
以上のことから、260nm近傍の紫外線を細菌に照射すればDNAを破壊して細菌を死滅させることができるので、塩素殺菌と違って化学薬品を使わないで殺菌が可能となる。
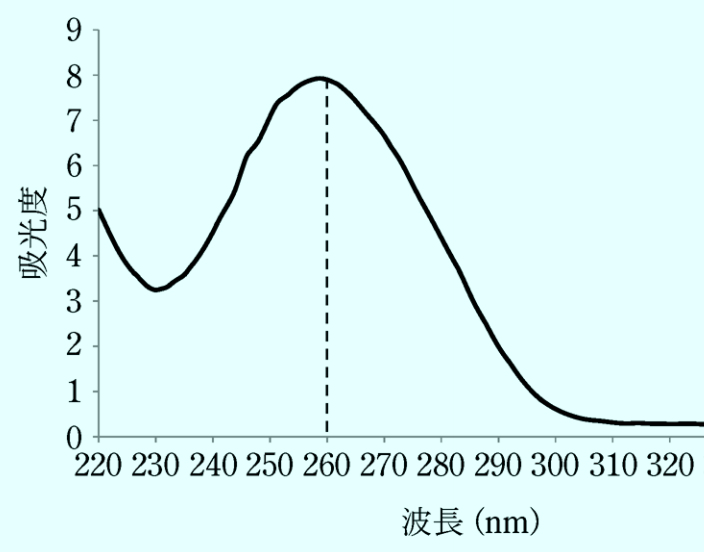
図Ⅳ-1 DNA・RNAの吸収スペクトル [柴山, 2017]
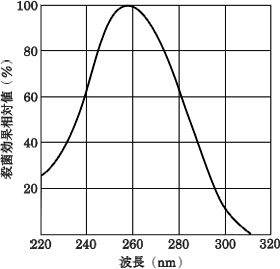
図Ⅳ-2 殺菌作用の波長特性 [JIS Z 8811]
2.紫外線ランプ
図Ⅳ-3に低圧水銀ランプ(有電極型)の構造と発光特性を示す。このランプは紫外線領域の波長 254nm(殺菌線)と185nm(オゾン線)に強い発光線を示す。
紫外線ランプはUVを通しやすい石英管に収納するが、石英の材質によって、①オゾンレス石英ガラスランプと②合成石英ガラスランプに分けられる。
①オゾンレス石英ガラスランプは、石英ガラス中にチタンなどを混ぜて200nmより短波長のUVを吸収するようにしたランプで主に254nmのUVを放射し、紫外線殺菌ランプとして用いられる。
②合成石英ガラスランプは、200nmより短い波長のUV透過性に優れ、ランプ点灯時間の経過による透過性の劣化も少ないので、効率よく185nmのUVを放射する。185nmのUVは気相中酸素と作用してオゾンO3を生成するので、紫外線オゾン発生装置などに用いられる。オゾンレスと合成の石英ガラスの相違は、石英材質の差異による185nm(オゾン線)のUVを透過するかしないかの相違である。
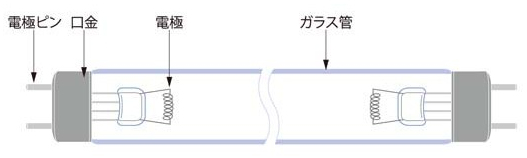
(A) ランプの構造
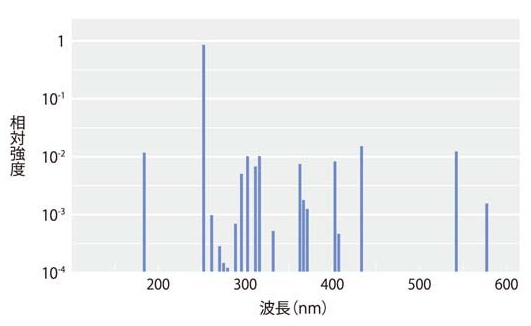
(B) 発光スペクトル
目次へ
3.死滅に必要な照射線量
S:菌類の生存率、Po:紫外線照射前の菌数、P:紫外線照射後の菌数、E:有効な紫外線照度(mW/cm2)、t:照射時間(秒)、Q:生存率Sを1/e=36.8%とするために必要な紫外線照射線量

目次へ
4.紫外線の測定
紫外線の測定には、古くは光電効果を利用した真空管が利用されていた。しかし、現在は、大きい増倍率、低雑音、広い波長域と感度レンジに対応できるなどの利点をもつ光電子増倍管を除いては、半導体を利用した光検出器にとって代わられている。光電子増倍管は、分光器(特定波長の光を取り出す)と一体で装置化され、複雑化・高価格となる。半導体光検出器は小型・軽量なので、光計測によく使用されるものの、半導体の種類によって測定可能な波長域や性能(感度、暗電流、ノイズ、応答速度など)が異なるので、測定目的に沿って選択する。
(1)回折格子・光電子増倍管による測定
(2)フォトダイオードによる測定
半導体pn接合に逆バイアス電圧を印加し、これに入射するバンドギャップよりも大きい光エネルギーで流れる光電流を利用する光センサーは、フォトダイオードと呼ばれる。逆バイアスを印加せずに、pn接合に光を照射し光電流を増幅する方法もある。代表例は、Siセル(太陽電池)やGeセルである。pn接合の間に真性層を挟み、高速応答を得るものとして、SiやInGeGaAsなどのpinフォトダイオードや、増幅作用のあるアバランシュフォトダイオードがある。フォトダイオードは検出できる波長域が異なるので、電流検出・増幅回路、反射光や目的波長以外の光の除去(分光フィルター)などを組み合わせて、目的波長(帯)の紫外線検出器が構成されている。フォトダイオード利用紫外線測定器は、強力な紫外線の照度も正確に計ることができ、信頼性の高い精密計測器である。また、紫外線システムの保守・管理に活用できる。半導体センサを用いた紫外線測定器はコンパクトで、電池でも稼働するので、現場分析にも適用可能であり、次のような特長がある。
➀ 受光器を差し替えるだけで各UV波長域の測定が可能、② 高速応答性で、高速搬送時の正確な測定が可能、③ 校正が簡単(校正用光源が別途に必要)、④ USB対応でPCからの設定も可能で、外部電源としても使用可能、⑤現場に受光器と通信機を設置して遠隔測定が可能、⑤オゾナイザーに接続して、その計測制御が可能。
半導体に関する基礎知識および検出回路は、水浄化技術に関わる様々な分野において極めて重要であるので、別途ページにて解説する。なお、光半導体素子に関する基礎・応用については、文献[HAMAMATSU, URL]が参考となる。
V.殺菌技術のまとめ
1.殺菌技術の選定
殺菌技術は、方法によってその効果と価格が大きく異なる。同じ原理を用いた殺菌技術でも、メーカーによって多種多様な装置が提供されている。殺菌技術の原理と限界を理解した上で、性能のみでなく維持管理(技術上の難易、設置スペース、電気消費量、消耗する薬品・部品や人件費、安全性)を含めて選定する。
2.殺菌装置・システムの設計と設置
殺菌効果の測定と装置の発生量・投入量が手動・自動のいずれを問わず、維持管理が簡便にできるシステムが求められる。
小型浄化槽では、半年以上で消耗する錠剤を筒に充填して、処理水と接触させ、15分以上の滞留時間となるように消毒槽が設計されている。放流水中に残留塩素が、試験紙で検出されるように、錠剤充填筒に底部ある接触口を調整するという、維持管理が極めて簡便なものである。
3.殺菌操作上の留意点
規模に関わらず、設備を利用した殺菌技術では、薬品の管理、装置・システムの運転には、安全管理と適正な性能が発揮できるよう留意する。
参考文献および引用図表
ICST:http://icst.jp/products/oxygen-exp.html
HAMAMATSU:https://www.hamamatsu.com/resources/pdf/ssd/01_handbook.pdf~https://www.hamamatsu.com/resources/pdf/ssd/15_handbook.pdf
MIHAMA:http://www.mihama.com/products/chemical/sao_apparatus.html
Roth, J.A., D.E.Sulivian: Ind.Eng.Fundam, No.20, pp.137-140(1981)
USHIO:https://www.ushio.co.jp/jp/technology/glossary/glossary_ta/low_pressure_mercury_lamp.html
岩崎電気:https://www.iwasaki.co.jp/product/applied_optics_field/washing_system/04_2.html
オゾン発生装置.com:http://www.wako-system.co.jp/005.html
気象庁:http://www.jma-net.go.jp/kousou/obs_first_div/ozone/index.html
柴山 祥枝:ぶんせき, No.7, pp.268-274(2018) (http://www.jsac.or.jp/bunseki/pdf/bunseki2018/201807nyuumon.pdf)
曽根興三・田中元治(訳) :定性分析化学Ⅱ,共立出版,p.462, p.473(1974)
神鋼エアーテック:http://shinko-airtech.com/equip_o2.html
中村 成興・村山 智正:日本海水学会誌, 第5号, pp.305-311(1996)
光と色と:http://optica.cocolog-nifty.com/blog/2012/08/post-efe1.html
水処理管理便覧編集委員会:水処理管理便覧、丸善、p.259(1998)
三菱電気:http://www.mitsubishielectric.co.jp/society/ozonizer/ozonizer/index.html
森 正樹:環境技術, vol.1, No.10, pp.738-742(1972)
諸岡 成治・池水 喜 義・加藤 康夫:化学工学論文集, Vol.4, No.4, pp.377-380(1978)
目次へ
掲載日:2018年11月14日
更新日:2018年11月17日
