村上定瞭(水浄化フォーラム)
2.電気泳動法の分類
電気泳動法の略語集
3.代表的な電気泳動法
3.1 アガロースゲル電気泳動法
3.2 アクリロアミドゲル電気泳動法
4.キャピラリー電気泳動法
5.マイクロ・ナノチャンネル電気泳動
キャピラリー電気泳動法-略語集
参考文献
(以下、掲載準備中)
1.初めに
1.1 電気泳動法の概略
ここで言う荷電物質は、緩衝液(バッファー、buffer)成分を除くペプチド、タンパク質、核酸(DNA、RNA)、糖、金属など、水溶液中で正(+)または負(-)の荷電を持つ物のことで、いわゆる電気泳動の対象となる物質である。ただし、水溶液中では試料が拡散してしまうため分離する支持体として膜(membrane)やゲル(gel)を用い、これらの支持体中を荷電物質が移動していく現象を利用する。支持体中の荷電物質は、直流電場下で、その性質(形や荷電状態や分子量等)に応じて物質電荷と反対電極へ向かって移動する。その際の移動速度が物質によって異なるので、試料の各物質成分が分離できる。
支持体でよく利用されるアガロースゲル(agarose gel, AG)またはポリアクリルアミドゲル(polyacrylamide gel, PAG)は網目状立体構造をもち、物質に対し分子ふるいの役割をはたす。小さな物質は速く、大きな物質は遅く移動し、分子量に応じた分離が可能となる。この時、移動距離とタンパク質の分子量[Da]/核酸のサイズ[bp]はその対数値にほぼ反比例するので、電気泳動を用いて分子量/サイズの決定も可能となる。
また、分子ふるいではなくて、荷電状態や形状に応じた分離方法もある。これらの様々な要因をいろいろ組み合わせて試料中の各物質成分を分離することができる。
電気泳動法は上記の分離原理を利用して分子量決定をはじめ等電点や純度決定、各成分の比較・定量・精製確認などに利用され、核酸やタンパク質の主たる分離・分析法となっている。
事例として、図1に10kbpの環状2重鎖DNAプラスミド(合成)を、制限酵素ECoRI(E、Escherichia coli)と制限酵素BamHI(B、Bacillus amyloliquefaciens H)を用いて、それぞれ、および、双方を添加して切断したDNA断片のゲル電気泳動のバンドパターンを示す。酵素Eでは4kbと6kbの2断片、酵素Bでは3kb、7kbの2断片が展開されている。EとBの双方の酵素を添加した場合には、1kb、2kb、3kb、4kbの4断片が生じることが理解できる。
本ページでは核酸の分離・検出を中心に、電気泳動法の原理および各手法の装置、試薬や操作について、説明する。
注)用語については簡略化のために日本語、英語またはローマ字略号で表記しているが、初心者が混乱しないように重複して記載している。
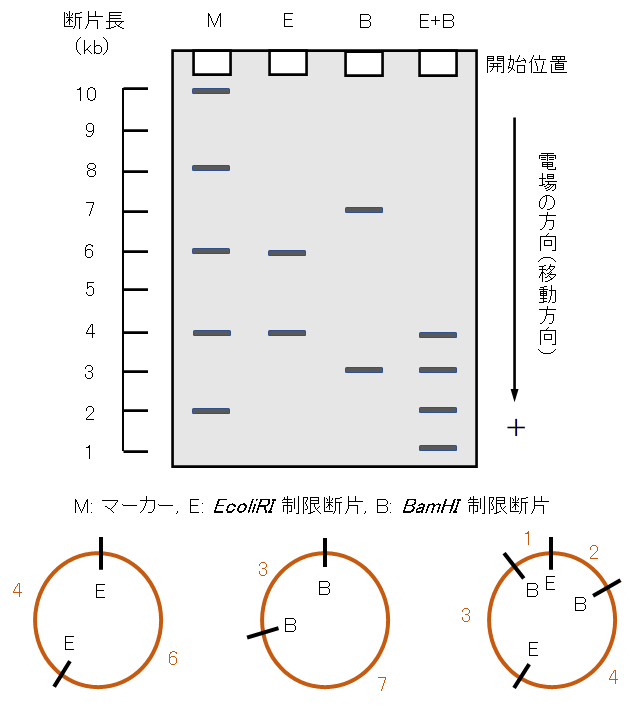
図1-1 DNAプラスミドの制限酵素断片の電気泳動のバンドパターン
実際の移動軸は対数で示されるが、本モデルのマーカー軸は等間隔軸で示していることに留意する。
1.2 電気泳動法実験の動画
電気泳動法の全体像を把握するため、高校生の実習教材の動画を紹介する。
動画1 λファージDNAの制限酵素断片のAG-EPによる測定
紫野高校非常勤講師・矢嶋正博:https://www.youtube.com/watch?v=NHo8yo51Mek
注)ウエル(well):井戸・穴という意味で、ゲル平板末端のウエルに試料を注入する。コウム(comb):櫛という意味で、ゲル平板末端に差し込んで、ウエルをつくる。
1.3 電気泳動試薬
1) TAEバッファー: 2mol/L Tris、1mol/L 酢酸、50mmol/L EDTAの混合液(pH 8.3)
トリス(tris(hydroxyethyl)aminomethane、Tis) 242g、酢酸 57.1mL、EDTA・2Na・2H2O 18.6gを1Lメスフラスコに入れて純粋でメスアップ、室温保存。
この原液を50倍に希釈して、核酸のAG-EP緩衝液に用いる。TAE緩衝液は低イオン強度(低電界強度、1-2V/cm)なので、大きなDNA(12-15kbp)を分離するのに適している。TAE緩衝液に溶かされたAGは大きい孔サイズと低い電界強度を有しており、大きなDNAのバンドがスメア(band smear:バンドがぼやけること)になりにくい。緩衝能力が弱いので、長時間の通電にはTBE緩衝液を用いる。
2) TBEバッファー: 500mmol/L Tris、500mmol/L ホウ酸、20mml/L EDTAの混合液(pH 8.3)
トリス 60.55g、ホウ酸 30.9g、EDTA・2Na・2H2O 4.65gを1Lメスフラスコに入れて純粋でメスアップ、オートクレーブ/フィルターで滅菌、室温保存。
この原液を10倍に希釈して、DNA分離におけるPAG作製やPAG-EP緩衝液に用いる。小さなDNA(<1,000bp)の分離に適している。高イオン強度(高電界強度)および高いpH緩衝能を有している。
3) DNAバンドの染色液
核酸染色においてEtBr(ethidium bromide)は、広く使用されている染色試薬であり、核酸染色のスタンダード試薬として位置付けられている。一方、EtBrは変異原性が指摘されており、取り扱いには注意が必要である。近年では、安全性の高い新たな核酸染色試薬も開発・市販されている。
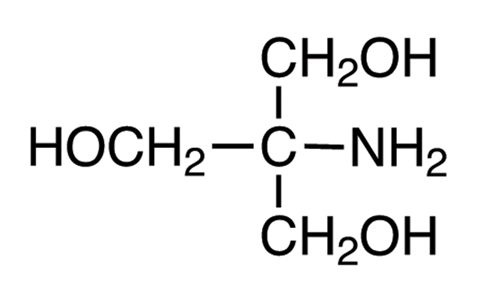
図1-2 トリス(Tris(hydroxyethyl)aminomethane)。
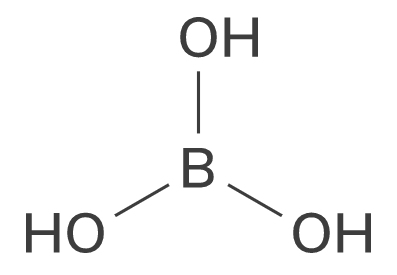
図1-3 ホウ酸(boric acid)
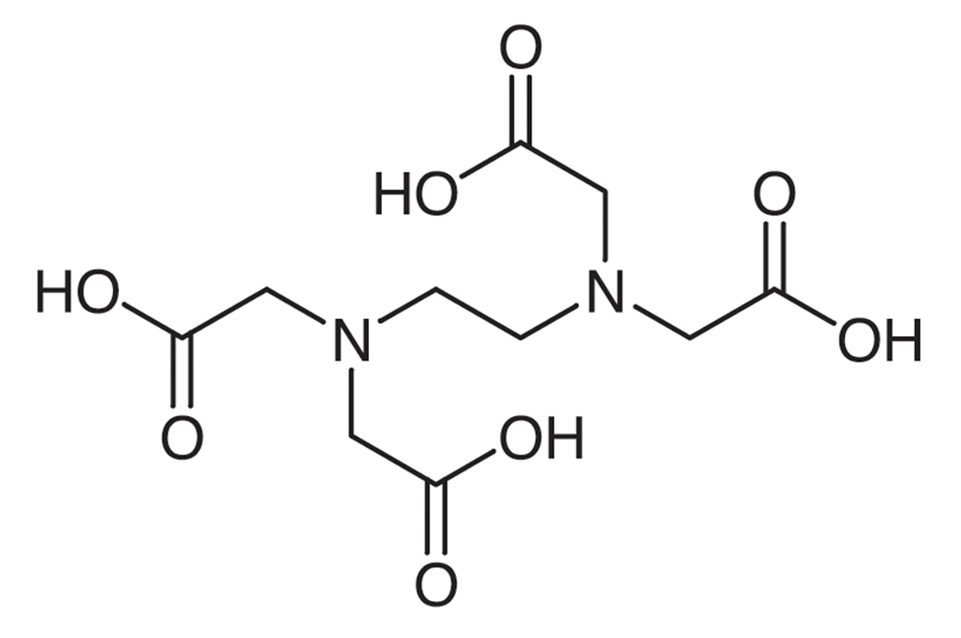
図1-4 EDTA(ethylenediaminetetraacetic acid)。
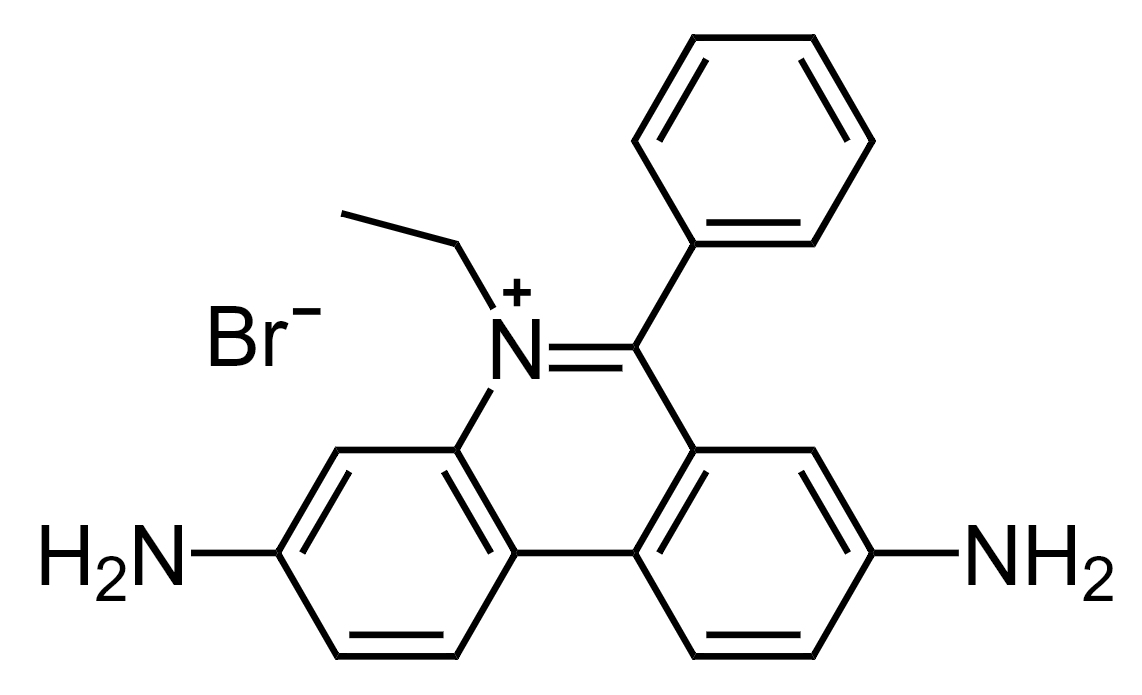
図1-5 EtBr(ethidium bromide)
AG-EPなどの電気泳動を行い、ゲルに紫外線を照射して蛍光を検出する。紫外線は目や肌に有害であるため、紫外線をカットするフィルター越しに観察するか、カメラの付いた撮影装置の中で紫外線を照射する。インターカレートされる臭化エチジウムの量はDNA分子の大きさにだいたい比例するので、蛍光の強さでおよそのDNA量を見積もることができる。
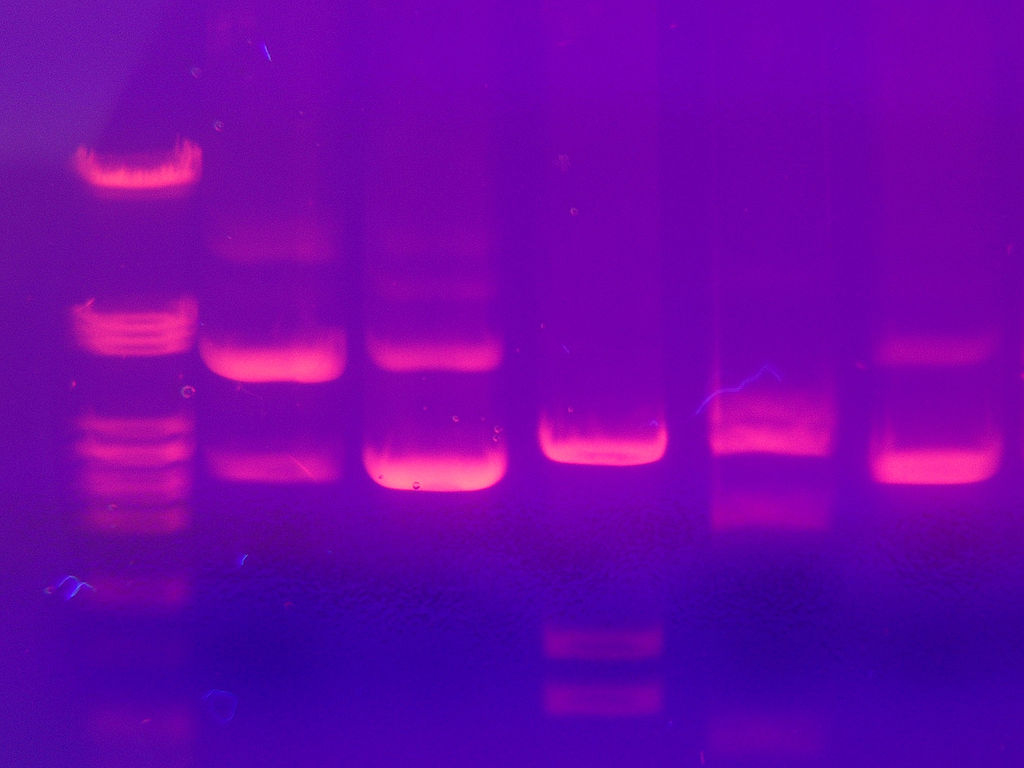
図1-5 AG-EP分離したゲル上のDNAバンドのEtBrによる染色・検出写真
Mnolf: Photo taken in Innsbruck, Austria; https://commons.wikimedia.org/w/index.php?curid=1131449
2.電気泳動法の分類
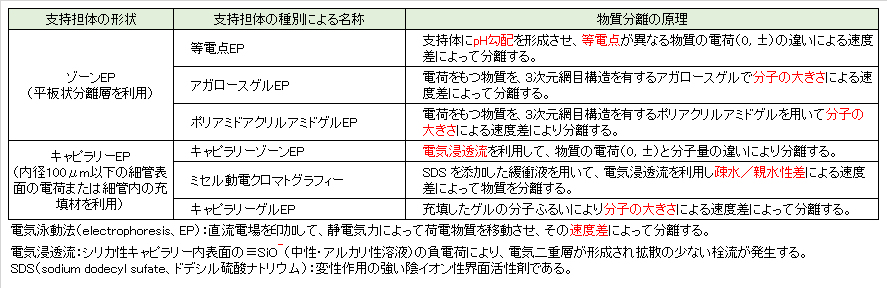
3.代表的なゾーン電気泳動法
3.1 アガロースゲル電気泳動(AG-EP)法
DNAやRNAはバッファーなどに溶解すると、リン酸残基によってマイナスに荷電する。これらの核酸溶液をゲルローディングバッファー(ローディングダイともいう)と混和してAGの中に添加する。
また、電気泳動後に核酸サイズの確認を行うための分子量マーカーはサンプルに応じたマーカーを選別してゲル内に必ず添加する。
通電すると。バッファー中でゲル内のDNAは陽極側に移動する。ゲルの分子ふるい効果により、長いDNAは網目構造内をゆっくりと動くのに対し 短いDNAはより速く動くことから、核酸のサイズに応じた移動度を示す。一般に核酸を分離するために使用されるアガロースの濃度は、0.5~5%であり、濃度が高いほど小さい断片を分離する(表3.1)。電気泳動およびアガロースゲルの作製時に使用するバッファーはTAEバッファーまたはTBEバッファーが用いられる。
電気泳動後のゲルはEtBr(ethidium bromide)などの蛍光試薬などで染色し検出することで核酸の電気泳動パターンが得られる。このパターンから分子量の推定および確認、個体識別のための遺伝子型の情報を得ることが可能となる。
また、目的とするDNAの検出法としてサザンブロット法がある。サザンブロット法はDNA試料をAG-EPで分離した後、分離されたDNA変性させる。このDNAをニトロセルロース膜に転写した後、膜上の特定配列をもつDNAを、これと相補的な塩基配列をもつDNA標識化したもの(プローブ)との塩基対の形成(八イブリダイゼーション)を利用して検出する。
注)ゲルローディングバッファー:泳動かどれほど進行しているかを目で確認するだけでなく、核酸がゲルに入り込む前に浮いてしまうのを防ぐ役割がある。
解説-AG濃度と分離DNAサイズ
一般的に、小さなDNA断片の分離には、高濃度のゲルが適している。濃度の低いゲルは壊れやすくて扱い難く、一方、濃度の高いゲルは濁っていて可視化を妨害することがあることに注意すること。
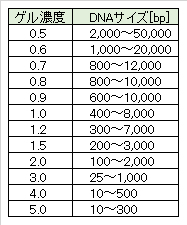
ゲル濃度(w/v、g/mL):AG重量[g]/buffer[mL] × 100[%]
解説-AG-EP装置
アガロースゲル(AG)はポリアクリルアミドゲル(PAG)よりも大きな網目構造をとるため、比較的長い核酸断片(およそ50bp~20kbp)の分離に使用される。AGはすべりやすく、PAGのような垂直型の方式には適していない。ゲルを水平にしてバッファー内に沈めるサブマリン式で泳動することが一般的である。
水平型のものは、ゲルの厚みを厚くでき、投入できるサンプル量を増やせるが、分離能に劣る。DNAは負に荷電した分子なので、電場をかけると正極の方に移動する。
アガロースゲルの厚さは3~4mmが適している。5mmよりも厚いゲルを使用すると、バンドがぼやけたり、染色のバックグラウンドが高くなる原因となる。同様に、泳動バッファーは、水面の高さがゲルの3~5mm上になるくらいの量を使用する。バッファーがあまりにも多いと、DNAの移動が遅くなったり、バンドが歪む原因となる。
印加電圧(+極と-極との距離[cm]に対する)は、4~10V/cmとする。電圧が低すぎると移動度が低下し、DNAの拡散によってバンドが広がってしまう。電圧が高すぎると、ゲルの過熱によりバンドの解像度が低下する恐れがある。特に、長時間による電気泳動で、バッファーの温度が大きく上昇する場合には、外部冷却器(循環ポンプ、冷却器、温度センサより構成)を電気泳動装置に接続して、バッファーを循環して一定温度に保つ。

写真1 AG-EP装置(水平型)の事例
https://anatech.co.jp/upload_files/report/201810301641085108QKcFO.pdf
解説-アガロースゲル(AG)の作成と電気泳動
AG(寒天)は、アガロース粉末にTAE/TBEバッファーを加え、加熱して溶かした後、冷却するとゲル化する。アガロースはその精製度が高いほど、分離能が高くなる。また、DNAの精製に用いる際には、融点が低い低融点アガロースを用いると電気泳動後のAG板の取り出し作業が簡便となる。
動画2のAGの作製と電気泳動の具体的な実験事例を示す。
動画2 小型サブマリン電気泳動装置の事例-AGの作製、電気泳動、展開ゲルの蛍光染色、展開パターンの蛍光撮影
ATTO Co., https://www.atto.co.jp/products/agarose/small8x102/WSE-1710
3.2 ポリアクリドアミド電気泳動(PA-GE)法
ポリアクリルアミドゲル(polyacrylamide gel、PAG)は、アクリルアミド(acrylamide、AAm)の重合体をビスアクリルアミド(N,N’-methylenebisacrylamide、BIS)が架橋することにより、網目構造を形成する。網目の大きさは、AAmの濃度で変わり、ゲルの強度は架橋剤のBISの割合を高めることで強くなる。PAGはDNAサイズの分解能がよく1塩基の違いも検出できる。小さいサイズ(数塩基)から数kb程度のサイズの断片の泳動にも使用できるが分離できる。
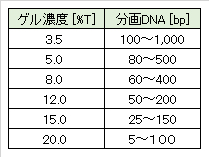
DNAサイズの範囲は狭いため、サイズに合わせてゲル濃度を変える必要がある(表3.2)。
また、スラブ電気泳動装置を用いるときには、AG-EP装置とは異なり、専用の電源装置が必要となる。
電気泳動後の検出方法には電気泳動前に試料に蛍光色素(fluorescence dye)や放射性同位元素(radioisotope, RI)などの標識をしてから泳動・分離後に検出する方法や、電気泳動終了後に色素染色で可視化する方法などがある。核酸の検出にはEtBr(図1-4および図1-5)などの蛍光色素が用いられ、蛋白質の検出には、クマシーブリリアント青(Coomassie brillient blue, CBB)などの色素が用いられる。また、ブロッティングと組み合わせることで、ゲルから膜に移した成分のうち、特定の核酸や蛋白質を高感度に検出する方法もある。
得られた電気泳動パターンからは、試料成分の比較、分子量の推定や塩基特異性・変異の検出(多型)、精製度・純度の確認、RNAや蛋白質の発現量比較などの情報を得ることが可能となる。
解説-PAG-EP装置(垂直型)
垂直型PAGは2枚のガラス板の間にゲル溶液を流し込んで作るので、ゲルの厚みを薄くすることができる。薄いゲルは分離能に優れるが、投入できるサンプル量は少ない。
PAGの網目構造はAGよりも細かく、短い核酸断片(5bp~1,000bp)の分離に適している。

写真2 PAG-EP装置(垂直型)の事例
https://anatech.co.jp/upload_files/report/2018103016353165576v2Na.pdf
解説-ポリアクリルアミドゲル(PAG)の作成
PAGは、単量体であるアクリルアミド(AAm)と少量のN,N’-メチレンビスアクリルアミド(N,N’-methylenebisacrylamide、BIS)からなる重合体で網の目構造をしている。単量体の溶液に重合開始剤である過硫酸アンモニウム(ammonium persulfate、APS)および重合開始剤であるN、N、N´、N´- テトラメチルエチレンジアミン(N,N,N’,N’-tetramethylenediamine、TEMED)を加えると、ラジカル重合によってゲル化する。
(1) 必要なゲルの枚数に応じて、自作ゲル作成キット(ゲルプレート、コウム、スペーサー)もしくは多連ゲル作製器を組み立てる。
(2) ゲルの調整に必要な試薬(AAmとBIS混合液、APS液とTEMED液)を準備する。目的とする核酸のサイズによりアクリロアミドの濃度を変える。動画3および動画4にスラブゲルの作製手順を示す。AAmの重合反応およびBISによる架橋反応については、下記の「解説-ポリアクリルアミドゲル作製の化学反応」を参照。
動画3 ミニスラグゲル作製キットを利用したPAG作製方法
動画4 多連(4枚)ミニスラグゲル作製キットを利用したPAG作製方法
ATTO Co., https://www.atto.co.jp/technical_info/electrophoresis/Note_EP_gel-preparation
解説-ポリアクリルアミドゲル作製の化学反応
ポリアクリルアミドゲルが形成されるラジカル連鎖重合反応は、一般的にラジカル連鎖重合は、①重合の開始、②重合の伸長、③重合の停止の3段階からなる(図3-1)。
アクリルアミド(acrylamide、AAm)の重合の開始剤として、過硫酸アンモニウム(ammonium persulfate、APS)とN、N、N´、N´- テトラメチルエチレンジアミン(N, N, N’, N’-tetramethylethylenediamine、TEMED)が用いられる。
モノマーAAmとともに、架橋剤としてN、N´- メチレンビスアクリルアミド(N,N’-methylenebisacrylamide、BIS)を加えることによりポリマーpolyacrylamideを架橋し、網目構造のゲルをつくらせることができる。ポリアクリルアミドゲル(PAG)についての重合反応の詳細については、「website:温度を感じて変化するポリマーの合成」を参照されたい。
注)ゲル濃度
核酸の分離には、3~20%(%T)のPAGが一般的に使用される(表3.2)。PAGの濃度表示には、%Tと%C があり、以下のように表される。
%C[w/w、g/g] = BIS[g]/(AAm[g] + BIS[g]) x 100[%]
%Tに加えて、AAm(モノマー)とBIS(架橋剤)の合計量に対するBISの重量割合[%C]も、PAGの孔サイズおよびサンプル分離能に影響を及ぼす。
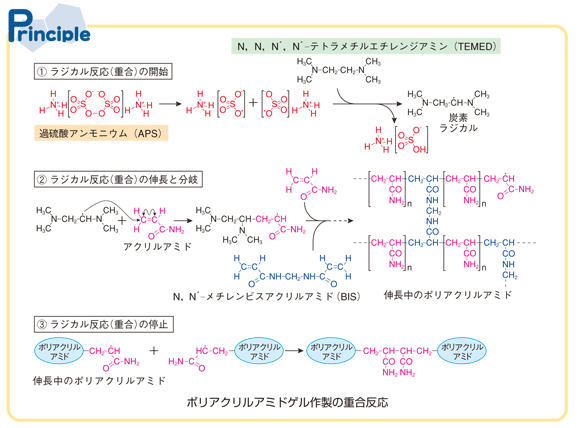
図3-1 ポリアクリルアミドゲル作製の化学反応
https://www.yodosha.co.jp/jikkenigaku/nucleic_acid/vol3.html
公開開始日:2021年12月16日
最終更新日:2021年12月19日
