Constituent elements of human body, seawater and crust
村上定瞭(水浄化フォーラム), Sadaaki Murakami (Water & Solutions Forum)
目次
1.環境水のpH
1.1 海水のpH
1.2 地下水のpH
2.海水と地殻の構成元素
2.1 海水の主要化学成分
2.2 海水の構成元素
2.3 海洋の誕生と構成元素の変遷
3.人体の構成元素
3.1 人体の構成元素
3.2 人体と海水との比較
参考文献
Table of contents
1. Environmental water pH
1.1 pH of sea water
1.2 pH of ground water
2. Constituent elements of seawater and crust
2.1 Main chemical components in seawater
2.2 Constituent elements in seawater
2.3 Birth of ocean and transition of constituent elements
3. Constituent elements of the human body
3.1 Constituent elements of the human body
3.2 Comparison between human body and seawater
References
1.環境水のpH
1.1 海水のpH
海水のpHは弱アルカリ性を示し、表層水では8.1~8.2となっている。これは表1に示すようにCa2+、Mg2+、HCO3–、H3BO3などのpH緩衝能をもつ電解質を含んでいるからである。気象庁によると、表面海水のpHは約8.1で、そのpHは深くなるにつれて下がっている。例えば、北西太平洋亜熱帯域では水深1000m付近で約7.4と最も低くなる(北西太平洋亜熱帯域でのpHの平均的な鉛直分布)。
これは、深くなるにつれて有機物の分解により海水中の酸素が消費され、全炭酸濃度が増加することによる。
目次へ
1. pH of environmental water
1.1 pH of seawater
The pH of seawater is weakly alkaline, with surface water ranging from 8.1 to 8.2. This is because as shown in Table 1, sea water contains pH buffering electrolytes such as Ca2+, Mg2+, HCO3–, H3BO3 and others. According to the Japan Meteorological Agency , the surface seawater has a pH of about 8.1 and its pH decreases with increasing depth. For example, in the northwestern Pacific Subtropical Zone, it is the lowest at around a water depth of 1000 m, around 7.4 (average vertical distribution of pH in the Northwestern Pacific Subtropical Zone).
This is because as the depth increases, oxygen in seawater is consumed due to the decomposition of organic matter, and the total carbon dioxide concentration increases.
To table of contents
1.2 地下水のpH
地表から浸透した降水には、大気中に含まれる二酸化炭素CO2が溶存しており、また、浅い地層に堆積した主に植物起源の有機物が分解して生成したCO2が地下水に溶け込んでいる。このため浅層の地下水では、やや酸性(6付近)のpHを示す。地下水が流動するとともに、CO2は砂礫と接触してNa+等のアルカリ成分を溶かし出し、CO2はHCO3–に変化して(Na+ + CO2 + H2O → Na+ + HCO3– + OH–)、アルカリ性を示すようになる。このように、沖積平野の深部に帯水する年代の古い地下水では、CO2が消失してpHが上昇する。場合によっては9.0を示すこともある。pHが9を超える事例は、溶存成分が比較的少ない花こう岩質の母岩から湧出する温泉水などでみられ、泉質はアルカリ性単純温泉と呼ばれ、全国各地にある [日本地下水学会]。
パイライトFeSを含む地層の地下水や鉱山湧水が地表に出ると、強い酸性を示す。これは溶解したFe2+が酸素によりFe3+に酸化されて、H+が放出されるからである(2Fe2+ + O2/2 + 2H2O → Fe2O3(s) + 4H+)。鉄バクテリアも共存し、水路は赤色で覆われている。このFe2+の酸化反応において、共存する炭酸水素イオンHCO3–が触媒作用を示す。HCO3–が全て消費されてpH 4近くまで低下すると、この反応は極めて遅くなる。
目次へ
1.2 pH of Groundwater
The precipitation permeated from the surface, the carbon dioxide CO2 contained in the air has been dissolved, and also CO2, produced by the decomposition of mainly plant-derived organic matter deposited in the shallow strata, is dissolved in groundwater. For this reason, shallow groundwater shows a slightly acidic pH (around 6). As groundwater flows, CO2 comes into contact with gravel and dissolves Na+ and other alkaline components, and CO2 changes to HCO3– (Na+ + CO2 + H2O → Na+ + HCO3– + OH–), it becomes alkaline. Thus, CO2 disappears and pH rises in old groundwater that is deeply flooded in the alluvial plain. In some cases, it may indicate 9.0. Cases where the pH exceeds 9 are seen in hot spring water that springs out from granitic host rocks that have relatively few dissolved components. The spring quality is called alkaline simple hot spring, and it is found all over Japan [Japanese Association of Groundwater Hydrology].
When groundwater or mine spring water from the stratum containing pyrite FeS appears on the surface, it shows strong acidity. This is because dissolved Fe2+ from FeS is oxidized to Fe3+ by oxygen in the air, and H+ is released (2Fe2+ + O2/2 + 2H2O → Fe2O3(s) + 4H+). Iron Bacteria also coexist and the waterways are covered in red. In this Fe2+ oxidation reaction, the coexisting hydrogen carbonate ion HCO3− acts as a catalyst, and the reaction becomes very slow when all of the HCO3– is consumed and the pH drops to near pH 4.
To table of contents
2.海水と地殻の構成元素
2.1 海水の主要化学成分
表1に海水中の主要化学成分の濃度を示す。海水は3.5%程度の塩分を含む。これは、地球が形成され、海が形成された当時、海水は酸性であり、それにより地殻を溶かし、アルカリ金属・アルカリ土類金属によって中和したことによる。ただ、海水が中性になって以降も僅かながら地殻を溶かし続けており、これにより塩分濃度は徐々に上昇を続けている。しかし氷河期による極地氷冠の成長や融解メルトダウンで多少の上下がある。
海洋の塩分は地球上の観測場所により3.1%から3.8%のばらつきがあり、海洋において一様ではない。とくに河口や氷河の崩落する地域では汽水化されている。最も塩分が高い外洋は紅海であり、海水の蒸発量の多さ、降水の少なさ、河川の流入、地形により海水の攪拌が少ないことなどが影響している。
なお、塩湖においては、海水よりもさらに塩分が高い場合がある。最も高いのは死海であり、塩分濃度は約30%である。これら塩湖は、河川から淡水が流入するものの、蒸発が激しく、流出する河川が無い事によって成立している。河川の淡水は僅かながら塩分を含んでいるため、水分の蒸発により塩分が濃縮されるのである。河川による水の流入はあっても流出がないという意味では、塩湖は海と同じである。[Wikipedia]
目次へ
2. Constituent elements of seawater and the crust
2.1 Main chemical components in seawater
Table 1 shows the concentrations of the main chemical components in seawater. Seawater contains about 3.5% salinity. This is because seawater was acidic at the time when the earth was formed and the sea was formed, which caused the crust to melt and was neutralized by alkali metals and alkaline earth metals. However, even after the seawater became neutral, it continued to dissolve the crust for a while, causing the salt concentration to gradually rise. However, there are some ups and downs due to polar ice cap growth and melting meltdown during the Ice Age.
The salinity of the ocean varies from 3.1% to 3.8% depending on the observation site on the earth, and is not uniform in the ocean. Especially in areas where estuaries and glaciers collapse, brackish water is used. The open sea, which has the highest salinity, is the Red Sea, which is affected by high evaporation of seawater, low precipitation, inflow of rivers, and low agitation of seawater due to topography.
In salt lakes, salinity may be higher than seawater. The highest is in the Dead Sea with a salinity of about 30%. These salt lakes are formed by fresh water flowing in from the rivers, but the evaporation is severe and no rivers flow out. Since fresh water in rivers contains a small amount of salt, the salt is concentrated by evaporation of water. A salt lake is the same as the sea in the sense that there is no inflow but no inflow from a river. [Wikipedia]
To table of contents
Table 1 Concentrations of major chemical components in seawater [Matsui, 1970]
| 成分 Component |
濃度 mg/kg Concentration |
溶質 % Solute |
成分 Component |
濃度 mg/kg Concentration |
溶質 % Solute |
|---|---|---|---|---|---|
| Na+ | 10,556 | 30.61 | Cl− | 18,980 | 55.05 |
| Mg2+ | 1,272 | 3.69 | SO42− | 2,649 | 7.68 |
| Ca2+ | 400 | 1.16 | HCO3− | 140 | 0.41 |
| K+ | 380 | 1.10 | Br− | 65 | 0.19 |
| Sr2+ | 8 | 0.03 | F− | 1 | 0.003 |
| H3BO3 | 26 | 0.07 |
2.2 海水の構成元素
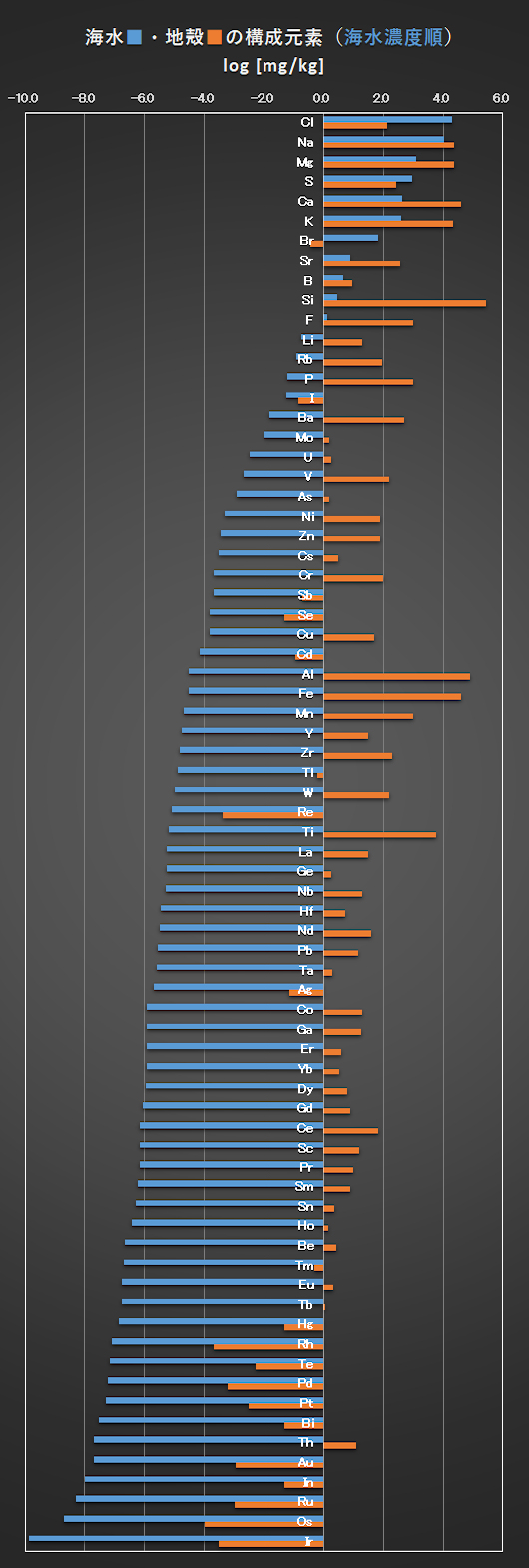
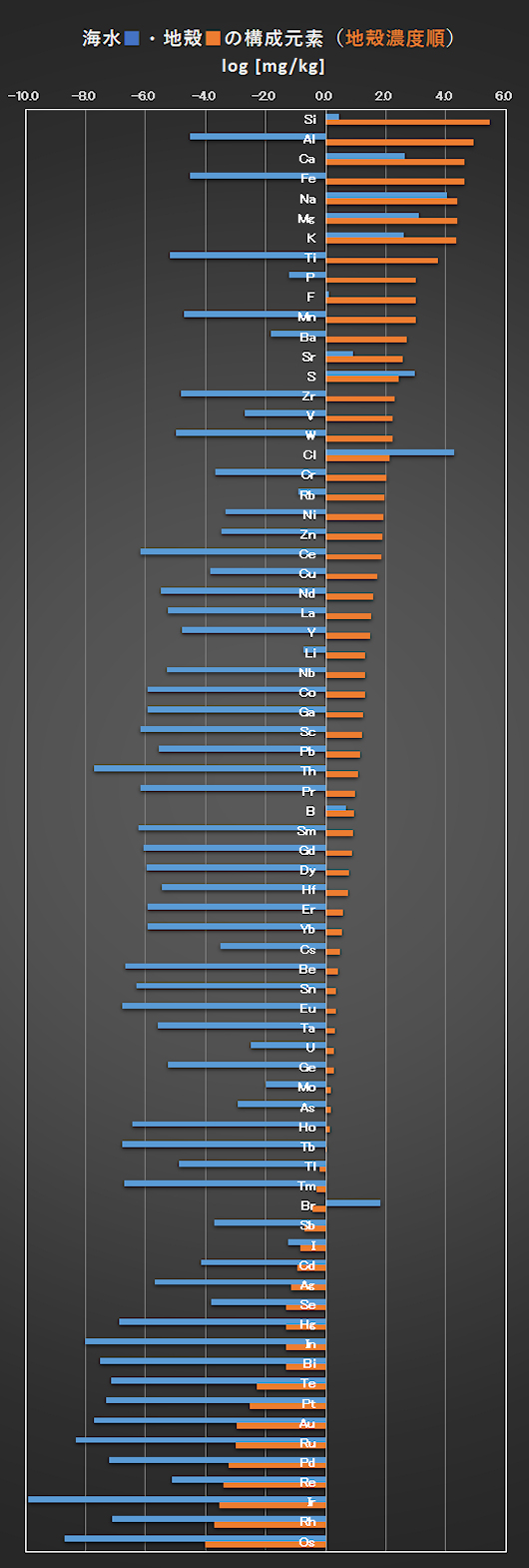
海水および地殻の含有量の関係を図1(海水濃度順)と図2(地殻濃度順)に示す。ただし、地球上に豊富に存在し、生命の主構成元素であり、常温で気体・液体・固体の状態の分子を構成するC、H、O、Nおよび希ガスは除いてある。
青棒 ■(海水濃度)と橙棒 ■(地殻濃度)との高さの差が小さい元素ほど、海水と地殻中との濃度比の相関性が高くなる。地殻に豊富に存在する元素が、必ずしも、海水中の濃度が高いとは言えない。
相関性の高い元素は、アルカリ金属元素とハロゲン元素で、これらは1価の正または負のイオンを形成して、安定な水和イオンを形成するイオンである。次に2価のアルカリ土類金属元素である。
一方、相関性が低い、あるいは全くない元素、すなわち、log [mg/kg] = 0.0の軸を基準として、青棒と橙棒が相互に反対方向にある元素である。これらは、安定な価数が3以上の金属元素である。これらの金属は中性の水中では、難溶性の水酸化物 M(OH)n(n ≧3 :価数、脱水酸化物:MOn/2)を形成し、それらの金属イオンの溶存濃度が極めて低いからである。リン P の海水中の濃度が低いのは、FePO4やAlPO4のような多価金属イオンと不溶性塩を形成しているからである。
目次へ
2.2 Constituent elements in seawater
The relationship between seawater and crust contents is shown in Fig. 1 (order of seawater concentration) and Fig. 2 (order of crust concentration). However, C, H, O, N and noble gases are excluded, which are abundantly present on the earth and are the main constituent elements of life, and which constitute molecules in a gas, liquid or solid state at room temperature.
The smaller the height difference between the blue bar (concentration of seawater) and the orange-red bar (concentration of crust), the higher the correlation of the concentration ratio between seawater and the crust. The abundance of elements in the crust is not necessarily high in seawater.
Highly correlated elements are alkali metal elements and halogen elements, which are ions that form mono-valent positive or negative ions to form stable hydrated ions. Next is a divalent alkaline earth metal element.
On the other hand, it is an element with low or no correlation, that is, an element in which the blue bar and the orange-red bar are in opposite directions with respect to the axis of log [mg/kg] = 0.0. These are stable metal elements having a valence of 3 or more. These metals are hard-to-dissolve hydroxide M(OH)n (n ≥3: valence; dehydrated oxide: MOn/2) in neutral water, and the dissolved concentration of these metal ions is extremely low. The low concentration of phosphorus P in seawater is due to the formation of insoluble salts, such as FePO4 and AlPO4, with poly-valent metal ions.
To table of contents
C、H、O、N、および希ガス元素を除く
Fig.1 Constituent elements of seawater and the crust (in order of seawater concentration) [Nozaki, 1996]
Excluding C, H, O, N, and rare gas elements
C、H、O、N、および希ガス元素を除く
Fig.2 Constituent elements of seawater and crust (in order of crust concentration) [Barbalace, 2007]
Excluding C, H, O, N, and rare gas elements
2.3 海洋の誕生と構成元素の変遷
私たちの住む星、地球ができたのは、今から約46億年前であった。原料となった物質は、微惑星に含まれていた岩石や金属であった。微惑星の衝突・合体の繰り返しによって地球は今の形、大きさを作っていった。小さいものは大きいものに吸収されていき、徐々に一つの惑星へとまとまっていったのである。地球の元である原始地球は、こうして誕生した。原始地球の半径が現在の地球の約2割、1500kmくらいになると、小惑星の衝突によって脱ガスを起こすようになった。脱ガスにより、中に含まれていた二酸化炭素や水、窒素などのガス成分は放出され、原始地球のまわりを覆った。原始大気の誕生である。原始大気は水蒸気を主成分とし、二酸化炭素や窒素、一酸化炭素を含んでいたと考えられている。46億年前の生まれたばかりの地球では岩石がとけたマグマの海が地表を覆っていた。また、水蒸気、二酸化炭素や窒素などのガスでできた原始大気が空を覆っていた。[地球の誕生]
およそ43億年前になると、地球の温度が急に下がって、原始大気の中に含まれていた水蒸気が雨となり、地上に降り注ぐようになった。雨が地表を冷やし、地表が冷えると原始大気が冷えてさらに雨が降り、年間の雨量は10mを超える凄まじい大雨だったと考えられている。この大雨が1,000年近くも続き、現在の海のもととなる原始の海が生まれた。原始の海は雨にとけた塩酸なども流れこんだので、はじめは酸性で、とても生物の住める環境ではなかったようである。酸性の海水はその後、地表の岩石・土壌の成分であるカルシウム、鉄、ナトリウムなどを溶かし、現在のような中性の海水になった。[海事広報協会]
酸性の海水が中性になるにつれて、高濃度であったAl3+やTi4+などがAl(OH)3やTi(OH)4などの水酸化物として沈殿し、現在の低濃度になった。
32億年前になると、光合成をする生物が現れ、二酸化炭素を酸素に変換するようになった。海水中の酸素が増加してくると、Fe2+はFe3+に、Mn2+はMn4+に酸化されて、それぞれ、Fe(OH)3、MnO2として沈殿していった。鉄やマンガンなどの濃度が低下し、海水中で酸素が消費されなくなった20数億年前から、大気中に酸素が供給されるようになった。[Wikipedia]
大気中の酸素が増加して、太陽からの紫外線が減少してくると地表にも生物が生息する環境が整い、二酸化炭素の消費と酸素の生産が平衡状態となり現在の大気となった。しかし、近年の化石燃料の大量消費により、二酸化炭素が徐々に増加しつつある。
以上の述べたように海洋が誕生した時代には、地殻と海水の成分にはかなりの相関性であったものが、アルカリ金属・アルカリ土類金属による地表からの溶出による酸性から中性へ、また、光合成生物の誕生とその酸素の生産による海水の酸化還元電位のプラス側への変化により、多価金属元素において顕著に見られるように地殻成分の傾向とは異なる海洋の構成成分となった。
ところで、特異な元素として、フッ素とリンである。ハロゲン元素であるフッ素はF–として安定である。また、リンは価数V・Ⅲ・Ⅰ・-Ⅲとして、環境の酸化還元電位に応じて安定な化学種として水中に溶存できる。しかし、地殻中の濃度から考えて、海水中の濃度は極めて低い。これは、F–およびPO43-(現在の海洋環境で安定な化学種)が各種の金属イオンと難溶解性の塩を形成するからであろう。
目次へ
2.3 Birth of the ocean and transition of constituent elements
The planet where we live, the earth, was created about 4.6 billion years ago. The raw materials were rocks and metals contained in planetesimals. By repeating collisions and coalescence of planetesimals, the earth has created its current shape and size. The smaller ones were absorbed by the larger ones, gradually becoming one planet. The primitive earth, the origin of the earth, was born in this way. When the radius of the primordial earth became about 20% of the present earth, about 1500 km, degassing began to occur due to the collision of asteroids. By degassing, gas components such as carbon dioxide, water, and nitrogen contained in the gas were released and covered the primordial earth. The birth of the primitive atmosphere. It is thought that the primitive atmosphere was composed mainly of water vapor and contained carbon dioxide, nitrogen, and carbon monoxide. On a newborn earth 4.6 billion years ago, rock-melted magma seas covered the surface. Also, a primitive atmosphere made of gases such as water vapor, carbon dioxide, and nitrogen covered the sky. [Birth of the earth]
About 4.3 billion years ago, the temperature of the earth suddenly dropped, and the water vapor contained in the primitive atmosphere became rain and began to fall on the ground. It is believed that the rain chilled the surface of the earth, and when the surface cooled, the primordial atmosphere cooled, causing more rain, and the annual rainfall was over 10 meters. This heavy rain lasted for nearly 1,000 years, creating a primitive sea that is the basis of the present sea. The primitive sea seemed not to be a habitat for living things because it was acidic at first because hydrochloric acid dissolved in the rain also flowed into it. After that, the acidic seawater melted calcium, iron, and sodium, which are the components of the rocks and soil on the surface of the earth, to become the neutral seawater as it is today. [Japan Maritime Public Relations Association]
High concentrations of Al3+ and Ti4+ as the acidic seawater became neutral, these metal ion precipitated as hydroxides such as Al(OH)3 and Ti(OH)4 and became the present low concentration.
3.2 billion years ago, photosynthetic organisms appeared and began to convert carbon dioxide into oxygen. When oxygen in seawater increased, Fe2+ was oxidized to Fe3+, Mn2+ was oxidized to Mn4+, and Fe(OH)3 and MnO2 were precipitated. Oxygen has been supplied to the atmosphere 2 billion years ago, when the concentrations of iron and manganese decreased and oxygen was no longer consumed in seawater. [Wikipedia]
When oxygen in the atmosphere increases and ultraviolet rays from the sun decrease, the environment where living things inhabit the surface of the earth is adjusted, and the consumption of carbon dioxide and the production of oxygen are in equilibrium and become the present atmosphere. However, carbon dioxide is gradually increasing due to the recent large consumption of fossil fuels.
;As mentioned above, in the era when the ocean was born, there was a considerable correlation between the crust and seawater components, but from acidity to neutrality due to elution from the surface by alkali metals and alkaline earth metals, also, due to the birth of photosynthetic organisms and the change in redox potential of seawater to the positive side due to the production of oxygen, it became a constituent component of the ocean that is different from the tendency of crustal components, as is clearly seen in poly-valent metal elements.
By the way, the unique elements are fluorine and phosphorus. Fluorine, which is a halogen element, is stable as F– . Phosphorus can be dissolved in water as a stable chemical species with a valence of V, Ⅲ,Ⅰ, and -Ⅲ depending on the redox potential of the environment. However, the concentration in seawater is extremely low considering the concentration in the crust. This may be because F– and PO43- (a stable species in today’s marine environment) form sparingly soluble salts with various metal ions.
To table of contents
3.人体の構成元素
3.1 人体の構成元素
ヒトの体は構成する基本的な有機分子をはじめ、全ての元素から成り立っている。生命の起源以来、生命体は進化の過程で、宇宙や地球に依存するあるゆる元素を取り込み、利用してきた。
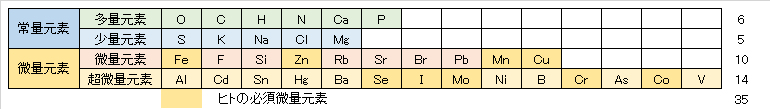
この中で、アミノ酸、タンパク質、核酸、脂肪、糖など体を構成する基本的な有機分子に利用されている元素は、酸素O、炭素C、水素H、窒素N、カルシウムCa、リンPの6種類である。これらの元素は体内濃度がそれぞれ体重1kgあたり10g以上を占め、多量元素と呼ばれ、人体中の存在量は98.5%を占める。これらのうち、O、C、H、Nは共有結合をしやすく、体の構成に必要な主要元素である。Caは骨の成分として、Pは核酸のリン酸結合やエネルギーの代謝に必要な元素である。
次に、多い元素は硫黄S、カリウムK、ナトリウムNa、塩素Cl、マグネシウムMgであり、いずれも体重1kgあたり1.0~2.5gを占め、少量元素と呼ばれる。Sは含硫アミノ酸を構成する元素であり、K、Na、Cl、Mgはイオン化しやすく細胞の浸透圧の維持と調節、膜電位の決定にも関与しており、Caとともに膜情報伝達系においても重要な役割を演じている。S以外は電解質元素でもある。多量元素と少量元素を合わせた11元素を常量元素と呼び、これらを合計すると人体中の体内存在量は99.3%を占めることになる。
上記の11元素だけでは生命ならびに健康を維持することはできない。残りの0.7%には微量であるが、生命機能を維持するうえで重要な元素である。これらは、鉄Fe、フッ素F、ケイ素Si、亜鉛Zn、ストロンチウムSr、ルビジウムRb、臭素Br、鉛Pb、マンガンMn、銅Cuの10元素は1~100mg/kgで存在しており、微量元素と呼ばれる。
さらに、1mg/kg以下のものは超微量元素と呼ばれ、アルミニウムAl、カドミウムCd、スズSn、バリウムBa、水銀Hg、セレンSe、ヨウ素I、モリブデンMo、ニッケルNi、ホウ素B、クロムCr、砒素As、コバルトCo、バナジウムVの14種がある。
24種の微量・超微量元素のうち、ヒトにとって必須元素として認められているものはFe、Zn、Mn、Cu、Se、I、Mo、Cr、Coの9元素である。
ヒトにおける必須元素は多量元素、少量元素、微量元素を合わせるとと20元素となり、生命の維持、発育・成長、正常な生理機能には不可欠な元素である。[荒川, 2016]
目次へ
3. Constituent elements of human body
3.1 Elements of the human body
The human body consists of all the elements, including the basic organic molecules that make up it. Since the origin of life, life forms have taken in and utilized certain elements depending on the universe and the earth in the process of evolution.
Among these, the elements utilized in the basic organic molecules that make up the body, such as amino acids, proteins, nucleic acids, fats, sugars, are oxygen O, carbon C, hydrogen H, nitrogen N, calcium Ca, and phosphorus P. The concentration of these elements in the body accounts for 10 g or more per 1 kg of body weight, and they are called major elements, and their abundance in the human body accounts for 98.5%. Of these, O, C, H, and N are the main elements necessary for body constitution because they easily form covalent bonds. Ca is a bone component, and P is an element necessary for phosphate binding of nucleic acids and energy metabolism.
Next, the most abundant elements are sulfur S, potassium K, sodium Na, chlorine Cl, and magnesium Mg, all of which occupy 1.0 to 2.5 g per 1 kg of body weight and are called minor elements. S is an element that constitutes sulfur-containing amino acids, and K, Na, Cl, and Mg are easily ionized and are involved in maintaining and controlling the osmotic pressure of cells and determining the membrane potential. These elements plays important roles. Other than S are also electrolyte elements. Eleven elements, which are a combination of major elements and minor elements, are called ordinary elements, and the total amount of these elements in the human body accounts for 99.3%.
Life and health cannot be maintained with the above 11 elements alone. The remaining 0.7% is a trace amount, but it is an important element for maintaining vital functions. These are 10 elements of iron Fe, fluorine F, silicon Si, zinc Zn, strontium Sr, rubidium Rb, bromine Br, lead Pb, manganese Mn, and copper Cu, present at 1 to 100 mg / kg, are called trace elements .
Furthermore, those of 1 mg/kg or less are called ultra-trace elements, and there are 14 kinds of elements, aluminum Al, cadmium Cd, tin Sn, barium Ba, mercury Hg, selenium Se, iodine I, molybdenum Mo, nickel Ni, boron B, chromium Cr, arsenic As, cobalt Co and vanadium V.
Of the 24 trace and ultra-trace elements, the nine elements recognized as essential for humans are Fe, Zn, Mn, Cu, Se, I, Mo, Cr and Co.
The essential elements in humans are a total of 20 elements, including major elements, minor elements, and trace elements, which are essential elements for life maintenance, growth, and normal physiological functions. [Arakawa, 2016]
To table of contents
3.2 人体と海水との比較
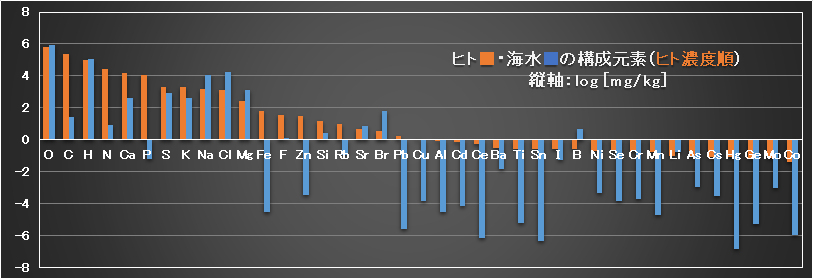
生体の多量元素のうち、OとHは海水とほぼ同じレベルにある。CとNは海水より高いレベルであるが、光合成や窒素固定によって水・空気から取得して植物が生育し、これを動物が摂取している。骨・歯や血液・筋肉・神経などの成分であるCaは海水より高いレベルである。Pは海水中のレベルに比べて、生体中の含有量が極めて高く、濃縮率は105レベルとなっている特異な元素である。
少量元素のうち、海水よりも生体においてS、Kは高く、Na、Cl、Mgは低くなっている。海水魚では多量の海水を取り込み塩分NaClの濃い尿を少量排出して、NaCl濃度を体液<海水に保っている。人体での塩分の取り過ぎは、高血圧の大きな要因となっている。
微量元素の中で、生体へのFeの濃縮率は106で際立っており、Znは105でPと同レベルである。
超微量元素についても、生体中の濃度は、海水中の濃度よりもかなり高いレベルにあることが分かる。超微量元素については、未だに生体内の機能が不明な元素もあり、今後の研究の進展が期待されている。
家庭で広く利用される食品成分表には無機質欄にNa、K、Ca、Mg、P、Fe、Zn、Cu、Mnなどの成分量が記されている。生体および海水を構成する元素濃度を比較して見ると、その意味がよく理解できる。
必須元素と非必須元素
必須元素とは、それが欠乏すると欠乏症状が現れ、長く続くと死に至るものである。元素によって至適領域が大きく異なり、狭いものや広いものがある。具体例として、Seは必須元素であるが、至適範囲が非常に狭い。アメリカではセレンダブレットがスーパーマーケットに販売されており、多量のセレンを飲んで、脱毛や爪の脱落などの症例がある。中国では土壌中セレン濃度の高い地域や低い地域があり、欠乏症や過剰症の両方が報告されている。ヒトの必須元素の機能と疾患の概要については、文献 [荒川, 2016] を参照されたい。
非必須元素とは、欠乏しても生命に異常はないが、多すぎると中毒を起こしさらには死に至るものである。
目次へ
3.2 Comparison between human body and seawater
Of the major elements in living organisms , O and H are at almost the same level as seawater. Although C and N have higher levels than seawater, they are taken from water and air by photosynthesis and nitrogen fixation to grow plants, which are ingested by animals. Ca, which is a component of bones, teeth, blood, muscles, and nerves, has a higher level than seawater. P is a unique element whose content in living organisms is much higher than that in seawater and the concentration rate is 105 levels .
Among the minor elements , S and K are higher and Na, Cl and Mg are lower in living organisms than in seawater. Saltwater fish takes in a large amount of seawater and discharges a small amount of urine with a high concentration of NaCl, keeping the NaCl concentration in the body fluid.
Among the trace elements , the concentration rate of Fe in living organisms is outstanding at 106 and Zn is 105 which is the same level as P. It can be seen that the concentration in the living body of ultra-trace elements is considerably higher than that in seawater.
As for ultra-trace elements, there are some elements whose functions in the body are still unknown, and future progress in research is expected. In the table of food ingredients widely used at home, the amounts of ingredients such as Na, K, Ca, Mg, P, Fe, Zn, Cu and Mn are listed in the column of minerals. Comparing the concentrations of the elements that make up living organisms and seawater, the meaning is well understood.
Essential element and non-essential element
A required element is one that causes deficiency symptoms when it is deficient and causes death when it lasts for a long time. The optimum region varies greatly depending on the element, and there are narrow and wide regions. As a specific example, Se is an essential element, but the optimum range is very narrow. In the United States, selenium tablets are sold in supermarkets, and there are cases of drinking a large amount of selenium and causing hair loss or nail loss. In China, there are areas with high and low selenium concentrations in soil, and both deficiency and excess disease have been reported. See the literature [Arakawa, 2016] for an overview of the functions and diseases of human essential elements.
The non-essential elements are not abnormal in life even if they are deficient, but if they are too much, they cause poisoning and even death.
To table of contents
Fig.3 Elements of the human body and seawater [Human body: Wikipedia, 2016, URL ]
文献からの引用値が異なるので、含有量(濃度)に関して本文と図表との記載値が異なる元素がある。この理由は、測定技術の進歩にもかかわらず微量元素の定量は容易ではなく、特に海水・地殻・土壌・生体の微量元素の定量においては、複雑な前処理での不可避な作業環境から(へ)の混入・消失や共存する物質の干渉作用が著しく、年々、様々な機関や研究者によって測定値が更新されているからである。詳しくは、ICP発光分析・ICP質量分析などを参照されたい。
なお、地表水(河川・湖沼)や地下水などの元素構成は、その背景(土壌・地殻・環境汚染)による地域差の変動が大きいので留意されたい。また、Feの海水中の溶存値であるが、表層での約3ng/kgから減少し、水深1,000mで約40ng/kgと最大となり、それ以深では微減しているとの報告[Achterberg, et al., 2001]もある。これは、上記の海水のpHで述べたように、pHとFe3+の溶解度の関係で説明できる。
目次へ
Since the values quoted from the literature are different, some elements may differ in the content (concentration) between the text and figures. The reason for this is that quantification of trace elements is not easy in spite of advances in measurement technology. Because the unavoidable mixture and disappearance into and from the samples happen during work of the complicated analytical processing and the interference actions of the coexisting materials are remarkable, the measured values have been updated by various institutions and researchers year by year. For details, refer to ICP emission analysis / ICP mass spectrometry.
It should be noted that the elemental composition of surface water (rivers and lakes) and groundwater varies greatly depending on the background (soil, crust, environmental pollution). Also, it is reported that the dissolved value of Fe in seawater decreases from about 3 ng/kg in the surface layer, reaches a maximum of about 40 ng/kg at a water depth of 1,000 m, and decreases slightly below that [Achterberg, et al., 2001]. This can be explained by the relationship between pH and the solubility of Fe3+ , as described above for seawater pH.
To table of contents
参考文献
1) Achterberg, E.P, et.al: Analytica Chimica, Vol.442, Issue 1, pp.1-14, 2001.
2) Barbalace, Kenneth: “Periodic Table of Elements”. Environmental Chemistry.com. Retrieved 2007-04-14.
3) 松井 義人・一国 雅巳(訳):一般地球化学、岩波書店、1970.
4) 重松 恒信:日本海水学会誌 Vol.32, No.3, pp.150-157, 1978.
5) 野崎 義行:日本海水学会誌 Vol.51, No.5, pp.302-308, 1997.
6) 小宮 剛:地学雑誌、Vol.116, No.1, pp.95-113, 2007.
7) 荒川 泰昭:日本臨床, Vo.74, No.7, pp.1058-1065, 2016.
References
1) Achterberg, E.P., et.al: Analytica Chimica, Vol.442, Issue 1, pp.1-14, 2001.
2) Barbalace, Kenneth: “Periodic Table of Elements”. Environmental Chemistry.com. Retrieved 2007-04-14.
3) Matsui, Y. , Ikuni, M. (Translated): General Geochemistry, Iwanami-Shoten, 1970 (in Japanese).
4) Shigematsu, T. : Bulletin of the Society of Sea Water Sceince, Japan, Vol.32, No.3, pp.150-157, 1978 (in Japanese).
5) Nozaki, Y. : Journal of the Japan Society for Sea Water Vol.51, No.5, pp.302-308, 1997 (in Japanese).
6) Komiya, T. : Journal of Geography, Vol.116, No.1, pp.95-113, 2007 (in Japanese).
7) Arakawa, Y. : Japanese Journal of Clinical Medicine, Vol.74, No.7, pp.1058-1065, 2016 (in Japanese).
