村上定瞭(水浄化フォーラム)
Ⅰ.コロイドと界面現象
1.コロイドとは
2.疎水・親水コロイド
3.疎水コロイドの分散と凝集
4.親水コロイドの塩析
5.会合コロイドとミセル
6.コロイド溶液の物性
Ⅱ.解説
解説(A) 粒子界面の静電気現象
解説(B) 疎水性2粒子系の相互作用
解説(C) 粒子界面電荷の発生
解説(D) 電解質効果とSchulze-Hardy法則
解説(E) 凝集速度
解説(F) 表面張力と界面活性
解説(G) 界面活性剤の特性
解説(H) 吸着エネルギーと平衡式
解説(J) 高分子吸着と分散・凝集
付録 疎水コロイド相互作用の計算ソフト
(ダウンロード)
参考文献
関連ページ
分散・懸濁粒子の凝集分離
Ⅱ.解説
解説(F) 表面張力と界面活性
1.表面張力の意義とその温度変化
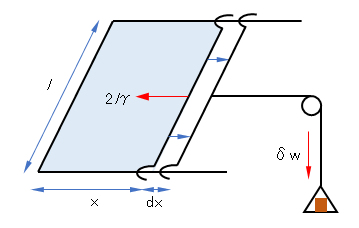
膜は表裏2枚ある。表面張力をγとする。表面の縮もうとする力2l γに抗して距離dXだけ動かす仕事δwは、
δw = 2l γdx (F.1)
である。Aを全膜面積とすると、A = 2l xだから、式(F.1)は
δw = γdA (F.1’)
となる。式(F.1’)を変形して
γ= δw/dA (F.2)
この式の右辺は単位面積当たりの仕事量である。仕事量は自由エネルギー変化であるから式(F.2)より
γ = dG/dA (F.3)
または、積分して、
式(F.3)より、表面張力は比表面自由エネルギーともいえる。表面を新しく作るときの余分の自由エネルギーが表面に蓄えられ、その表面を維持していることと理解できる。
液体(l:liquid)の表面張力は温度が上昇すると低下する。表面張力の温度変化は次のRamsey-Shieldsの式で表される。
γ(M/ρl )2/3 = k(Tc – T – 6) (F.5)
M、ρl:液体のモル質量、密度;M/ρl:モル体積、Tc:臨界温度(Kで表す);T:絶対温度;k:定数
上式で’6’は経験的に導入された数値である。片山正夫は次式のように、気体(g:gas)の密度ρgの導入により’6’を不要にした。
γ[M/(ρl – ρg)]2/3 = k(Tc – T) (F.6)
図F.1 表面張力のモデル実験
2.表面張力の測定
2.1 リング法
f = 4πrγβ (F.7)
r:リング半径、β:補正係数
2.2 吊板法
f = mg + 2γ(l + d) (F.8)
ここでは板に対する液の接触角を’0’としている。この方法によると、正しい静的表面張力が求められる。
2.3 液重法、液容法、滴数法
2πrγ = mgφ = Vρgφ (F.9)
ここで、r は先端部の外側の半径,ρは液体の密度、φは補正係数で文献から求められ
る。滴数法では、表面張力既知(γoとする)の液体と、未知(γとする)の液体についで、滴数 no、nを測定すると、滴数は1滴の体積に反比例するので、式(F.9)から、
γ/γo = ρno/(noρ) (F.9′)
の関係が得られる。この装置は簡便・廉価であり、注意深く実験すればかなり正確な値が得られる。
3.曲面の表面張力に関する現象
3.1 曲面の全圧
ΔP = 2γ/r (F.10)
γ:液体の表面張力
これをYoung-Laplaceの式という。
<説明>
式(F.10)を理解するには,液面を凹に保っておくために、外から余分の圧を加えておく必要があると考えればよい。ΔPは毛管中を液が上昇する駆動力であり(ただし、液が壁をぬらす場合)、泡の液膜中で液がプラトー領域へ流れる駆動力でもある。2枚の板の問にこれをぬらす液があると板は互いに引きっけられる。このΔPは一般に毛管力または毛管圧といわれる。
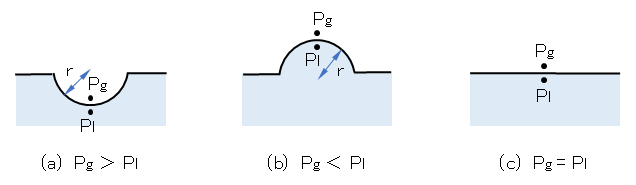
図F.4 曲面における気相・液相の全圧(Pg、Pl )の違い
液面:(a) 凹面(r>0)、(b) 凸面(r<0)、(c) 平面
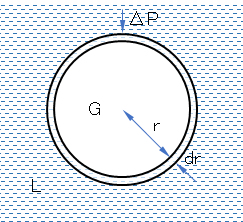
図F.5 図F.4(a)に対応する凹状液面のモデル図
4.界面張力と表面張力の関係
γow = γo + γw – 2(dγo・dγw)1/2 (F.14)
ここで、前下付きdは分散力成分であることを示す。無極性の油では分散力しか作用していないのでdγo = γoである。
<説明>
γ = dγw + hγw (F.15)
水銀のような金属では、分散力と金属結合 mに分けて,
γHg = dγHg + mγHg (F.16)
と仮定する。2種の分子間の相互作用力は分散力の幾何平均、すなわち、(dγo・dγw)1/2で表されると仮定する。図F.7において、油の分子に働く力は油どうしの凝集力(表面張力)と、油と水との相互作用力であり、前者は界面張力に対してプラスに、後者は界面張力を減らす方向に働く。水分子に対しても同様に考えられるので、全体として界面張力γowは式(F.14)となる。
γow、γo、γwの実測から式(F.14)を用いてdγwが求められる。Fowkesは種々の脂肪族炭化水素と水の界面張力データから、dγwを得て、式(F.15)からhγwを得ている。すなわち、
dγw = 22 [mN/m]
したがって、
hγw = 50 [mN/m]
また、水・水銀の組み合わせから、dγHg、mγHgが得られた。このようにして、多くの液体の衣面張力の各成分が得られる。
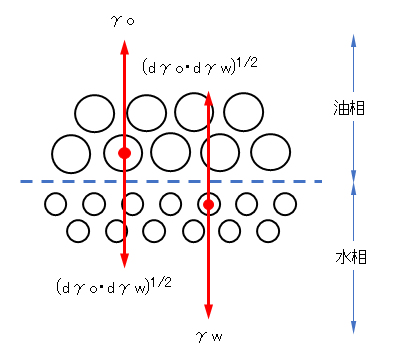
図F.7 油・水の界面の分子に働く力 [Fowkes, 1964]
大きい○:油分子、小さい○:水分子
5.溶液の表面張力
溶質の種類により表面張力の濃度変化を2大別することができる.濃度が増すと、水溶液の表面張力が減少する場合[図F.8(a)(b)]とわずか増加する場合[図F.8(c)]とである.前者は溶質が有機化合物の場合に、後者は無機塩の場合に現れる。前者のように、濃度増加によって表面張力が低下する現象を界面活性といい、この場合の溶質を界面活性物質という。前者の内、曲線(a)のように、表面張力の低下が特に顕著で,γ-c 曲線に折れ曲がりが生じるような溶質を界面活性剤という。界面活性物質には分子中に、親水基と疎水(親油)基とが含まれており、これらを広く、両親媒性物質ともいう。表面張力が低下するのは溶質が表面に吸着するためであり、吸着と表面張力の変化とを理論的に結び付けているのがギブスの吸着式である。
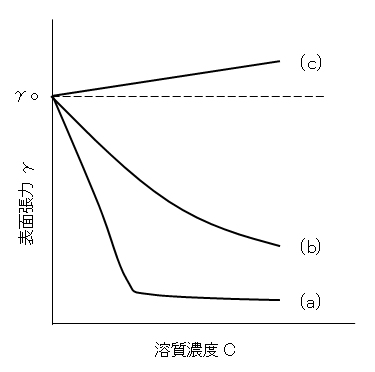
図F.8 水溶液の表面張力と溶質濃度との関係の模式図
6.ギブスの吸着式
Γ = – c/(RT)・dγ/dc (F.17)
ここで、Γ は界面と内部の濃度差を表す量で、界面過剰濃度といわれる。低濃度のときは近似的に吸着量としてよい。cは溶質濃度であるが、厳密には活量を用いなければならない。
<説明>
dσG = – σSdT + σVdP + μ1dσn1 + μ2dσn2 + γdA (F.18)
前下付きのσは界面相の量であることを表す。最後の項は式(F.3)からくる界面特有の量である。T、P 一定の場合は
dσG = μ1dσn1 + μ2dσn2 + γdA (F.19)
μ1、μ2、γを一定で積分すると、
σG = μ1・σn1 + μ2・σn2 + γA (F.20)
この式を全微分し、式(F.19)と辺辺引くと、
σn1・dμ1 + σn2・dμ2 + Adγ = 0 (F.21)
または
(σn1/A)dμ1 + (σn2/A)dμ2 + dγ = 0 (F.21′)
σn1/A = Γ1、σn2/A = Γ2を界面過剰濃度という。成分1を溶媒とするとき、溶媒の界面過剰量σn2が’0’になるようAA面を選ぶことができる。そのときの溶質の界面過剰濃度は一義的に決まる。これを単にΓと書くことにする。そうすると、式(F.21′)は
Γ = – dγ/dμ2 (F.22)
となる。
dμ2 = RT・dln a (F.23)
a:溶質の活量
であるから、
Γ = – 1/(RT)・dγ/dln a = – a/(RT)・dγ/da (F.24)
希薄溶液では a≒cであるから式(F.17)が得られる。
図F.8と式(F.17)を関連づける。図F.8-(a)・(b)ではdγ/dc<0であるから、式より Γ>0、すなわち、溶質は界面で過剰になっており、吸着が起きているのである。図F.8-(c)では、dγ/dc>0であるから、Γ<0、すなわち、負吸着が起きている。無機塩は水中で電離し、イオンは水和して内部へと引き込まれるので、表面で不足する。
極性有機化合物はその疎水基が水から離れようとして表面へ出てきて、表面に濃縮される。dγ/dcのこう配を求めるとΓが得られる。その単位はmol/m2である。界面活性剤の場合、屈曲点で表面吸着は満員になり、内部でミセルの形成か始まる(図F.10)。屈曲点はミセル形成の臨界濃度(cmc)である。cmc以上では表面張力はほぽ一定である。ここにGibbsの式(F.17)を形式的に当てはめると、吸着量はほぼ ‘0’になってしまう。脱着(吸着しているものが外れること)が起きているようにみえる。このことはcmc以上ではモル濃度 c の代わりに活量 aを用いることに留意すること、aが濃度で変わることを示唆している。
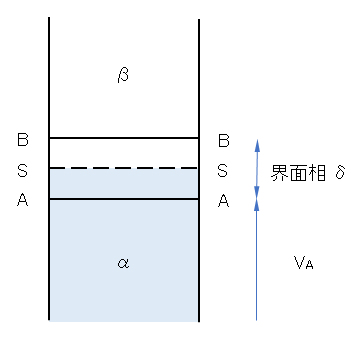
図F.9 α相とβ相との界面のモデル図
領域AABBが界面相、本文ではβ相は空気として無視している
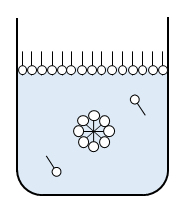
図F.10 界面活性剤水溶液のcmcにおける模式図
目次へ
解説(G) 界面活性剤の特性
凝集・沈殿プロセスにおいて、界面活性剤の一つである高分子凝集剤が広く用いられているが、種類も多種多様で、その選定や添加量が適正に行われないと、全く効果が得られないことや逆効果となることもある。ここでは、高分子凝集剤の利用にあたって、基本的に必要な界面活性剤の特性について記載する。本ページには、水浄化に関係が薄い内容も含まれているが、界面活性剤を理解する上で重要なものと考えている。
ところで、われわれはさまざまな表面・界面とともに生活している。自然界では、水の表面・葉の表面・水と土の界面、また身体の表面などがすぐ思いつく。生活面・産業面も数限りない表面や界面を作り出して、それを利用したり、それに悩まされたりしている。界面活性剤は表面や界面を改質・変成させる性質を持っている。
ミセルについては、Ⅰ-5.会合コロイドとミセルで簡単に記載した。ミセルという語は、以前には、セルロースやデンプン分子の作る集合構造のうち、微結晶部分をいうのに用いられていたが、1920年代以降は界面活性剤の分子またはイオンの集合体を指すことが多い。界面活性剤が溶液中でミセルを作ると言いだしたのは,1913年、McBainらが初めである。彼らはセッケン水溶液中の分子量の測定から、セッケン分子が会合していることに気づいた。ミセルの形については、1930年代、Hartleyの球状ミセルとHessの層状ミセルとの論争があった。戦後、前者が認知されたが、今では、濃厚溶液の作る液晶中で、後者がリバイバルしている。
なお、本ページの内容は、文献[北原、1994]から多くを引用している。不明な事項については、本著を参考にされたい。
1.界面活性剤の定義・構造・分類
この定義には表面張力低下という表現はないが、上記(3)から、ギブスの吸着式[式(F.17)]を使って導くことができる。上記4項目のほかに、ミセルを形成する機能があるが、これも(1)から導かれる。
以上の定義から界面活性剤の構造の概略が浮かび上がってくる。界面活性剤の構成のポイントは親水基と疎水基とを持つことであるが、溶媒が水の場合、表面に吸着するためには、ある程度の長さの疎水基が必要であり、それを水溶性にするために、それに見合った親水性の強い親水基を必要とする。
疎水基を直鎖炭化水素とすると、炭素数にして10~18程度のものが使われ、それにバランスした親水基としてイオン性基、COO–、-SO4–、-SO3–、-NH3+などが必要となる。
-OH、-NH、-COOHなどでは親水性が不十分である。この親水・疎水のバランスを示すよい例は、酸化エチレン基-(CH2CH2O)x-を親水基とする非イオン界面活性剤で、炭化水素基の炭素数と酸化エチレン基の数とを変えることにより、親水・疎水のバランスを連続的に変え、水溶性界面活性剤や油溶性界面活性剤を作り出すことができる。本稿では、界面活性剤のスキームとして、図G.1のような簡略図を使う。
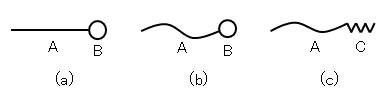
図G.1 界面活性剤の模式図
A:疎水基、B:親水基、C:酸化エチレン基
(1) 解離基による分類:最も一般的に行われている分類である。
a. イオン界面活性剤(アニオン界面活性剤)
b. イオン界而活性剤(カチオン界面活性剤)
c. 非イオン界而活性剤(ノニオン界而活性剤)
d. 両性界面活性剤
(2) 疎水基の分岐度による分類:分子の形状を表している。
a. 直鎖型界面活性剤
b. 二鎖型界面活性剤
(3) 溶解性による分類
a. 水溶性界面活性剤
b. 油溶性界面活性剤(非水系界面活性剤)
(4) 分子量による分類
a. 低分子界面活性剤
b. 高分子界面活性剤
c. 重合性界面活性剤
(始め低分子型であるが、吸着などさせた後、重合させ高分子型とするもの)
(5) 疎水基の種類による分類
a. 炭化水素系界而活性剤
b. 炭化フッ素系界面活性剤
(6) 特殊な界面活性剤
a. 機能性界面活性剤
例.クラウンエーテル誘導体、シクロデキストリン誘導体
b. 自然指向型界面活性剤
例.ショ糖脂肪酸エステル(モノ:水溶性;ジ、トリ:油溶性)、モノグリセリド、アルキルグルコシド、アミノ酸誘導体
c. 生体内界面活性剤
例.レシチン(一般的にリン脂質)、胆汁酸の塩、肺内界面活性物質
その他,次の実用的見」也からの分類がある。
(7) 用途による分類
起泡剤:家庭用界面活性剤、繊維用界面活性剤
消泡剤:衣料用洗剤、乳化重合用界面活性剤
乳化剤:台所用洗剤、セメント用界面活性剤
分散剤:トイレタリー洗剤、食品工業用界面活性剤
湿潤剤:身体洗浄剤、農薬用界面活性剤
可溶化剤:化粧品用界面活性剤、その他
2.界面活性剤の2大物性
2.1 界面吸着能
界面活性剤の水溶液表面への吸着は泡の生成を容易にし、水・油界面への吸着はエマルジョンの生成を助け、液体・固体の界面への吸着は微粒子分散系の安定性に寄与する(図G.2)。これらは表面張力・界面張力の低下によるものである。
油(無極性溶媒)中に溶解している界面活性剤の場合、油自身の表面張力がすでに低いので、界面活性剤は油溶液表面へ吸着することはない。しかし、水酸基は、油と水の界面、油と親水性固体の界面において自由エネルギーが低く熱力学的に安定であるため、界面活性剤はこれらの界面へ吸着する。
アルコール・アセトンなどの極性溶媒に溶解している界面活性剤は、親水基・疎水基ともに溶媒と親和性があり、表面へも界面へも移る傾向を持たないので、吸着はどの場合も起こりにくい。
2.2 ミセル形成能
油溶性界面活性剤も油中で、親水基を内側にし、疎水基(親油基)を外側に向けた集合体を作る[図F.3(b)]。これを逆ミセルという。逆ミセル形成には微量の水が必要であるといわれている。しかし、この確証は得られていない。
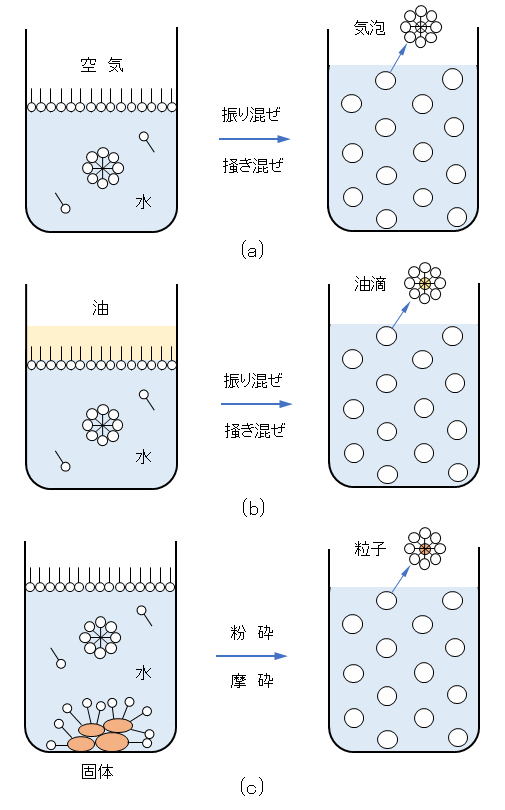
図G.2 界面活性剤の機能の模式図
(a) 泡立て、(b) 油の乳化、(c) 固体粒子の分散
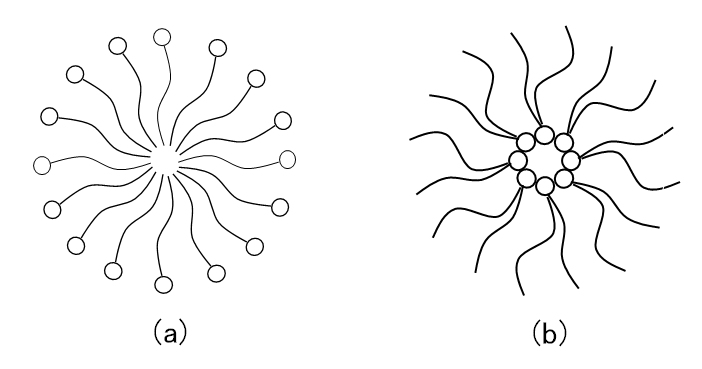
図G.3 (a)ミセル、(b)逆ミセルの模式図
逆ミセルを作るものは二重鎖型が多い
3.クラフト点と曇り点
3.1 クラフト点
クラフト点は、表G.1に示すように、界面活性剤の疎水基の炭素数が長くなるほど高くなり、枝分かれがあって結晶性が悪くなると低くなる。

イオン性界面活性剤は、クラフト点以下では溶解度が低くミセルを作らないので、界面活性剤としての性質を示さない点に注意が必要である。
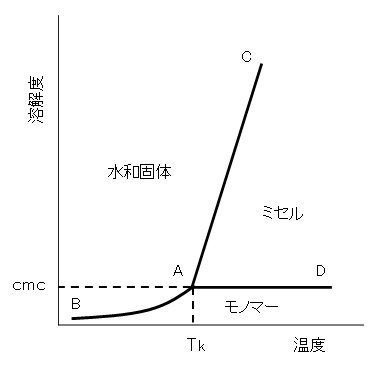
図G.4 イオン性界面活性剤の水への溶解度を示す模式図
Tk:クラフト点
3.2 曇り点
曇り点は非イオン界面活性剤の水溶性、または油溶性を表す1つの尺度であり、曇り点の高いものほど水溶性が大きい。したがって、他の水溶性・油溶性を表す尺度、たとえば、HLB(親水性と親油性バランス)とよい相間関係がある。曇り点は界面活性剤の疎水基の炭素数が増すと低下し、上記の酸化エチレン基数xが増すにつれて上昇する。界面活性剤濃度が 1%前後では、濃度により曇り点はほとんど変わらない。
<HLB概念とHLB値>
水と油(水難性の有機溶媒の総称とする)を掻き混ぜるとエマルジョンが生成するが、不安定であってすぐ元の水と油に分離する。エマルジョンを寿命を延ばす(安定化する)ためには界面活性剤などを共存させねばならない。この安定化のための第三者を乳化剤という。乳化剤としては主に界面活性剤が使われるが、高分子物質、時には微粉末も用いられる。
生成するエマルジョンには、O/W(oil in water)型とW/O(water in oil)型とがあるが、これを決めるのは主として乳化剤の種類による。エマルジョンを作るため、乳化剤を選ぶ基準の最も有名なのはHLBである。
乳化剤の役割は、油・水界面に吸着して、油・水界面張力を低下させてエマルジョンが生成しやすくすることと、安定な界面膜を作り、エマルジョンを安定化することである。このためには界面活性剤の親水性、親油性が対象とする水・油に良好な親和性を持つことが必要である。これがHydrophile-Lypophile Blance(親水・親油バランス、HLB)の概念である。乳化剤として用いられる界面活性剤は、ほとんど非イオン界面活性剤である。非イオン界面活性剤はその構造からして、親水性・親油性を広い範囲で変えられるという利点があり、それぞれの界面活性剤にHLB値が与えられている。これを単にHLBといっている。HLBが大きいほど親水性が大きく、小さいほど親油性が大きいように数値が決められている。HLBを決める方法はいくつかある。
油には実験的に所要HLBという値が決められている。ある油でO/W型エマルジョンを作りたいという場合、その油の所要HLBに等しいHLBを持つ界面活性剤を用いて乳化すると、安定性のよいエマルジョンが得られる。W/Oの場合は所要HLBはあまり決められていない。
4.ミセル形成とcmc
4.1 実験的アプローチ
cmc以上でミセルという集合体が形成されていくことは、いくつかの実験で実証することができる。静的光散乱実験から得られる濁り度のデータの解析により、分子量が得られる。この値はcmc以上では界面活性剤分子(モノマー)の数十倍の値となる。また、適切な半透膜を用いて溶液の浸透圧を測定できるが、それから得られる分子量もcmc以上ではモノマーの数十倍となる。蒸気圧降下法の原理に基づく蒸気圧オスモメーターによると、数万までの分子量を測定できるが、これによっても、ミセルの会合数(測定分子量をモノマー分子量で割った値)が数十であることが確かめられる。
cmcはイオン性、非イオン性を問わず、界面活性剤の水溶液の重要な物性値であるが、次のような条件により影響を受ける。
(a) cmcは測定法によりわずかに違う。
(b) cmcは温度によって変化する。特に、非イオン界面活性剤の場合著しい。
(c) 非イオン界面活性剤のほうがイオン性界面活性剤に比べてcmcははるかに低い。
ミセルの形成を妨げるイオン問の反発と水和層間の反発とを比べると、前者のほうが大きいので、イオン性界面活性剤のほうがミセルが生成しにくく、cmcが高くなる。
(d) cmcは疎水基が直鎖アルキル基の場合、その炭素数Nとの関係は、次式で示される。
log cmc = A – BN (4.1)
A、B:定数
イオン性界面活性剤の場合、B ≒ 0.30、すなわち、CH2が1個増すごとにcmcは約1/2減少する。非イオン界面活性剤では、B ≒ 0.48である。
炭化水素基が長くなるに従い、水への溶けにくさが増す。すなわち、水から逃れる傾向が強くなる。したがって、より低濃度で集合するようになり、cmcが低下する。
(e) イオン性界而活性剤の場合、無機塩を添加するとcmcは低下する。その関係は、次式で示される。
log cmc = a – b log c (4.2)
a、b:定数、c:全イオン濃度、c = cs + cmc(csは塩濃度)
イオン性界面活性剤のミセル形成を妨げる力はイオン間の反発である。無機塩を加えると、塩から解離したイオンの中の界面活性剤と反対のイオン(対イオンという)が、界面活性剤イオンの周りに集まって電荷を中和する。そのため、界面活性剤イオン間の反発が減少し、ミセルの形成が促進され、cmcが低下する。
(f) 高級アルコールを少量添加すると、イオン性界面活性剤のcmcはその濃度とともにほぽ直線的に低下する。
高級アルコールは水に難溶性で、図G.6のように、ミセルの周辺部に取り込まれる。ミセルに取り込まれることを可溶化という(G.7 可溶化とマイクロエマルジョン、参照)。アルコール分子が界面活性剤のイオン間にくさびのように入り込むため、イオン間の反発力が弱まる。そのため、ミセルは形成しやすくなり、cmcは低下する。
以上述べた現象は、次項の「ミセル形成の理論」で定性的に説明する。cmc値の数例を表G.2にあげた。
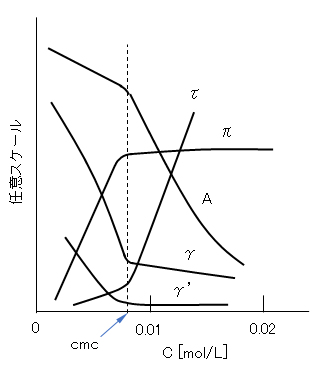
図G.5 ドデシル硫酸ナトリウム水溶液の物性の濃度変化(25℃)
A:モル導電率、π:浸透圧、γ:表面張力、γ’:油との界面張力、τ:濁り度
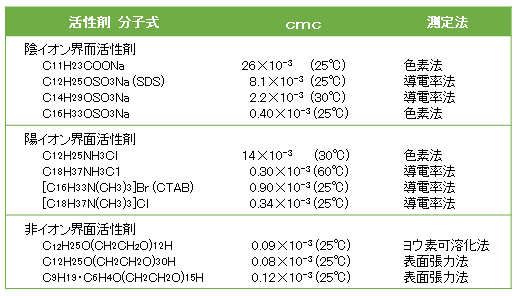
注)非イオン界面活性剤のcmcは溢度で著しく変化する。cmcを求める方法によりcmcはいくぶん変わることがある。
図G.6 陰イオン界面活性剤への高級アルコールの可溶化の模式図
4.2 理論的アプローチ
界面活性剤の疎水基は水中から逃れようとする。界而活性剤の濃度が増すにつれて、水溶液表面への吸着量が増す。表面吸着が飽和すると、界面活性剤分子の疎水基どうしが寄り集まるようになる。親水基は水側に向くほうが安定であるので、図G.3(a)のような集合体ができる。cmcをあまり超えないかぎり、集合体の大きさがほぽ一定に保たれるのは、イオン性界面活性剤の場合は、親水基のイオン間の反発が働くからであり、非イオン界面活性剤の場合は、親水基の水和層間の反発が慟いているからである。
疎水基が水から逃れようとするのは、水の構造からみて、次のようなエントロピー的なものである。
炭化水素の周りの水は水素結合によって氷状の構造をとっている。炭化水素が寄り集まると、周りの水は開放されて自由になり、氷状の構造に比べて配置のエントロビーが増大する。すなわち、ミセル形成により水のエントロピーが増大し、これが系全体の自由エネルギーの減少に寄与している。
5.ミセルの形・大きさ
cmcからあまり離れていない低濃度(たとえば、cmcの10倍以内)で、塩の添加濃度が高くないときはミセルは球状である。しかし、界面活性剤の濃度をずっと増やすか、塩の添加濃度を増すと、ミセルの大きさが増加していき、球状を保持できなくなってソーセージ状または屈曲した棒状(虫状)を示すようになる。たとえば、セッケンの濃度を増していくと、棒状または層状のミセルが生成し、これらが配列して液晶を作ることは以前から知られていた。
臭化セチルトリメチルアンモニウム(CTAB)に臭化ナトリウムまたは臭化カリウムを加えていくと、CTABの濃度は高くなくても、無機塩濃度がある値以上になると、分子量(ミセル量)が急激に増大し始める。ミセル量が増大したところを電子顕微鏡で観察すると、虫状のミセルが見られる[Imae, et al.,1985, 1986, 1987]。ミセルが虫状になるためには、CTABのように、界面活性剤のイオン部分が大きいものがよい。さらに、CTABとサルチル酸ナトリウムをほぼ等モルずつ混合した水溶液では、ミセルがひも状に長く発達して、これが絡み合って水溶液は粘稠化し、ゲル化することもある。電子顕微鏡で見ると、長いひも状のミセルが観察される[Shikata, et al.,1989; Hoffmann, 1988]。
Israelachviliはミセルがどんな形態をとるかを界面活性剤分子の形、環境(添加塩濃度など)と関連づけた。彼の提案した臨界充填パラメータで上に述べた球状、虫状、びも状ミセルなどの形成を説明することができる。
Israelachviliらは図G.7の界面活性剤分子のスキームで示すように、親水基断面をao、炭化水素のとりうる最大長さをlc、炭化水素部の占める体積をvとし、v/aolc = p を臨界充填パラメータと名づけた。pの値によって、ミセルは種々の形をとる。すなわち、p<l/3、1/3<p<1/2、1/2<p<1、p≒1、p>1の場合、それぞれ球状、非球状、ベシクル、層状、逆ミセルを作るとした[Israelachvili et al., 1976, 1977]。ここで、aoは分子固有ではなく、塩の添加などで変化することに注意したい。
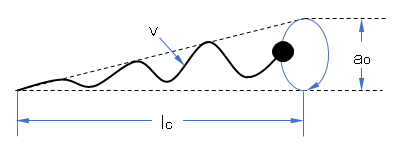
図G.7 界面活性剤分子の形状に関するパラメーター
6.逆ミセル
(a) 非イオン界面活性剤でHLBの低いもの、すなわち、酸化エチレン基数が少ないか、またはないもの。
(b) イオン性界面活性剤で結晶性の悪いもので、二鎖型の界面活性剤はこれに属す。
典型的な逆ミセル形成界面活性剤として、ジ-2-エチルヘキシルスルホコハク酸ナトリウムがある。
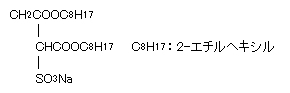
これはAerosol OTまたはAOTという商品名で知られている。AOTは水にもわずかに溶けて水中でもミセルを作る。生体内界面活性剤のレシチンも二鎖型の界面活性剤であり油溶性である。
AOTのベンゼンまたはシクロヘキサン溶液中で分子量を測定すると、10-3 mol/L以下の低濃度でないかぎり、集合体の形成が確認される。この集合体(逆ミセル)は周りが油であるから、図G.3(b)のような配向をしていると推定される。このことは、次項で述べるように、この溶液に水が可溶化されることから確認できる。逆ミセルには次のような特性がある。
(1) 水中ミセルに比べると、一般に会合数が小さい。たとえば、AOTの場合、ベンゼン中で約10、イソオクタン中で約20である。
(2) 会合数の小さいこともあり、cmcの存在が必ずしも明確ではない。
(3) 水または塩などの水溶液を可溶化する。
油溶性界面活性剤は極性溶媒(アルコール、アセトンなど)中では、よく溶けすぎて集合体を作らない。
7.可溶化とマイクロエマルジョン
7.1 定義と起因
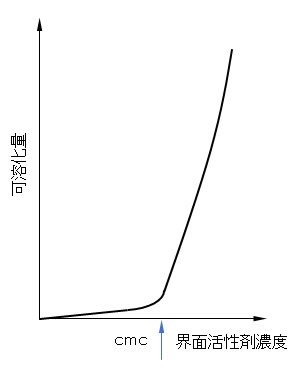
図G.8 界面活性剤濃度と難水溶性物質(油・染料)の可溶化量
可溶化量が増すとミセルは膨らんでいく。光の散乱能はミセルが膨らむと増大し、液は半透明になって乳光を発したり、やや濁って見えたりする。図G.9に水中のミセルの場合についてそのスキームを示した。この膨らんだ可溶化状態をマイクロエマルジョンという。水中ミセルの膨らんだ場合をO/Wマイクロエマルジョン、逆ミセルの膨らんだ場合をW/Oマイクロエマルジョンという。エマルジョンという名がついているが、熱力学的に不安定な通常のエマルジョンの仲間ではない。初めエマルジョン粒子の微細の場合という意味でこの名がっけられたが、現在は可溶化状態の膨らんだもので、熱力学的に安定な系の名前である。区別するために、通常のエマルジョンをマクロエマルジョンということがある。
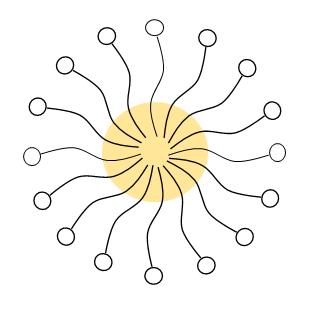
図G.9 O/Wマイクロエマルジョンの模式図
7.2 可溶化状態図
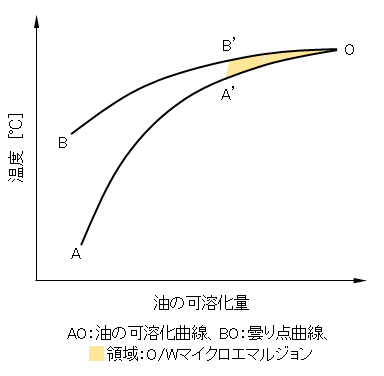
図G.10 可溶化状態図の一例
一定濃度の界面活性剤の水溶液に油を添加し、温度を変えて溶解する領域を調べる
7.3 可溶化の場所
7.4 可溶化量
7.5 コサーファクタントを用いたマイクロエマルジョン
たとえば、オクチル硫酸ナトリウム(SOS)2 g、ヘキサノール4 g、デカン47 g、食塩水溶液47 gの混合系をよく振って35℃で静置すると、食塩水溶液の濃度が9%のときは、図G.11-Aのように、混合系の油の約半分が油相として分離し、残りはO/Wマイクロエマルジョンとなる。このマイクロエマルジョンの中にSOSの大部分と残り約半分の油が含まれている。食塩濃度を16%にすると、図G.11-Bのように約40%の水分が水相として分離し、残りはW/Oマイクロエマルジョンとなり、この中には、SOSの大部分も含まれている[Ogono et al., 1989]。
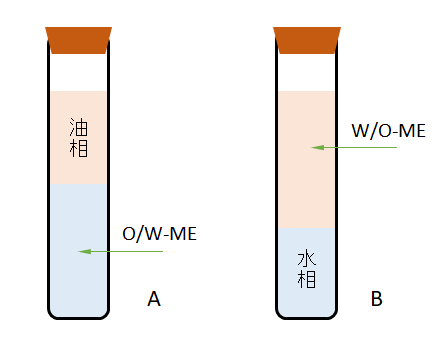
図G.11 オクチル硫酸ナトリム・ヘキサノール・デカン・食塩水系でのマイクロエマルジョン(ME)の生成
7.6 可溶化の応用
ミセル触媒の最初の研究は興味深いので少し触れておく。クリスタルバイオレットという色素は水に溶けて美しい紫色を呈するが、アルカリ性にすると退色して無色になる。この反応は次式にように考えられている。
この退色速度は陽イオン界面活性剤のミセルの存在下(たとえば、CTAB、0.01mol/L)では14倍速くなるが、陰イオン界面活性剤のミセルの存在下(たとえば、SDS、0.01mol/L)では1/17に低下する。この触媒作用の機構は以下のとおりである。色素のカルボニウムイオッはミセルの周辺部に可溶化する。CTABミセルは正の電荷を持っているので、OH–を引き寄せ、色素イオンとの反応を促進させる。SDSミセルは、反対に負の電荷を持ち、OH–を反発して反応を遅延させる[Dynstee,1959]。
O/Wマイクロエマルジョンは多量の油を安定に保持してくれる。地中に埋蔵されている石油はホップによるくみ出し(1次回収)、熱水注入による採取(2次回収)で取り出される分は埋蔵量の50~60%にすぎないといわれる。残りの岩石・砂などにしみこんでいる石油を界面活性剤と水を注入することにより、マイクロエマルジョンとして取り出そうというのが3次回収である。世界的に注目されている技術で、低廉な界面活性剤が大量に使えるかどうかが鍵である。
W/Oマイクロエマルジョン中に可溶化している水は、極性基に結合している部分と自由水に近い部分とに分けられる。後者は無機塩などの水溶性物質を溶かすことができる。しかも、逆ミセルは動的性質を持っているので、衝突に際して他のミセルと内部の水を交換することができる。したがって、反応物質を別々のミセルに可溶化しておけば、混合により、ミセルの衝突→接触、交換→反応という過程が起きるはずである。この推定は多くの逆ミセル内での超微粒子生成反応で実証された。
例として、磁性酸化鉄(Fe3O4)の生成反応をあげる。AOTまたは非イオン界面活性剤(ポリオキシエチレンノニルフェニルエーテル、平均酸化エチレン基数6)のシクロヘキサン溶液に、FeCl3、FeCl2、NH3の水溶液をそれぞれ可溶化した系を作り、これらを混合すると瞬時にして反応が起こり、Fe3O4の超微粒子(粒子直径約3 nm)の分散系が生成する[Gobe et al., 1983]。この系は磁性を示し、一種の磁性流体である。このときの反応は、次式で示される。
Fe2+ + Fe3+ + 8OH– → Fe3O4 + 2H2O
参考文献
Alonso, M. and E. J. Finn, E.J.: University Physics-Volume Ⅱ Field and Waves, Addison-Wesley Publoshing Co., 1967
Bergdtrom, L.: Hamaker Constants of Inorganic Materials, Advances in Colloid and Interface Science, 70, pp.125-169, 1997
Derjaguin, B.V.: Kolloid Z. (in German). Vol.69, No.2, pp.155–164, 1934
Dynstee, E. F., E. Grunwald: J.Am. Chem. Soc., 81, 4540(1959
Eischens, R. P., S. F. Francis, W. A. Pliskin: J. Phys. Chem., 60, 196(1956)
Fowkes, F. M.: Ond. Eng. Che., 56, 41(1964)
Gobe, M., K. Kon-no, K. Kandori, A. Kitahara: J. Colloid Interface Sci., 93, 293(1983)
Hamaker, H.C.: Physica Ⅳ, No.10, 1058(1937)
Hoffman, H., G. Ebert: Angew Chem. Int. Ed., 27, 902(1988)
Imae, T, R. Kamiyama, S.Ishida: J. Colloid Interface Sci., 108, 215(1985); J. Phy. Chem., 90, 5216(1986); Colloid Polymer Sci., 265, 1090(1987)
Israelachvili, J. N., D. J. Mitchell, B. W. Ninham: J. Chem. Soc. Faraday Trans.Ⅱ, 72, 1525(1976); Biochem. Biophs. Acta, 470, 185(1977)
Mizuhara, K., K. Hara, T. Imoto: Kolloid-Z. u. Z. Polymere, 229,17(1969); ibid., 237,279(1970)
Ogino, K., M. Nakamae, M. Abe: J. Phys. Chem., 93, 3704(1989)
Otterwill, R.H. & A. Watanabe: Kolloid. Z., Vol.170, p.133, Fig.1, p.135, Fig.4(1960)
Shikata, T., Y. Sakaguchi, H. Uragami, A. Tamura, H. Hirata: J. Colloid Interface Sci., 119, 291(1989)
池上 徹(栗田工業KCRセンター):水処理教室-凝集処理、https://kcr.kurita.co.jp/wtschool/012.html
化学工学協会編:化学工学便覧、丸善、1978
北原 文雄・渡辺 晶:界面電気現象-基礎・測定・応用-、共立出版、1972
北原 文雄:界面・コロイド化学の基礎、講談社、1994
作花 済夫:ゾル-ゲル法の科学、アグネ承風社、1988
小林 幹雄・他4名共編:数学公式集:共立出版、2005
長谷川 裕也:コロイド化学、http://sekatsu-kagaku.sub.jp/colloid.htm
福田 清成・中垣 正幸:コロイド化学の基礎、大日本図書、1969
粉体工学会編:液相中の粒子分散・凝集と分離操作、日刊工業新聞社、2010
松村 淳司:界面・電気化学講義、http://res.tagen.tohoku.ac.jp/~liquid/MURA/kogi/kaimen/kaimen2002/2002-6.pdf
用水廃水便覧編集委員会編:用水・廃水便覧、丸善、1973
目次へ
掲載日:2019年03月29日
更新日:2019日04月21日
