Outline of water purification technology – Removal of soluble substances
村上定瞭(水浄化フォーラム), Sadaaki Murakami (Water & Solutions Forum)
溶解性物質の除去
水中に溶解した物質を化学反応により無害な物質へ変換したり、不溶性塩の沈殿を生成させて分離したり、固体へ吸着したりして汚濁物質を除く方法である。また、溶解性有機物は微生物に摂取させ、増殖した菌体を固液分離して取り除く。
Removal of soluble substances
It is a method of removing pollutants by converting substances dissolved in water into harmless substances by a chemical reaction, by generating insoluble salt precipitates for separation, or by adsorbing to solids. In addition, soluble organic substances are taken up by microorganisms, and the grown bacterial cells are separated by solid-liquid separation.
1.中和
多くの水生動物、農作物に対して望ましいpHは5.8~8.6であるとされる。pHの調整は単に放流水だけを対象とするものではなく、生物学的処理や凝集沈殿などの処理を効果的に行う前処理としても重要である。
中和剤の選定においては、反応速度、中和曲線、反応生成物の沈降・脱水性などを検討して、最も経済的なものを選ぶ。アルカリ剤としては、水酸化ナトリム、炭酸ナトリム、生石灰CaO、消石灰Ca(OH)2、水酸化マグネシウムMg(OH)2などが、酸として硫酸、塩酸などが用いられる。
酸-アルカリの中和反応において、不溶性塩を生成しない中和剤を選ぶ場合と積極的に不溶性塩を生成させる場合がある。ナトリム化合物は不溶性塩の形成がないが、硫酸イオンや炭酸イオンを多量含む酸性排水に対して生石灰や消石灰を用いると硫酸カルシウムの沈殿が生成する。
1. Neutralization
The desirable pH for most aquatic animals and crops is 5.8 to 8.6. The adjustment of pH is not only intended for discharged water, but is also important as a pretreatment for effectively carrying out biological treatment or treatment such as coagulation sedimentation.
In selecting the neutralizing agent, the most economical one is selected by considering the reaction rate, the neutralization curve, the precipitation/dehydration property of the reaction product, and the like. As the alkaline agent, sodium hydroxide, sodium carbonate, quick lime CaO, slaked lime Ca(OH)2, magnesium hydroxide Mg(OH)2 and the like are used, and sulfuric acid, hydrochloric acid and the like are used as the acid.
In the acid-alkali neutralization reaction, a neutralizing agent that does not form an insoluble salt may be selected or an insoluble salt may be positively formed. Although sodium compounds do not form insoluble salts, calcium sulfate precipitates when quicklime or slaked lime is used for acidic wastewater containing a large amount of sulfate ions and carbonate ions.
2.酸化
水質汚濁の指標としてCODやBODが用いられるように、汚濁物質の酸化は水処理分野において重要な処理プロセスである。
塩素や次亜塩素酸ナトリウムは他の酸化剤と比べて安価であり、強力な殺菌作用をもち処理水の消毒、また、水中の有機物や硫化水素、シアンなどの酸化分解などに用いられ、水処理においては不可欠の酸化剤である。
オゾンは塩素より強い酸化力を有し、次のような利点がある。オゾンの発生量は電力により調整できる。水中では短時間で分解消滅する。塩素のように有機物と反応して有機塩素化合物を生じるおそれがない。
そのほか、硫酸酸性で第一鉄塩と過酸化水素を用いるフェントン法、オゾンと紫外線の併用など複数の要素を組み合わせ酸化力を促進する方法がある。
化学酸化は難生分解性有機物、例えば、芳香族化合物や第4級アミンなど、を生分解性物質へ改質する処理法としても用いられる。図1に電解塩素を酸化剤とする有機物の有機酸への改質例を示す。
2. Oxidation
As COD and BOD are used as indicators of water pollution, oxidation of pollutants is an important treatment process in the water treatment field.
Chlorine or sodium hypochlorite are cheaper than other oxidizers, has a strong bactericidal action, and is used for disinfecting treated water, and for oxidative decomposition of organic substances in the water, hydrogen sulfide, cyanide, etc. It is an essential oxidant in processing.
Ozone has a stronger oxidizing power than chlorine and has the following advantages. The amount of ozone generated can be adjusted by electric power. Decomposes and disappears in water in a short time. There is no danger of reacting with organic substances to form organochlorine compounds like chlorine.
In addition, there are methods such as Fenton’s method that uses ferrous salt and hydrogen peroxide under sulfuric acid acidity, and methods that combine multiple elements such as combined use of ozone and ultraviolet rays to promote the oxidative power.
Chemical oxidation is also used as a treatment method for modifying a hardly biodegradable organic substance such as an aromatic compound or a quaternary amine into a biodegradable substance. Figure 1 shows an example of reforming an organic acid to an organic acid using electrolytic chlorine as an oxidant.
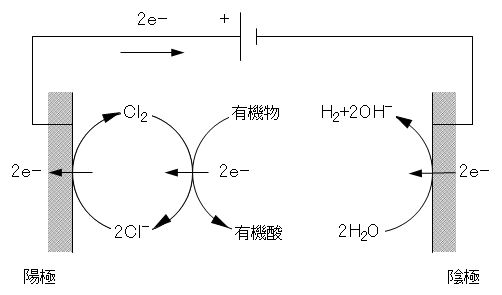
図1 電解塩素による有機物の酸化機構
Figure 1 Oxidation mechanism of organic matter by electrolytic chlorine.
3.不溶性塩
例えば、カドミウムイオンに対して、硫化物イオンを添加すると硫化カドミウムの沈殿が生成する。また、重金属イオンを中和すると水酸化物の沈殿が生成する。溶解度の低い不溶性塩を形成するようなイオンを添加したり、pHを調整することにより不溶性塩の沈殿を形成させ、水中から汚濁物質を除くことができる。
また、微量の重金属イオンを含む排水に、鉄(Ⅱ)塩を添加して中和・空気酸化して水酸化鉄(Ⅲ)とともに沈殿させる共沈殿法もある。
3. Insoluble salts
For example, addition of sulfide ions to cadmium ions causes precipitation of cadmium sulfide. Further, when the heavy metal ions are neutralized, a hydroxide precipitate is generated. By adding an ion that forms an insoluble salt having low solubility or adjusting the pH, a precipitate of the insoluble salt can be formed to remove contaminants from water.
There is also a co-precipitation method in which iron (II) salt is added to the wastewater containing a trace amount of heavy metal ions for neutralization and air oxidation to precipitate with iron (III) hydroxide.
4.吸着
生物学的あるいは物理・化学的な方法でも分離できないような微量の有機化合物を除去するために吸着法が用いられる。吸着剤として活性炭が最も広く用いられている。活性炭の内部には10-7~10-3cmの細孔が無数に存在し、その比表面積は500~1500m2/gと極めて大きい。
図2に活性炭の構造とその層状構造内への分子の取り込みの様子を示す。活性炭への吸着されやすさは次のようになる。脂肪族化合物より芳香族化合物のほうが吸着されやすい。疎水性であるほど吸着されやすく、脂肪族のアルキル基が長いほど疎水性となり、吸着性を増す。
溶液の表面張力を減少させる物質を界面活性であるといい、界面活性が強い物質ほど、吸着されやすい。弱電解質の有機物は、イオン化しているものより非解離の分子状態での吸着力が大きい。極性が大きい分子は吸着力が弱い。分子量が大きくなるほど、吸着性が増すが、細孔内の拡散速度が遅くなり、分子量が1500を超えると著しく遅くなるといわれている。
吸着装置としては、反応槽内の被処理水に粒子状の活性炭を添加し機械的に水と活性炭を混合し吸着終了後に活性炭を沈降分離する方式や、塊状の活性炭充填槽に排水を通水して有機物を吸着させる方式などがある。
4. Adsorption
Adsorption methods are used to remove traces of organic compounds that cannot be separated by biological or physical/chemical methods. Activated carbon is most widely used as an adsorbent. There are innumerable pores of 10-7 to 10-3 cm inside the activated carbon, and its specific surface area is extremely large at 500 to 1500 m2/g.
Figure 2 shows the structure of activated carbon and how molecules are incorporated into the layered structure. The susceptibility to adsorption on activated carbon is as follows. Aromatic compounds are more easily adsorbed than aliphatic compounds. The more hydrophobic it is, the easier it is to be adsorbed, and the longer the aliphatic alkyl group is, the more hydrophobic it is, and the more it is adsorbed.
A substance that reduces the surface tension of a solution is said to be surface active. A substance having a stronger surface activity is more easily adsorbed. The weak electrolyte organic substance has a larger adsorptive power in a non-dissociated molecular state than in an ionized one. Molecules with large polarity have weak adsorption power. It is said that as the molecular weight increases, the adsorptivity increases, but the diffusion speed in the pores slows down, and when the molecular weight exceeds 1500, it remarkably slows down.
As the adsorption device, particulate activated carbon is added to the water to be treated in the reaction tank, mechanically mix the water and activated carbon, and the activated carbon is settled and separated after the adsorption is completed, or the waste water is passed through the activated carbon filling tank in the lump form. Then, there is a method of adsorbing organic substances.
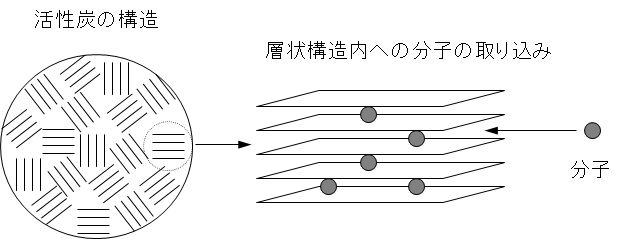
図2 活性炭による分子の吸着機構
Figure 2 Adsorption mechanism of molecules by activated carbon.
5.イオン交換
図3に示すように、固液2相間においてイオンが互いに入れ替わる反応をイオン交換反応という。このイオン交換をする母体をイオン交換体と呼び、最近では、有機合成によって作られたイオン交換樹脂が用いられている。
イオン交換樹脂は、排水から有価物の回収、微量の重金属イオンの除去などに用いられている。イオン交換樹脂は高価であるから、再生して繰り返し利用される。再生には強酸、強アルカリあるいは食塩などの濃厚溶液が使用され、したがって濃厚な再生液の処理が必要である。
5. Ion exchange
As shown in Figure 3, the reaction in which the ions are exchanged between the two solid-liquid phases is called the ion exchange reaction. The mother body for this ion exchange is called an ion exchanger, and recently, an ion exchange resin made by organic synthesis is used.
Ion exchange resins are used for recovering valuable substances from waste water and removing trace amounts of heavy metal ions. Since the ion exchange resin is expensive, it is regenerated and reused. Concentrated solutions such as strong acids, strong alkalis or salt are used for regeneration and therefore treatment of concentrated regenerants is necessary.
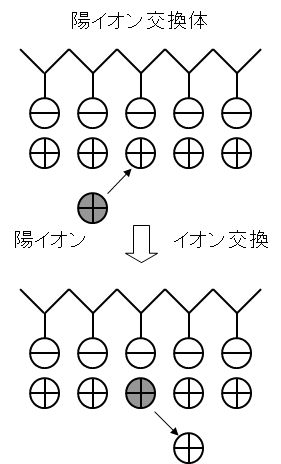
図3 イオン交換による陽イオンの除去機構
Figure 3 Mechanism of cation removal by ion exchange.
