村上定瞭(水浄化フォーラム)
はじめに
Cr(最外殻電子:3d54s1)・Mn(3d54s2)・Fe(3d64s2)などは遷移元素で、自然の水環境の条件(好気・嫌気または酸化還元電位)によって、金属イオンの価数が容易に変化する。一方、Zn(4s2)・Cd(5s2)・Pb(6s26p2)で、金属イオンはZn(Ⅱ)・Cd(Ⅱ)が安定である。鉛は,条件によってPb(Ⅱ)またはPb(Ⅳ)が安定である。
上記の重金属M(Ⅱ)/(Ⅲ)は、酸性では水溶性であるが、中性・アルカリ性では水酸化物M(OH)2またはM(OH)3(Ⅲ価は弱酸性でも)を形成して難溶性となるが、Zn(Ⅱ)およびPb(Ⅱ)はアルカリ性では、OH–イオンが配位して再び溶解する両性水酸化物質である。これらの重金属は中和によって難溶性の水酸化物を生成させて除去する方法が一般的に用いられるが、ZnおよびPbには注意が必要である。
上記の重金属M(Ⅱ)/(Ⅲ)は、酸性では水溶性であるが、中性・アルカリ性では水酸化物M(OH)2またはM(OH)3(Ⅲ価は弱酸性でも)を形成して難溶性となるが、Zn(Ⅱ)およびPb(Ⅱ)はアルカリ性では、OH–イオンが配位して再び溶解する両性水酸化物質である。これらの重金属は中和によって難溶性の水酸化物を生成させて除去する方法が一般的に用いられるが、ZnおよびPbには注意が必要である。
Ⅰ.カドミウム
カドミウムは銀白色の光沢を有し、展延性に富み、加工しやすい金属である。亜鉛と化学的性質が似ており、カドミウム単独ではなく、亜鉛鉱物、特に閃亜鉛鉱(ZnS)や菱亜鉛鉱(ZnCO3)に伴って産出される。
用途として、メッキ、顔料、電池、テレビのブラウン管、合金、化学試験材料、塩化ビニル樹脂安定剤等に使用されている。
カドミウムの人に対する経口致死量は、350~3,500mg/人と推定され成人に対して影響を及ぼさない量は3mg/人と考えられている。また、経口摂取後の吸収率は、3~7%と推定され、体内ではタンパク質と結合する。なお、排泄は緩慢であり、生体における生物学的半減期は非常に長く、成人では20年である。急性毒性としては、カドミウム化合物の経口LD 50は、マウスとラットで60~5,000mg/kg体重であり、ラットでは飲料水中10mg/L以上の連続摂取で腎臓に障害性の影響がみられている。魚類の急性毒性では、96時間LD 50がニジマスで0.007mg/L、ブルーギルで20.4mg/Lなどのデータがある。慢性毒性としては、ラットの経口投与による長期毒性試験では、腫瘍の発生率に増加はみられていない。なお、骨軟化症を起こすイタイイタイ病の主な原因は、カドミウムの慢性中毒であるとされている。発がん性に関しては、国際がん研究機関(IARC)による分類では、2A(人に対して発がん性を示す可能性が非常に高い)にランクされている。
カドミウムは、水中ではCd(H2O)42+として、また、塩化物イオンと錯体を作りやすく、Cl–濃度に応じてCdCl42-、Cd(H2O)2Cl2等の形で存在する。土壌中では、陽イオンの形のときは粘土等に吸着されるが、わずかなCl–の存在で、海水中と同様に中性または陰電荷をもつ錯イオンとなり、粘土から離れていくという特性をもつ。その性質は、亜鉛よりはるかに強い。
地表水、地下水では亜鉛の1/200程度含まれていることが多い。一般的には汚染のない河川水中でカドミウムは0.02~0.2μg/L、海水で0.05~0.11μg/L程度含まれているといわれている。
カドミウムに関する水質基準を表Ⅰ-1に示す。排水基準については、一般に排水が公共用水域排出されるとき、排水口のごく周辺を除き10倍以上に希釈され環境基準を達成できるという考え方に基づいている。
用途として、メッキ、顔料、電池、テレビのブラウン管、合金、化学試験材料、塩化ビニル樹脂安定剤等に使用されている。
カドミウムの人に対する経口致死量は、350~3,500mg/人と推定され成人に対して影響を及ぼさない量は3mg/人と考えられている。また、経口摂取後の吸収率は、3~7%と推定され、体内ではタンパク質と結合する。なお、排泄は緩慢であり、生体における生物学的半減期は非常に長く、成人では20年である。急性毒性としては、カドミウム化合物の経口LD 50は、マウスとラットで60~5,000mg/kg体重であり、ラットでは飲料水中10mg/L以上の連続摂取で腎臓に障害性の影響がみられている。魚類の急性毒性では、96時間LD 50がニジマスで0.007mg/L、ブルーギルで20.4mg/Lなどのデータがある。慢性毒性としては、ラットの経口投与による長期毒性試験では、腫瘍の発生率に増加はみられていない。なお、骨軟化症を起こすイタイイタイ病の主な原因は、カドミウムの慢性中毒であるとされている。発がん性に関しては、国際がん研究機関(IARC)による分類では、2A(人に対して発がん性を示す可能性が非常に高い)にランクされている。
カドミウムは、水中ではCd(H2O)42+として、また、塩化物イオンと錯体を作りやすく、Cl–濃度に応じてCdCl42-、Cd(H2O)2Cl2等の形で存在する。土壌中では、陽イオンの形のときは粘土等に吸着されるが、わずかなCl–の存在で、海水中と同様に中性または陰電荷をもつ錯イオンとなり、粘土から離れていくという特性をもつ。その性質は、亜鉛よりはるかに強い。
地表水、地下水では亜鉛の1/200程度含まれていることが多い。一般的には汚染のない河川水中でカドミウムは0.02~0.2μg/L、海水で0.05~0.11μg/L程度含まれているといわれている。
カドミウムに関する水質基準を表Ⅰ-1に示す。排水基準については、一般に排水が公共用水域排出されるとき、排水口のごく周辺を除き10倍以上に希釈され環境基準を達成できるという考え方に基づいている。

目次へ
1.カドミウムの水中での化学的性質
周期表では亜鉛の下にあり、亜鉛と非常によく似ている。Ⅱ価の状態では銅(Ⅱ)にも似ている。
(1)pHの影響
水に溶解したCd(Ⅱ)の配位数を4(4が多く見られるが、条件によっては6となることもある。)とすると、酸性では水分子が4個配位した錯イオン[Cd(H2O)4]2+として存在する。さらに、例えば、陰イオンX–がp個配位すると、錯体[Cd(H2O)4-pXp](2-p)+となる。以下、簡略化するため、配位した水分子は省略して、Cu2+やCdXp(2-p)+と表記する。
水中のCd2+の陽イオンは無色で、白色のCd(OH)2はpH 8から沈殿する。熱溶液では脱水して黄色になり、乾固・加熱すると濃褐色のCdOとなる。Cd(OH)2は強アルカリ性ではわずかに溶け、Cd(OH)3–、Cd(OH)42-などを生じる。溶液を中和すると最初には塩基性塩および吸着化合物が生成する。pH 10.6まで塩基性塩が存在し、これはpH 11.2になるまで完全には水酸化物に変化しない。
水中のCd2+の陽イオンは無色で、白色のCd(OH)2はpH 8から沈殿する。熱溶液では脱水して黄色になり、乾固・加熱すると濃褐色のCdOとなる。Cd(OH)2は強アルカリ性ではわずかに溶け、Cd(OH)3–、Cd(OH)42-などを生じる。溶液を中和すると最初には塩基性塩および吸着化合物が生成する。pH 10.6まで塩基性塩が存在し、これはpH 11.2になるまで完全には水酸化物に変化しない。
Cd(OH)+ + H2O = Cd(OH)2(aq) + H+ pK2 = 9.9
Cd(OH)2(aq) + H2O = Cd(OH)3– + H+ pK3 = 18.7
Cd(OH)3– + H2O = Cd(OH)42- + H+ pK4 =33.1
Cd2+ + 2OH– = Cd(OH)2(s) pKsp = 14.4
(aq):溶解した水和イオン、(s):固体(結晶CdO・アモルホスCd(OH)2(1-x)OxによりKspの値が異なる、以下、同様)
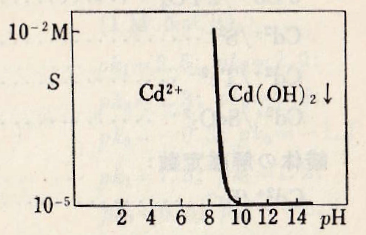
図Ⅰ-1 Cd(Ⅱ)水溶液のpHと溶解度の関係
作図は自動計算MS-Excel(ダウンロード)。
<留意事項>本ページに記載されている各数値(酸解離定数、溶解度積、錯体解離定数、酸化還元電位など)は、
文献によって異なる。また、計算値と実験値は異なることが多い。理由は別ページを参照。
(2)難溶性化合物
多数の塩および塩基性塩が難溶性である(炭酸塩、シアン化物、リン酸塩など)。硫化物が最も難溶性で、色はレモン黄ないし褐色でしばしばコロイド状になる。pH 0.2でも不溶性である。0.3N-HCl中でCdCl2の沈殿が生成し、HClがさらに濃くなると錯体CdCln(n-2)-(n>2)を生成して再溶解する。HCl中では、オレンジ色のクロロ硫化物(CdCl)2Sを生成することがある。
(3)錯体
たいていの陰イオンはCd2+と錯体を形成する。安定度の小さいCdCl–、CdCl2、CdCl3–、CdCl42-があり、同じように、SCN–、Br–、I–とも錯体を形成する。CdNO3+、CdSO4、Cd(SO4)22-、そのほかS2O32-との錯体もある。
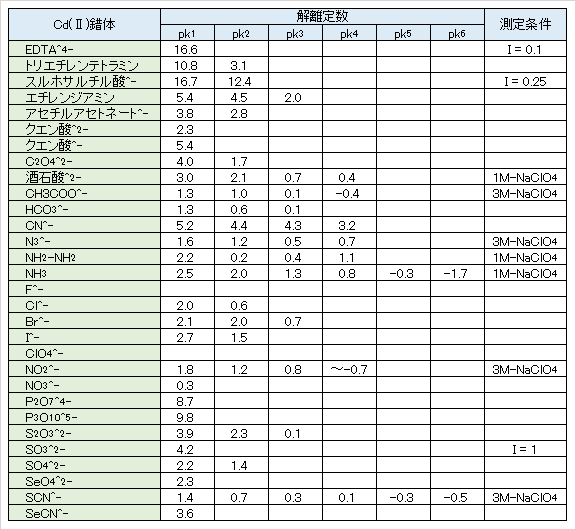
水酸化物Cd(OH)2はNH3水に溶けてアンミン錯体を形成するが、これもたいして安定ではない。CdCN+、難溶性のCd(CN)2のほかCd(CN)3–、Cd(CN)42-の錯体もある。表Ⅰ-3に各Cd(Ⅱ)錯体の解離定数を示す。解離定数 kが小さい(pk値の大きい)ものほど、錯体がより安定である。
水酸化物Cd(OH)2はNH3水に溶けてアンミン錯体を形成するが、これもたいして安定ではない。CdCN+、難溶性のCd(CN)2のほかCd(CN)3–、Cd(CN)42-の錯体もある。表Ⅰ-3に各Cd(Ⅱ)錯体の解離定数を示す。解離定数 kが小さい(pk値の大きい)ものほど、錯体がより安定である。
(4)酸化還元電位
つぎの式に、Cdの標準酸化還元電位を示す。また、酸化還元系の電位とpHの関係を図Ⅰ-2に示す。
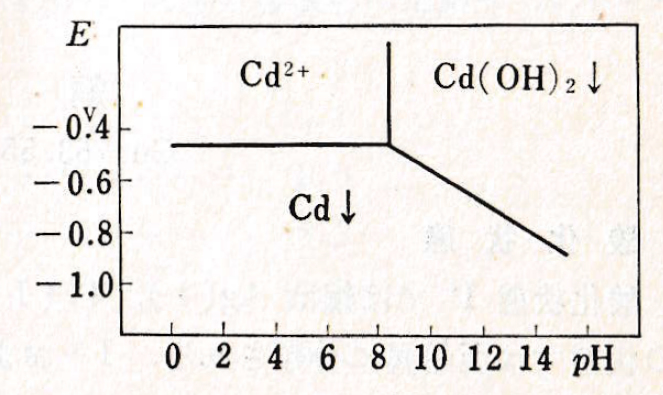
図Ⅰ-2 Cdの酸化還元系の見かけの電位とpHとの関係
目次へ
2.カドミウムの除去
(1)発生源
カドミウムおよびその化合物を含有する排水は、金属鉱山の坑内水、選鉱排水、精錬工場、メッキ工場、無機顔料などの無機工業製品製造工場、石油化学工業、写真感光材料製造業、有機化学工場、薬品製造業、ガラスまたはガラス製品製造業、非鉄金属製造業、金属製品製造業、機械器具製造業、電気メッキ施設などから排出されることがある。
(2)処理法
沈殿法、その他があり、アルカリ添加よる水酸化カドミウムとしての沈殿分離法がもっとも一般的である。溶存しているカドミウムを沈殿にし固液分離により除去する方法で、沈殿形として水酸化カドミウムCd(OH)2、硫化カドミウムCdS、アルキルキサントンゲン酸カドミウムCd[R-O-C(=S)-S]2(下図Ⅰ-3のS-H基のHが解離し、2個のキサントゲン酸イオン(合計4個のS基)がCd2+に配位し、4配位四面体構造となっている。)などがある。
1)水酸化カドミウム法・共沈法
Cd(Ⅱ)を含有する汚水にアルカリを加えpHを約10.5~11にし、水酸化カドミウムを沈殿させる。沈殿は凝集沈降し、さらに清浄ろ過(一般に砂ろ過)により分離する。
シアンを共存する場合には、カドミウムは錯イオンを形成しているので、沈殿の前に酸化してシアンを分解する。酸化には一般にアルカリ塩素法が用いられる。
Cd(OH)2はごくわずかに溶けてイオン解離している。溶存しているCdは排水基準以下でなければならない。そのために必要なpHは10.5~11である。
鉄やアルミニウムのイオンが共存すると、共沈効果によってpH9程度でカドミウムを0.1mg/Lにすることができる場合がある。共沈法の詳細については、別ページで掲載する。
シアンを共存する場合には、カドミウムは錯イオンを形成しているので、沈殿の前に酸化してシアンを分解する。酸化には一般にアルカリ塩素法が用いられる。
Cd(OH)2はごくわずかに溶けてイオン解離している。溶存しているCdは排水基準以下でなければならない。そのために必要なpHは10.5~11である。
鉄やアルミニウムのイオンが共存すると、共沈効果によってpH9程度でカドミウムを0.1mg/Lにすることができる場合がある。共沈法の詳細については、別ページで掲載する。
2)置換法
安定な錯イオンを形成するキレート剤を含む重金属排水は、水酸化物法や共沈法では処理できないことがある。また、共沈剤を添加すると凝集性が悪化することもある。希薄な排水では、アルカリ性でオゾンや次亜塩素酸によりキレート剤を分解すると水酸化物の沈殿が生成するが、濃厚な排水では処理コストが高くなる。このような場合には、置換法が有効であることが多い。置換法には、Ca塩、Mg塩、Fe塩とMg塩を利用する方法があるが、キレート剤を含む排水は、事前の共沈法に加えて、置換法を確認・選定する必要がある。置換法の詳細については、別ページで解説する。
3)硫化カドミウム法
硫化ナトリウムを加え、生成した硫化カドミウムCdSの沈殿を凝集沈降させ、さらに清浄ろ過により分離する。
4)ザンセート浮上法
アルキルザンセート(キサントゲン酸のアルキル基R:エチル、プロピル、あるいはブチルなど)を加え、カドミウム・アリキルザンセートの難溶性塩として沈殿させる。この沈殿は一般に浮上分離により除去されるので,ザンセート浮上法ともよばれる。
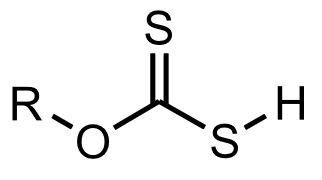
図Ⅰ-3 キサントゲン酸

図Ⅰ-3 キサントゲン酸
5)イオン交換法
亜鉛の除去に記載してあるので、省略する。
Ⅲ.鉛
鉛は、蒼白色の金属光沢を有し、軟らかく加工しやすい金属である。
鉛は地殻中に13mg/kg程度含まれているといわれている。用途として、蓄電池、ハンダ、合金、顔料、塗料、農薬、活字、鉛管、放射線遮蔽材、電線の被覆、防錆材料等、多岐にわたっている。
鉛中毒は昔から鉛毒として知られており、近年では、自動車の加鉛ガソリンの問題で注目されるようになった。職業性暴露では、鉛のヒューム、粉塵などの肺からの吸収が多く、次いで経口摂取が多い。吸収された鉛は最終的に骨に蓄積され、生物学的半減期は約20年以上と算定されている 。鉛化合物の毒性は血液中の鉛濃度に左右される。したがって、毒性は、鉛化合物の溶解性に関係し、不溶性より可溶性のものが強い。鉛中毒の症状は体内の蓄積濃度、暴露期間により異なるが、全身の疲れに始まり、不眠、頭痛、関節痛から腎臓障害、末梢神経、脳神経障害に至る。発ガン性に関しては、国際ガン研究機関(IARC)による分類では、無機鉛が2B(人に対して発ガン性を示す可能性がかなり高い)、有機鉛が3(人に対して発ガン性の疑いがある)にランクされている。水生生物に対しては、水中の硬度が増すと毒性が弱まることが示されている。
昔は、水道の給水管に鉛管を使用し、鉛が溶出することがあったが、現在、鉛管は新規の敷設には使われていない。
鉛は、特に硬度が低く、遊離炭酸が多い水には溶けやすい。また、鉛は水中ではPb2+、Pb(OH)+、Pb(OH)42-等として溶存しているが、沈降しやすい。汚染のない河川水中で鉛は0.001~0.01mg/L、海水で0.03μg/L程度含まれているといわれている。
鉛の基準値は、健康影響に関する知見の拡大により、人の健康の保護に関する環境基準は、平成5年に0.1mg/L以下から0.01mg/L以下に、水道水質基準では平成4年に0.1mg/L以下から0.05mg/L以下に強化された。さらに水道水質基準では、鉛の毒性は蓄積性のものと考えられることから、平成14年に0.01mg/L以下と強化された。排水基準及び下水道への排出基準は0.1mg/L以下と定められている(上記表Ⅰ-1)。
鉛は地殻中に13mg/kg程度含まれているといわれている。用途として、蓄電池、ハンダ、合金、顔料、塗料、農薬、活字、鉛管、放射線遮蔽材、電線の被覆、防錆材料等、多岐にわたっている。
鉛中毒は昔から鉛毒として知られており、近年では、自動車の加鉛ガソリンの問題で注目されるようになった。職業性暴露では、鉛のヒューム、粉塵などの肺からの吸収が多く、次いで経口摂取が多い。吸収された鉛は最終的に骨に蓄積され、生物学的半減期は約20年以上と算定されている 。鉛化合物の毒性は血液中の鉛濃度に左右される。したがって、毒性は、鉛化合物の溶解性に関係し、不溶性より可溶性のものが強い。鉛中毒の症状は体内の蓄積濃度、暴露期間により異なるが、全身の疲れに始まり、不眠、頭痛、関節痛から腎臓障害、末梢神経、脳神経障害に至る。発ガン性に関しては、国際ガン研究機関(IARC)による分類では、無機鉛が2B(人に対して発ガン性を示す可能性がかなり高い)、有機鉛が3(人に対して発ガン性の疑いがある)にランクされている。水生生物に対しては、水中の硬度が増すと毒性が弱まることが示されている。
昔は、水道の給水管に鉛管を使用し、鉛が溶出することがあったが、現在、鉛管は新規の敷設には使われていない。
鉛は、特に硬度が低く、遊離炭酸が多い水には溶けやすい。また、鉛は水中ではPb2+、Pb(OH)+、Pb(OH)42-等として溶存しているが、沈降しやすい。汚染のない河川水中で鉛は0.001~0.01mg/L、海水で0.03μg/L程度含まれているといわれている。
鉛の基準値は、健康影響に関する知見の拡大により、人の健康の保護に関する環境基準は、平成5年に0.1mg/L以下から0.01mg/L以下に、水道水質基準では平成4年に0.1mg/L以下から0.05mg/L以下に強化された。さらに水道水質基準では、鉛の毒性は蓄積性のものと考えられることから、平成14年に0.01mg/L以下と強化された。排水基準及び下水道への排出基準は0.1mg/L以下と定められている(上記表Ⅰ-1)。
1.鉛の水中での化学的性質
最も重要なのはⅡ価およびⅣ価である。
1.1 Pb(Ⅱ)
(1)pHの影響
陽イオンPb2+は無色・白色の水酸化物Pb(OH)2は両性で、pH 7.5で沈殿し、pH 13.0以上ではPb(OH)3–、Pb(OH)42-のような陰イオンを生じて再溶解する。Pb(OH)2を加熱・脱水した酸化物PbOは赤色または黄色である。
塩基性塩、例えば、上記表Ⅰ-2に示すPb(OH)Cl、塩基性酢酸塩および塩基性硝酸などが中和の途中で沈殿する。
塩基性塩、例えば、上記表Ⅰ-2に示すPb(OH)Cl、塩基性酢酸塩および塩基性硝酸などが中和の途中で沈殿する。
Pb(OH)+ + H2O = Pb(OH)2(aq) + H+ pK2 = 9.3
Pb(OH)2(aq) + H2O = Pb(OH)3– + H+ pK3 = 11.0
Pb(OH)3– + H2O = Pb(OH)42- + H+ pK4 = 15.4
Pb2+ + 2OH– = Pb(OH)2(s) pKsp = 15.9
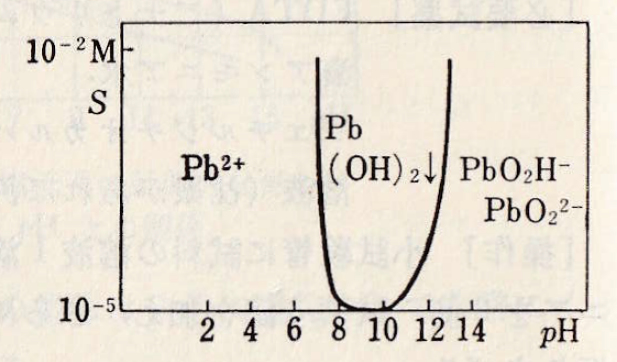
図Ⅱ-1 Pb(Ⅱ)水溶液のpHと溶解度の関係
注意)PbO2H– → Pb(OH)3–、PbO22- → Pb(OH)42-
作図は自動計算MS-Excel(ダウンロード)
(2)難溶性化合物
溶解度の小さい塩が多く、PbCl2、PbBr2や黄色のPbI2は熱溶液にはよく溶解するので、冷却するとキラキラする板状結晶が析出する。PbF2、PbSO4の中で後者は大過剰の酢酸イオンに溶解するが、そこに酸、SO42-あるいはCrO42-のイオンを加えると、これらとPb(Ⅱ)との塩が再沈殿する。
最も難溶解な塩は黄色のクロム酸塩と白色のリン酸塩で、いずれも2N酢酸に難溶である。これらの化合物は硫化物のほかはすべて2N-NaOHに溶ける。PbSは1.5N-HClにわずかに溶解する、4N-HClでは錯体を形成して速やかに溶ける。塩酸酸性で硫化水素を通じるとまず赤いスルフォ塩化物ができ、ついで黒色のPbSになる。PbSはHNO3によって酸化される。
最も難溶解な塩は黄色のクロム酸塩と白色のリン酸塩で、いずれも2N酢酸に難溶である。これらの化合物は硫化物のほかはすべて2N-NaOHに溶ける。PbSは1.5N-HClにわずかに溶解する、4N-HClでは錯体を形成して速やかに溶ける。塩酸酸性で硫化水素を通じるとまず赤いスルフォ塩化物ができ、ついで黒色のPbSになる。PbSはHNO3によって酸化される。
(3)錯体
安定な錯体の種類は多くはない。Cu+、Cu2+、Cd2+などと異なり、安定なアンミン錯体はなく、不安定なPbNO3+、PbCl+、PbCl2、PbCl3–、PbI3–、Pb(CN)42-などがある。酢酸イオン、チオ硫酸イオン、有機のヒドロキシ化合物とのPb(Ⅱ)錯体はかなり安定である。
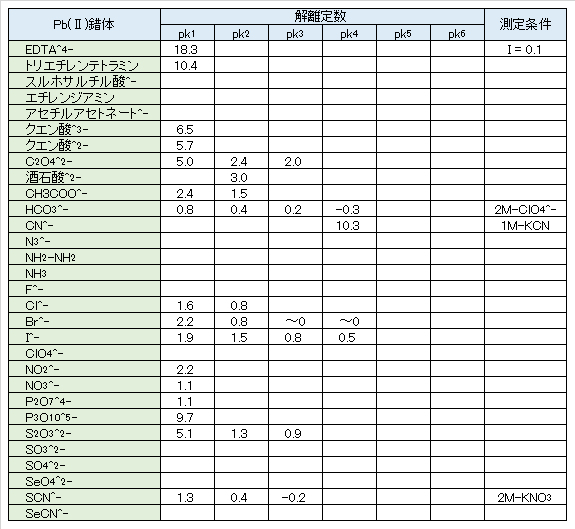
(4)酸化還元反応
金属鉛は硝酸や熱硫酸に溶け、熱濃硫酸はできたPbSO4が溶解する。HClおよび濃HIにも、錯体生成をともなって少しずつ溶解が起こる。HFは作用しない。
Pb(OH)42- + 2H+ +2e– = Pb(s) + 2OH– Eo = -0.60 V(1N-KOH)
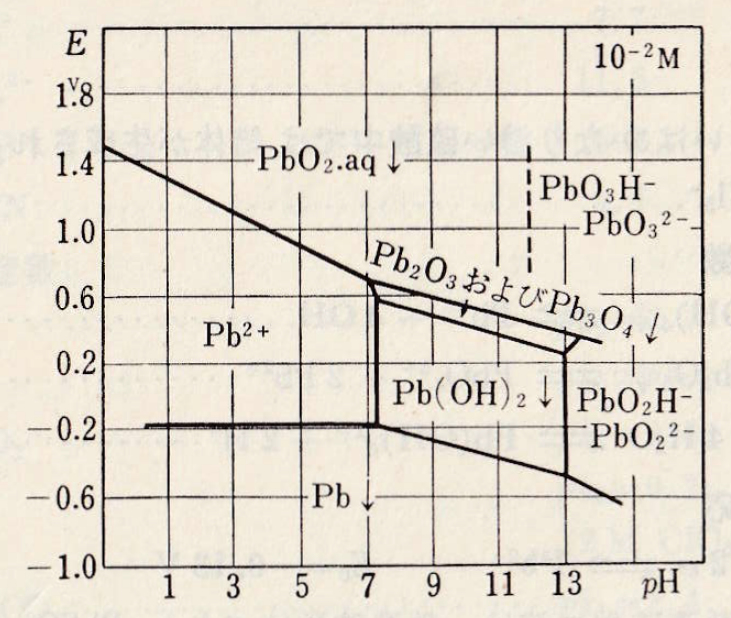
図Ⅱ-2 Pbの酸化還元電位系の見かけの電位とpHとの関係
1.2 Pb(Ⅳ)
(1)pHの影響
陽イオンPb4+は非常に酸性で、強酸性でも溶液中にはほとんど存在せず、褐色のPbO2が生成する。水酸化物はうすいNaOH溶液に溶けてPb(OH)62-(または、PbO32-)が生成する。
(2)錯体
濃塩酸あるいはかなり濃い硫酸中では錯体が生成される。たとえば、PbCl5–やPbCl62-などである。
(3)酸化還元反応
Pb(Ⅳ)の標準酸化還元電位は、
PbO2(s) + 4H+ + 2e– = Pb2+ + 2H2O Eo = 1.46 V
6M-H2SO4にPbO2が飽和した溶液では1.7 V、HCl中では、
PbO2は酸性で亜硫酸、シュウ酸、濃塩酸などによって還元される。
アルカリ性ではPbOはPb3O4、またはゆっくりと不均一化してPb2O3およびPbO2に酸化される。
アルカリ性ではPbOはPb3O4、またはゆっくりと不均一化してPb2O3およびPbO2に酸化される。
3PbO2(s) + H2O + 4e– = 3PbO(s) + 4OH– Eo = 0.32 V
3Pb2O3(s)+ H2O + 2e– = 3PbO(s) + 2OH– Eo = 0.40 V
強アルカリ性溶液では、PbO22-およびPb(OH)2はペルオキシ二硫酸塩、次亜塩素酸などによって酸化される。この際PbO22-はまずPb2O3またはPb3O4に酸化され、これが沈殿して、次にPbO32-に酸化される。
PbO32- + 5H+ + 4e– = Pb3O4(s)+ 5OH– Eo = 0.3 V
(酸化物で飽和した1N-KOH中での測定値)
目次へ
2.鉛の除去
(1)発生源
鉛およびその化合物を含有する排水は無機顔料などの無機化学工業製品製造業、有機化合薬品製造業、医薬品製造業、ガラスまたはガラス製品製造業、非鉄金属製造業、金属製品製造業、機械器具製造業などからの排水に含有することがある。
(2)処理法
処理方法は沈殿法およびその他があり、一般には水酸化鉛としての沈殿法が利用される。
1)水酸化鉛法・共沈法
水酸化鉛(酸化鉛)としての沈殿法が一般に応用される。汚水にアルカリを加えpH 9~10にし、生成した水酸化鉛は凝集沈降と清浄ろ過により分離する。
溶解度積はあまり小さくないのでpHはやや高めにする。pHが高くなりすぎると、[Pb(OH)3]–や[Pb(OH)4]2-を生成し、再溶解するので注意する。
鉄やアルミニウムのイオンが共存すると、共沈効果が得られ、操作pHを低くすることができる。
溶解度積はあまり小さくないのでpHはやや高めにする。pHが高くなりすぎると、[Pb(OH)3]–や[Pb(OH)4]2-を生成し、再溶解するので注意する。
鉄やアルミニウムのイオンが共存すると、共沈効果が得られ、操作pHを低くすることができる。
2)硫化鉛法
硫化鉛は溶解度積が著しく小さいので硫化鉛としての沈殿と固液分離による汚水処理が効果的であるが、沈殿はコロイドになりやすく、経費の視点から一般には採用されない。
3)イオン交換法
有機鉛化合物の(C2H5)3PbClは水中で解離して(C2H5)3Pb+として存在するので、強酸性イオン交換樹脂を用いるイオン交換鉱によって処理が可能となる。
Ⅲ.亜鉛
亜鉛は、青みの帯びた銀白色で、展延性に富んでいる金属である。湿った空気中では、表面に塩基性炭酸塩を形成する。
自然界に比較的広く分布する金属で、地殻中に70mg/kg程度含まれており、閃亜鉛鉱(ZnS)、紅亜鉛鉱(ZnO)、菱亜鉛鉱(ZnCO 3 )等として産出される。亜鉛は、カドミウムと化学的性質が似ている。用途として、トタン板の製造、真鍮等の合金材料、乾電池等に使用されている。
亜鉛は、カドミウムと異なり生物にとって必須元素であり、生体内で重要な役割を果たしている。亜鉛が欠乏すると、いろいろな障害を引き起こすが、多量に摂取すれば、呼吸器や消化器に障害をきたす。ヒトにおける生物学的半減期は、ほぼ1年である。
人為的な汚染源としては、鉱山排水、メッキ工場、顔料、医薬品製造工場等がある。また、ゴム製品、特に自動車のタイヤから放出される亜鉛が雨水等により土壌に吸着し、土壌汚染から水系汚染にまで及ぶ。上水道にみられる障害としては、給水管や給水装置の亜鉛メッキ部分からの溶出によるものがある。亜鉛が1mg/L以上になると、白濁したり、お茶の味を損ない、5mg/L以上で風呂等に汲み置きすると、表面に油膜状に浮く。
亜鉛は水中では[Zn(H2O)4]2+、[Zn(H2O)6]2+等として存在している。カドミウムと同様、塩素イオン錯体を作りやすい。汚染のない河川水中で亜鉛は10μg/L、海水で1μg/L程度含まれているといわれている。
亜鉛の基準値は、水道水質基準として1.0mg/L以下、排水基準2mg/L以下、下水道への排除基準として5mg/L以下と定められている(上記表Ⅰ-1)。
自然界に比較的広く分布する金属で、地殻中に70mg/kg程度含まれており、閃亜鉛鉱(ZnS)、紅亜鉛鉱(ZnO)、菱亜鉛鉱(ZnCO 3 )等として産出される。亜鉛は、カドミウムと化学的性質が似ている。用途として、トタン板の製造、真鍮等の合金材料、乾電池等に使用されている。
亜鉛は、カドミウムと異なり生物にとって必須元素であり、生体内で重要な役割を果たしている。亜鉛が欠乏すると、いろいろな障害を引き起こすが、多量に摂取すれば、呼吸器や消化器に障害をきたす。ヒトにおける生物学的半減期は、ほぼ1年である。
人為的な汚染源としては、鉱山排水、メッキ工場、顔料、医薬品製造工場等がある。また、ゴム製品、特に自動車のタイヤから放出される亜鉛が雨水等により土壌に吸着し、土壌汚染から水系汚染にまで及ぶ。上水道にみられる障害としては、給水管や給水装置の亜鉛メッキ部分からの溶出によるものがある。亜鉛が1mg/L以上になると、白濁したり、お茶の味を損ない、5mg/L以上で風呂等に汲み置きすると、表面に油膜状に浮く。
亜鉛は水中では[Zn(H2O)4]2+、[Zn(H2O)6]2+等として存在している。カドミウムと同様、塩素イオン錯体を作りやすい。汚染のない河川水中で亜鉛は10μg/L、海水で1μg/L程度含まれているといわれている。
亜鉛の基準値は、水道水質基準として1.0mg/L以下、排水基準2mg/L以下、下水道への排除基準として5mg/L以下と定められている(上記表Ⅰ-1)。
1.亜鉛の水中でのの化学的性質
周期表ですぐ下のカドミウムによく似ているが、Zn2+はCd2+よりも酸性が強く、負電荷の錯イオンも多い。酸化状態はⅡ価が安定である。
(1)pHの影響
陽イオンZn2+は無色、Zn(OH)2は白色でpH 6.5から沈殿する。一般に溶液を中和すると塩基性塩または吸着化合物が沈殿し、これはさらにアルカリ性になると水酸化物に変化する。Zn(OH)2は両性でpH 14付近で再溶解して無色のZn(OH)42-(ZnO22-)になる。NH3はアンミン錯体を形成して水酸化物を溶解する。
Zn(OH)+ + H2O = Zn(OH)2(aq) + H+ pK2 = 7.94
Zn(OH)2(aq) + H2O = Zn(OH)3– + H+ pK3 = 11.50
Zn(OH)3– + H2O = Zn(OH)42- + H+ pK4 = 12.80
Zn2+ + 2OH– = Zn(OH)2(s) pKsp = 15.55
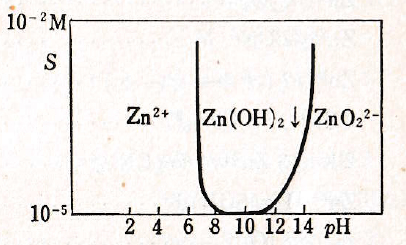
図Ⅲ-1 Zn(Ⅱ)水溶液のpHと溶解度の関係
ZnO22- → Zn(OH)42-
作図は自動計算MS-Excel(ダウンロード)
(2)錯体
アンミン、シアン化合物イオン、チオシアン酸イオンとの錯体はかなり不安定で、シュウ酸錯体も不安定である。ZnCl2、ZnCl–のようなクロロ錯体もたいして安定ではない。
(3)難溶性化合物
Zn(Ⅱ)の難溶性塩は多数ある。ZnSが最も難溶性であって、その沈殿は白色で、アリカリ性溶液から沈殿させるとコロイド状になるが、NH4+で凝集させることができる。また、熱酸性溶液で沈殿させるとろ過しやすい。これはZnSの溶解度がアルカリ性でより大きくなり、沈殿粒子が小さくなるからである。pH 1.1くらいの低いところですでに沈殿するから、トリクロル酢酸の緩衝液のpH2.5で沈殿する(Mn2+、Ni2+、Co2+との相違)。生成したばかりの沈殿は強アルカリに再溶解する。
K2Zn3[Fe(CN)6]2は白色で、うすい強酸溶液では溶解度は小さい。シアノコバルト(Ⅲ)酸亜鉛もこれと同じ性質を持っている。ZnNH4PO4はリン酸アンモニウム・マグネシウムMgNH4PO4(MAP:下水や焼却灰からのリンの回収に利用される)と同類で、pH5~7.5において難溶性である。
K2Zn3[Fe(CN)6]2は白色で、うすい強酸溶液では溶解度は小さい。シアノコバルト(Ⅲ)酸亜鉛もこれと同じ性質を持っている。ZnNH4PO4はリン酸アンモニウム・マグネシウムMgNH4PO4(MAP:下水や焼却灰からのリンの回収に利用される)と同類で、pH5~7.5において難溶性である。
(4)酸化還元反応
アルカリ性では、
亜鉛金属は強い還元剤であり、有機化合物の還元合成や化学分析で還元反応が必要な前処理操作において、広く用いられる。酸にでもアルカリでも侵されるが、水酸化物が難溶性でpH7~13では侵されない。強力な還元作用が必要な多くの還元反応で、酸性における亜鉛金属、ときには亜鉛アマルガムが用いられる。Cr2+やV2+はこのようにして調整される。As(Ⅲ)をAsH3に還元し、アルカリ性ではNO3–を還元してNH3に変換する。
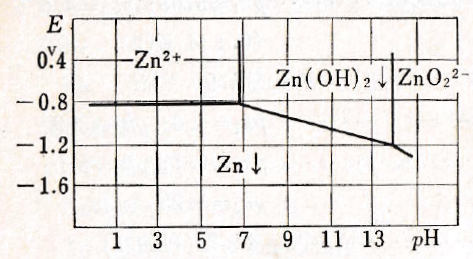
図Ⅲ-2 Znの酸化還元電位系の見かけの電位pHとの関係
目次へ
2.亜鉛の除去
(1)発生源
亜鉛は金属鉱山の坑内水、選鉱排水、精錬工場・化学工場・メッキ工場などの排水に含有されることがる。
(2)処理法
1)沈殿法
沈殿形は一般に水酸化亜鉛である。Zn2+を含有する排水はアルカリ(一般に水酸化カルシウム)を加えて、pH9~11にし、生成した水酸化亜鉛は一般に凝集沈殿により分離する。なお、亜鉛はpHが10以上になると溶解するので注意が必要である。
2)イオン交換法
繊維製造工場の凝固剤に用いる硫酸亜鉛や塩化亜鉛の処理に弱酸性陽イオン交換樹脂を用いてZn2+を吸着させ、食塩や硫酸ナトリウム水溶液(Na型で用いた場合)または塩酸や硫酸(H型)を用いて、亜鉛を濃厚水溶液として溶出ことにより、そのまま回収、再生利用するか、または濃縮た冷却により亜鉛化合物と過剰の溶離剤とを分離してそれぞれ回収、再利用する。
この方法は、亜鉛を石灰などにより水酸化亜鉛として沈殿除去する方法に比べ、スラッジを生じることなく回収・再利用が容易であるという利点がある。また、亜鉛精錬排水のような鉛とカドミウムの混合廃液には、その両者を共に吸着・脱着させて除去濃縮することが可能である。
1)沈殿法
沈殿形は一般に水酸化亜鉛である。Zn2+を含有する排水はアルカリ(一般に水酸化カルシウム)を加えて、pH9~11にし、生成した水酸化亜鉛は一般に凝集沈殿により分離する。なお、亜鉛はpHが10以上になると溶解するので注意が必要である。
2)イオン交換法
繊維製造工場の凝固剤に用いる硫酸亜鉛や塩化亜鉛の処理に弱酸性陽イオン交換樹脂を用いてZn2+を吸着させ、食塩や硫酸ナトリウム水溶液(Na型で用いた場合)または塩酸や硫酸(H型)を用いて、亜鉛を濃厚水溶液として溶出ことにより、そのまま回収、再生利用するか、または濃縮た冷却により亜鉛化合物と過剰の溶離剤とを分離してそれぞれ回収、再利用する。
この方法は、亜鉛を石灰などにより水酸化亜鉛として沈殿除去する方法に比べ、スラッジを生じることなく回収・再利用が容易であるという利点がある。また、亜鉛精錬排水のような鉛とカドミウムの混合廃液には、その両者を共に吸着・脱着させて除去濃縮することが可能である。
この方法は、亜鉛を石灰などにより水酸化亜鉛として沈殿除去する方法に比べ、スラッジを生じることなく回収・再利用が容易であるという利点がある。また、亜鉛精錬排水のような鉛とカドミウムの混合廃液には、その両者を共に吸着・脱着させて除去濃縮することが可能である。
Ⅳ.定量測定方法
1.公定測定方法
カドミウム、鉛、亜鉛などの重金属類についての公的な水質分析には、原子吸光分析法、ICP発光分析法、ICP質量分析法の3種類がある。原子吸光法は、さらに、フレーム原子吸光法と電気加熱(フレームレス)原子吸光法とに分けられる。これらの分析法の原理・装置・操作に関しては、別ページを参照されたい。
フレーム原子吸光法は、比較的操作が容易で精度も優れているため、古くから、重金属類の分析法の主流となっている。この分析法により、人の健康の保護に関する環境基準値の1/10の低濃度(0.001mg/L)まで測定するためには、目的元素を検水から分離・濃縮する必要がある。特に、PbはCdやZnと比べて感度が悪い。環境基準値レベルの測定を十分に満足させるためには、水中濃度の低い重金属の分離・濃縮に対して、次に示す溶媒抽出法が広く用いられている。
溶媒抽出法に用いるキレート剤には、ジチゾン、DDTC(N,N-ジエチルジチオカルバミド酸ナトリウム)、APDC(ピロリジン-N-ジチオカルバミド酸アンモニウム)等があり、いずれも多くの金属イオンと錯体を作り、有機溶媒に抽出される。有機溶媒には、四塩化炭素、クロロホルム、酢酸ブチル、MIBK(イソブチルメチルケトン)、DIBK(ジイソブチルケトン)等がある。しかし、四塩化炭素とクロロホルムは、毒性が強く、これらの使用は望ましくない。詳しくは、別ページを参照。
電気加熱原子吸光法は、フレーム原子吸光法より高感度が得られるが、共存する酸や塩類による干渉が大きい。これを防ぐため、添加剤(マトリックスモディファイヤー)を用いて測定するが、それでもなお影響が残る。
なお、試料中目的元素を加熱して原子・気化するフレーム(空気・アセチレンガスなどによる火炎)の代わりに、電気的に加熱する方法では、一般に、黒鉛炉(円筒状でこれに電気を印加して加熱、中央部に試料を注入する小さい穴がある。)が用いられる。この際に、黒鉛の燃焼を防ぐため、炉内外にアルゴンガスを流す。黒鉛炉を均一に加熱することが難しく、原子化効率の低下やバックグランドが大きい欠点がある。これを改善するため、高融点金属(タンタルやタングステン)を用いた金属アトマイザーがある。電気加熱に比べてフレームを用いる原子吸光法の感度が低いのは、大量の火炎流による気化原子の希薄が生じるからである。
ICP発光分析法は、重金属類の分析の有力な測定法として、利用されるようになった。この方法は、精度、感度ともフレーム原子吸光法と同程度かそれ以上であり、定量範囲が広く、多元素同時分析が可能であることが、原子吸光法より優れている。ただし、フレーム原子吸光法より妨害物質の影響が強いともいわれている。
ICP発光分析法(ICP:inductively coupled plasma、誘導結合プラズマ)とは、高周波で励起されたアルゴンガスの高熱プラズマ中へ検水をキャリアーガスで導入して、物質を原子化・気化して発光させる。各元素が発する固有波長を分光・検出し、標準試料の発光量と比較して、検水中の濃度を求める。多元素・同時分析が可能である。
ICP質量分析法は、ICP発光分析法よりはるかに高感度の重金属類の分析法として、最近、普及しつつある。ICP質量分析は、プラズマをイオン源とする質量分析計で、高感度、同時多元素分析が可能である。
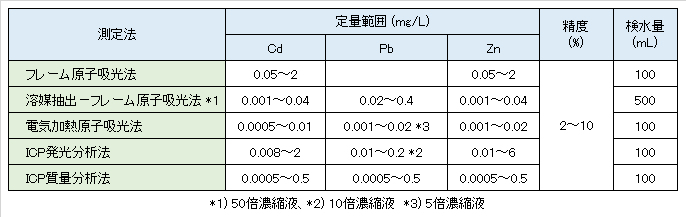
Cd、Pb、Znについての公的な測定方法の概要を表Ⅳ-1に示す。
<JIS K 0102 の検索・閲覧の方法>:別ページに記載してある。
フレーム原子吸光法は、比較的操作が容易で精度も優れているため、古くから、重金属類の分析法の主流となっている。この分析法により、人の健康の保護に関する環境基準値の1/10の低濃度(0.001mg/L)まで測定するためには、目的元素を検水から分離・濃縮する必要がある。特に、PbはCdやZnと比べて感度が悪い。環境基準値レベルの測定を十分に満足させるためには、水中濃度の低い重金属の分離・濃縮に対して、次に示す溶媒抽出法が広く用いられている。
溶媒抽出法に用いるキレート剤には、ジチゾン、DDTC(N,N-ジエチルジチオカルバミド酸ナトリウム)、APDC(ピロリジン-N-ジチオカルバミド酸アンモニウム)等があり、いずれも多くの金属イオンと錯体を作り、有機溶媒に抽出される。有機溶媒には、四塩化炭素、クロロホルム、酢酸ブチル、MIBK(イソブチルメチルケトン)、DIBK(ジイソブチルケトン)等がある。しかし、四塩化炭素とクロロホルムは、毒性が強く、これらの使用は望ましくない。詳しくは、別ページを参照。
電気加熱原子吸光法は、フレーム原子吸光法より高感度が得られるが、共存する酸や塩類による干渉が大きい。これを防ぐため、添加剤(マトリックスモディファイヤー)を用いて測定するが、それでもなお影響が残る。
なお、試料中目的元素を加熱して原子・気化するフレーム(空気・アセチレンガスなどによる火炎)の代わりに、電気的に加熱する方法では、一般に、黒鉛炉(円筒状でこれに電気を印加して加熱、中央部に試料を注入する小さい穴がある。)が用いられる。この際に、黒鉛の燃焼を防ぐため、炉内外にアルゴンガスを流す。黒鉛炉を均一に加熱することが難しく、原子化効率の低下やバックグランドが大きい欠点がある。これを改善するため、高融点金属(タンタルやタングステン)を用いた金属アトマイザーがある。電気加熱に比べてフレームを用いる原子吸光法の感度が低いのは、大量の火炎流による気化原子の希薄が生じるからである。
ICP発光分析法は、重金属類の分析の有力な測定法として、利用されるようになった。この方法は、精度、感度ともフレーム原子吸光法と同程度かそれ以上であり、定量範囲が広く、多元素同時分析が可能であることが、原子吸光法より優れている。ただし、フレーム原子吸光法より妨害物質の影響が強いともいわれている。
ICP発光分析法(ICP:inductively coupled plasma、誘導結合プラズマ)とは、高周波で励起されたアルゴンガスの高熱プラズマ中へ検水をキャリアーガスで導入して、物質を原子化・気化して発光させる。各元素が発する固有波長を分光・検出し、標準試料の発光量と比較して、検水中の濃度を求める。多元素・同時分析が可能である。
ICP質量分析法は、ICP発光分析法よりはるかに高感度の重金属類の分析法として、最近、普及しつつある。ICP質量分析は、プラズマをイオン源とする質量分析計で、高感度、同時多元素分析が可能である。
Cd、Pb、Znについての公的な測定方法の概要を表Ⅳ-1に示す。
<JIS K 0102 の検索・閲覧の方法>:別ページに記載してある。
2.各測定方法の概要
(1)フレーム原子吸光法
検水を前処理した後、0.1〜1mLの塩酸または硝酸酸性としたものを、アセチレン-空気フレーム中に噴霧し、下記に示す各元素の特定波長の原子吸光を測定し、前もって作成した検量線からその濃度を求める。
(2)溶媒抽出-フレーム原子吸光法(DDTC-酢酸ブチル抽出法)
試料を前処理した後、DDTCまたはAPDCと金属錯体を生成させ、この錯体を酢酸ブチルなどの有機溶媒で抽出する。抽出液をそのまま、または水溶液に置き換えて、アセチレン-空気のフレーム中に噴霧し、前述の波長における各元素の原子吸光を測定し、検量線からその濃度を求める。
濃度が低い検水で、抽出操作を妨害する物質を含まない場合には、下記の溶媒抽出やキレート樹脂による分離濃縮法を適用する。溶媒抽出法では、次のいずれかを用いる。
<① DDTCによる抽出>
pH 9でDDTC抽出を行うと、多くの元素が同時に抽出される。有機溶媒は酢酸ブチルまたは4-メチル-2-ペンタノン(MIBK)または2,6-ジメチル-4-ヘプタノン(DIBK)を用いる。
<② APDCによる抽出>
pH 3.5〜4.0で硫酸アンモニウムの存在下でAPDC抽出を行うと、銅、亜鉛、カドミウム、鉛などの金属が同時に抽出される。溶媒には、MIBKまたはDIBKを用いる。
DDTCまたはAPDCによる溶媒抽出法では、空試験として検水と同量の純水に対して同一操作を行って吸光度を求め、検水の測定値を補正する。
濃度が低い検水で、抽出操作を妨害する物質を含まない場合には、下記の溶媒抽出やキレート樹脂による分離濃縮法を適用する。溶媒抽出法では、次のいずれかを用いる。
<① DDTCによる抽出>
pH 9でDDTC抽出を行うと、多くの元素が同時に抽出される。有機溶媒は酢酸ブチルまたは4-メチル-2-ペンタノン(MIBK)または2,6-ジメチル-4-ヘプタノン(DIBK)を用いる。
<② APDCによる抽出>
pH 3.5〜4.0で硫酸アンモニウムの存在下でAPDC抽出を行うと、銅、亜鉛、カドミウム、鉛などの金属が同時に抽出される。溶媒には、MIBKまたはDIBKを用いる。
DDTCまたはAPDCによる溶媒抽出法では、空試験として検水と同量の純水に対して同一操作を行って吸光度を求め、検水の測定値を補正する。
(3)電気加熱原子吸光法
前処理した検水を0.1〜1mol/Lの硝酸酸性の一定量の溶液とし、電気加熱炉に注入して原子化し、上記波長における各元素の原子吸光を測定してその濃度を求める。
<測定操作>
検水の一定量(例えば、10〜50μ)をマイクロピペットで発熱体に注入し、乾燥(100〜120℃、30〜40秒)、灰化(600〜1,000℃、30〜40秒)し、次に原子化(2,200〜2,700℃、3〜6秒)し、所定波長の吸光度を測定して各金属を定量する。少なくとも、3回測定して、測定値が合致することを確認する。
測定波長:上記フレーム原子吸光法と同じ波長
測定金属の濃度が低く、アルカリ・アルカリ土類金属イオンなどの共存物質の濃度が高く測定を妨害する場合には、キレート樹脂による分離濃縮法を利用するとよい。
<注意事項>
この方法は、共存する酸、塩などの影響を受けやすい。重金属に対して非常に高感度であり、排水の定量では大幅な希釈が必要となることが多い。測定操作に利用する水、試薬、実験器具、測定環境からの汚染に十分な注意を払う。
<測定操作>
検水の一定量(例えば、10〜50μ)をマイクロピペットで発熱体に注入し、乾燥(100〜120℃、30〜40秒)、灰化(600〜1,000℃、30〜40秒)し、次に原子化(2,200〜2,700℃、3〜6秒)し、所定波長の吸光度を測定して各金属を定量する。少なくとも、3回測定して、測定値が合致することを確認する。
測定波長:上記フレーム原子吸光法と同じ波長
測定金属の濃度が低く、アルカリ・アルカリ土類金属イオンなどの共存物質の濃度が高く測定を妨害する場合には、キレート樹脂による分離濃縮法を利用するとよい。
<注意事項>
この方法は、共存する酸、塩などの影響を受けやすい。重金属に対して非常に高感度であり、排水の定量では大幅な希釈が必要となることが多い。測定操作に利用する水、試薬、実験器具、測定環境からの汚染に十分な注意を払う。
(4)ICP発光分光分析法
前処理した検水を0.1〜0.5mol/Lの塩酸または硝酸酸性の一定量の溶液とし、試料導入部を通して誘導結合プラズマ中に噴霧し、各元素の原子発光の強度を測定してその濃度を求める。
低濃度の検水を測定する場合は超音波ネブライザーを利用する。また、アルカリ・アルカリ土類金属イオンなどの共存物質の濃度が高く、測定元素の濃度が低いときには、溶媒抽出やキレート樹脂による濃縮分離を利用する。
カドミウム、鉛、亜鉛について、JIS KO102の本法の試験方法(抜粋)を下記に示す。
低濃度の検水を測定する場合は超音波ネブライザーを利用する。また、アルカリ・アルカリ土類金属イオンなどの共存物質の濃度が高く、測定元素の濃度が低いときには、溶媒抽出やキレート樹脂による濃縮分離を利用する。
カドミウム、鉛、亜鉛について、JIS KO102の本法の試験方法(抜粋)を下記に示す。
(5)ICP質量分析法
前処理した検水に内部標準物質を加え、0.1〜0.5mol/Lの硝酸酸性の一定量の溶液を、試料導入部を通して誘導結合プラズマ中に噴霧し、各元素と内部標準物質のそれぞれの質量/荷電数(m/z)におけるイオンの電流を測定し、各元素のイオン電流と内部標準物質のイオン電流との比を求めて定量する。
カドミウム、鉛、亜鉛について、JIS K O102の本法の試験方法(抜粋)を下記に示す。
カドミウム、鉛、亜鉛について、JIS K O102の本法の試験方法(抜粋)を下記に示す。
3.測定操作の注意事項
(1)検水の保存
金属類は採水後に採水容器の壁面に吸着したり、化学的な変化をしたりして減少するので、採水後の金属類の吸着や沈殿を最小限にするために試料に硝酸を添加し、pHを2以下にして保存する。常温保存、1ヶ月が保存の目安である。
(2)前処理
前処理は、主として、共存する有機物、懸濁物質及び金属錯体の分解を目的としており、試料の状態や試験方法の種類によって選択する。前処理については、別ページに詳しく記載しているので、簡単に説明する。
➀ 有機物や懸濁物質がきわめて少ない試料 → 硝酸または塩酸による煮沸
この方法は清澄な河川水に適用する。
② 有機物が少なく、懸濁物質を含む試料 → 硝酸または塩酸による分解
この方法は、有機物が少なく、懸濁物質として水酸化物、酸化物、硫化物、リン酸塩等を含む試料に適用する。
全亜鉛を測定する場合(生活環境の保全に関する環境基準)、イミノ二酢酸キレート樹脂の固相ディスクによる濃縮操作を行ってもよい。(S46 環境告示第59号 付表9参照)
③ 酸化されにくい有機物を多く含む試料 → 硝酸-過塩素酸による分解
④ 有機物や懸濁物質を含む一般的な試料 → 硝酸-硫酸による分解
この方法で硫酸が残っていると物理干渉を受けるので、水溶液をそのまま用いるICP発光分光分析法、ICP質量分析法、フレーム原子吸光法、電気加熱原子吸光法にはできる限り用いない。
鉛については、①~③の酸分解に硫酸を用いると難溶性の硫酸鉛を生成するので利用できない。亜鉛は使用する試薬中に多量に含まれていることが多いので、純品を選び、必要によっては精製する。また、使用する器具や測定環境からの汚染にも十分に注意する必要がある。
➀ 有機物や懸濁物質がきわめて少ない試料 → 硝酸または塩酸による煮沸
この方法は清澄な河川水に適用する。
② 有機物が少なく、懸濁物質を含む試料 → 硝酸または塩酸による分解
この方法は、有機物が少なく、懸濁物質として水酸化物、酸化物、硫化物、リン酸塩等を含む試料に適用する。
全亜鉛を測定する場合(生活環境の保全に関する環境基準)、イミノ二酢酸キレート樹脂の固相ディスクによる濃縮操作を行ってもよい。(S46 環境告示第59号 付表9参照)
③ 酸化されにくい有機物を多く含む試料 → 硝酸-過塩素酸による分解
④ 有機物や懸濁物質を含む一般的な試料 → 硝酸-硫酸による分解
この方法で硫酸が残っていると物理干渉を受けるので、水溶液をそのまま用いるICP発光分光分析法、ICP質量分析法、フレーム原子吸光法、電気加熱原子吸光法にはできる限り用いない。
鉛については、①~③の酸分解に硫酸を用いると難溶性の硫酸鉛を生成するので利用できない。亜鉛は使用する試薬中に多量に含まれていることが多いので、純品を選び、必要によっては精製する。また、使用する器具や測定環境からの汚染にも十分に注意する必要がある。
4.測定方法の選定
人の健康の保護に関する環境基準、排水基準及び水道水質基準では、測定方法として、表Ⅳ-1に示す各法が指定されている。測定方法はその目的とその必要とされる濃度から選定する。
人の健康の保護に関する環境基準を測定する場合は、定められた公定法による必要がある。排水処理等で特定元素についてモニターする場合には、初期投資が低く操作が簡便な原子吸光分析法が、水道水や環境水などの多元素を測定する場合には、初期投資は高額となるが人件費や分析時間等の観点から多元素同時分析法が、それぞれ有利である。いずれの方法においても試料の適切な前処理が必要である。
環境水を例に上げると、次のような選定となる。① ICP発光分光分析法に超音波ネプライザー等をつけて用いる多元素同時分析がよい。② 高感度が必要な場合は、ICP質量分析法を用いる。③ 環境水が汚濁されている場合や塩類濃度が高い試料(海水・感潮河川水等)の場合は、妨害に強く数種類の重金属元素を同時抽出できる溶媒抽出-フレーム原子吸光法を用いる。④ 妨害物質が少ない試料の高感度測定を行う場合は、電気加熱原子吸光法を用いてとよい。⑤ 比較的濃度が高い場合は、直接噴霧フレーム原子吸光法を用いる。
人の健康の保護に関する環境基準を測定する場合は、定められた公定法による必要がある。排水処理等で特定元素についてモニターする場合には、初期投資が低く操作が簡便な原子吸光分析法が、水道水や環境水などの多元素を測定する場合には、初期投資は高額となるが人件費や分析時間等の観点から多元素同時分析法が、それぞれ有利である。いずれの方法においても試料の適切な前処理が必要である。
環境水を例に上げると、次のような選定となる。① ICP発光分光分析法に超音波ネプライザー等をつけて用いる多元素同時分析がよい。② 高感度が必要な場合は、ICP質量分析法を用いる。③ 環境水が汚濁されている場合や塩類濃度が高い試料(海水・感潮河川水等)の場合は、妨害に強く数種類の重金属元素を同時抽出できる溶媒抽出-フレーム原子吸光法を用いる。④ 妨害物質が少ない試料の高感度測定を行う場合は、電気加熱原子吸光法を用いてとよい。⑤ 比較的濃度が高い場合は、直接噴霧フレーム原子吸光法を用いる。
JIS-K0102-52.4 ICP発光分光分析法(抜粋)
試料を前処理した後、試料導入部を通して誘導結合プラズマ中に噴霧し、銅(代表元素として)による発光を波長 324.754nm で測定して銅を定量する。この方法によって表52.1に示す元素が同時定最できる。それぞれの元素ごとの測定波長、定量範囲及び繰返し精度の例を、表52.1に示す。
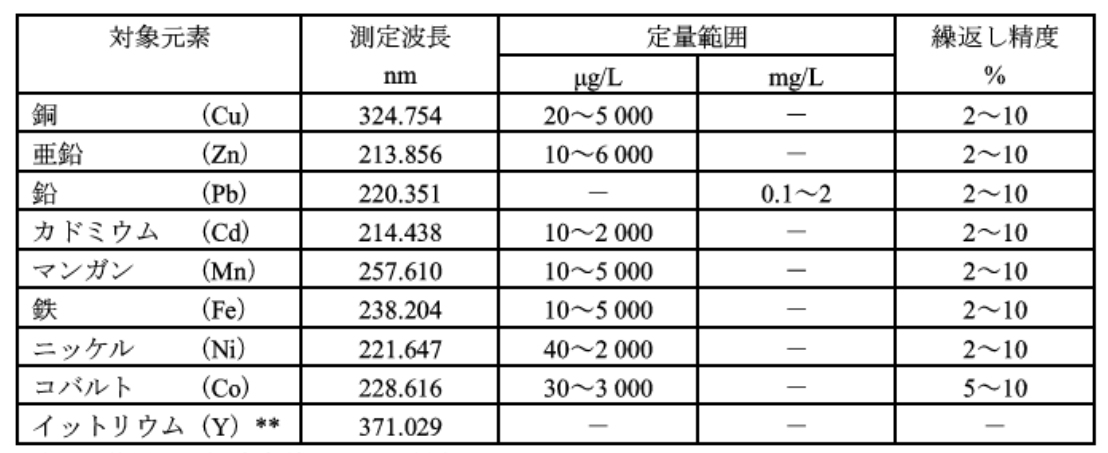
* 装置及び測定条件によって異なる。
** 内標準元素として、イットリウム(Y)のほか、インジウム(In)及びイッテルビウム(Yb)も使用できる。
a) 試 薬
試薬は、次による。
1) 銅標準液 (Cu 1mg/mL) JIS K 8005 に規定する容量分析用標準物質の銅を塩酸 (1+3) で洗い、水洗いし、JIS K 8101 に規定するエタノール (99.5) で洗い、次に、JIS K 8103 に規定するジェチルエーテルで洗った後、直ちに上口デシケーター中に入れ、2.0kPa 以下で数分間保った後、減圧ドで約12時間保つ。Cu 100%に対してその 1.00g をとり、硝酸 (1+1) 30mL 中に加え、煮沸して溶かし、窒素酸化物を追い出す。放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。
2) 銅標準液 (Cu 10μg/mL) 銅標準液 (Cu 1mg/mL) 5mLを全量フラスコ 500mL にとり、硝酸 (1+1) 10mL を加えた後、水を標線まで加える。
3) 亜鉛標準液 (Zn 1mg/mL) JIS K 8005 に規定する容量分析用標準物質の亜鉛を塩酸 (1+3) で洗い、水洗いし、JIS K 8101 に規定するエタノール (99.5)で洗い、次に、JIS K 8103 に規定するジエチルエーテルで洗った後、直ちに上口デシケーター中に入れ、圧力 2kPa 以下で数分間保った後、減圧下で約12時間保つ。 Zn 100% に対してその 1.00g をとり、硝酸 (1+1) 30mL に溶かし、煮沸して窒素酸化物を追い出す。放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。
4) 亜鉛標準液 (Zn 10μg/mL) 亜鉛標準液 (Zn 10μg/mL) 5mL を全量フラスコ 500mL にとり、硝酸 (1+1) 10mL を加えた後、水を標線まで加える。
5) 鉛標準液 (Pb 1mg/mL) JIS K 8701 に規定する鉛 (99.9%以上) 1.00g をとり、硝酸 (1+1) 30mL に溶かし、加熱して窒素酸化物を追い出す。放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。又はJIS K 8563 に規定する硝酸鉛(II) 1.60g をとり、硝酸 (1+1) 20mL 及び適量の水に溶かし、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。
6) 鉛標準液 (Pb 10μg/mL) 鉛標準液 (Pb 1mg/mL) 5mL を全量フラスコ 500mL にとり、硝酸 (1+1) 10mL を加え、水を標線まで加える。
7) カドミウム標準液(Cd 0.1 mg/mL) カドミウム (99.9%以上) 0.100g をとり、硝酸 (1+1) 20mL に溶かし、煮沸して窒素酸化物を追い出す。放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。
8) カドミウム標準液 (Cd 10μg/mL) カドミウム標準液 (Cd 0.1 mg/mL) 10mL を全量フラスコ 100mL にとり、硝酸 (1+1) 2mL を加えた後、水を標線まで加える。
9) マンガン標準液 (Mn 1mg/mL) JIS K 8247 に規定する過マンガン酸カリウム 2.88g をとり、水 150mL に硝酸 (1+1) 10mL を加えた溶液に溶かす。過酸化水素水 (1+9) (JIS K 8230 に規定する過酸化水素 10mL を水で薄めて 100mL とする。) を滴加し、かき混ぜて脱色した後、煮沸して過剰の過酸化水素を追い出す。放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。又はマンガン (99.9%以上) 1.00g をとり、硝酸 (1+3) 20mL に溶かし、煮沸して窒素酸化物を追い出す。放冷後、全最フラスコ 1,000mL に移し入れ、水を標線まで加える。
10) マンガン標準液(Mn 10μg/mL) マンガン標準液(Mn 1mg/mL) 5mL を全量フラスコ 500mL にとり、硝酸 (1 +1) 10mL を加え、水を標線まで加える。
11) 鉄標準液 (Fe 1mg/mL) 鉄 (99.5%以上) 1.000 g をとり、塩酸 (1 +1) 30mL 中に入れ、加熱して溶かし、放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。又はJIS K 8979に規定する硫酸アンモニウム鉄(Ⅱ)六水和物[ビス(硫酸)鉄(Ⅱ)アンモニウム六水和物]7.02g をとり、塩酸 (1+1) 20mL 及び適量の水に溶かし、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。
12) 鉄標準液 (Fe 0.1mg/mL) 鉄標準液 (Fe 1mg/mL) 10mL を全量フラスコ 100mL にとり、塩酸 (1+1) 2mLを加えた後、水を標線まで加える。
13) 鉄標準液 (Fe 10μg/mL) 鉄標準液 (Fe 0.1mg/mL) 10mL を全量フラスコ 100mL にとり、塩酸 (1+1) 2mLを加えた後、水を標線まで加える。
14) ニッケル標準液(Ni 0.1mg/mL) JIS K 9062 に規定するニッケル(99.9%以卜) 0.100g をとり、硝酸 (1+1) 20mL に溶かし、煮沸して窒素酸化物を追い出す。放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。
15) ニッケル標準液(Ni 10μg/mL) ニッケル標準液(Ni 0.1mg/mL) 10mL を全敬フラスコ 100mL にとり、硝酸 (1+1) 2mLを加えた後、水を標線まで加える。
16) コバルト標準液(Co 0.1mg/mL) コバルト(99.5‰以上) 0.100gをとり、硝酸 (1+1) 20mLに溶かし、煮沸して窒素酸化物を追い出す。放冷後、全量フラスコ 1,000 mL に移し入れ、水を標線まで加える。
17) コバルト標準液 (Co 10μg/mL) コバルト標準液 (Co 0.1mg/mL) 10mL を全量フラスコ 100mL にとり、硝酸 (1+1) 2mL を加え、水を標線まで加える。
1) 銅標準液 (Cu 1mg/mL) JIS K 8005 に規定する容量分析用標準物質の銅を塩酸 (1+3) で洗い、水洗いし、JIS K 8101 に規定するエタノール (99.5) で洗い、次に、JIS K 8103 に規定するジェチルエーテルで洗った後、直ちに上口デシケーター中に入れ、2.0kPa 以下で数分間保った後、減圧ドで約12時間保つ。Cu 100%に対してその 1.00g をとり、硝酸 (1+1) 30mL 中に加え、煮沸して溶かし、窒素酸化物を追い出す。放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。
2) 銅標準液 (Cu 10μg/mL) 銅標準液 (Cu 1mg/mL) 5mLを全量フラスコ 500mL にとり、硝酸 (1+1) 10mL を加えた後、水を標線まで加える。
3) 亜鉛標準液 (Zn 1mg/mL) JIS K 8005 に規定する容量分析用標準物質の亜鉛を塩酸 (1+3) で洗い、水洗いし、JIS K 8101 に規定するエタノール (99.5)で洗い、次に、JIS K 8103 に規定するジエチルエーテルで洗った後、直ちに上口デシケーター中に入れ、圧力 2kPa 以下で数分間保った後、減圧下で約12時間保つ。 Zn 100% に対してその 1.00g をとり、硝酸 (1+1) 30mL に溶かし、煮沸して窒素酸化物を追い出す。放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。
4) 亜鉛標準液 (Zn 10μg/mL) 亜鉛標準液 (Zn 10μg/mL) 5mL を全量フラスコ 500mL にとり、硝酸 (1+1) 10mL を加えた後、水を標線まで加える。
5) 鉛標準液 (Pb 1mg/mL) JIS K 8701 に規定する鉛 (99.9%以上) 1.00g をとり、硝酸 (1+1) 30mL に溶かし、加熱して窒素酸化物を追い出す。放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。又はJIS K 8563 に規定する硝酸鉛(II) 1.60g をとり、硝酸 (1+1) 20mL 及び適量の水に溶かし、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。
6) 鉛標準液 (Pb 10μg/mL) 鉛標準液 (Pb 1mg/mL) 5mL を全量フラスコ 500mL にとり、硝酸 (1+1) 10mL を加え、水を標線まで加える。
7) カドミウム標準液(Cd 0.1 mg/mL) カドミウム (99.9%以上) 0.100g をとり、硝酸 (1+1) 20mL に溶かし、煮沸して窒素酸化物を追い出す。放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。
8) カドミウム標準液 (Cd 10μg/mL) カドミウム標準液 (Cd 0.1 mg/mL) 10mL を全量フラスコ 100mL にとり、硝酸 (1+1) 2mL を加えた後、水を標線まで加える。
9) マンガン標準液 (Mn 1mg/mL) JIS K 8247 に規定する過マンガン酸カリウム 2.88g をとり、水 150mL に硝酸 (1+1) 10mL を加えた溶液に溶かす。過酸化水素水 (1+9) (JIS K 8230 に規定する過酸化水素 10mL を水で薄めて 100mL とする。) を滴加し、かき混ぜて脱色した後、煮沸して過剰の過酸化水素を追い出す。放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。又はマンガン (99.9%以上) 1.00g をとり、硝酸 (1+3) 20mL に溶かし、煮沸して窒素酸化物を追い出す。放冷後、全最フラスコ 1,000mL に移し入れ、水を標線まで加える。
10) マンガン標準液(Mn 10μg/mL) マンガン標準液(Mn 1mg/mL) 5mL を全量フラスコ 500mL にとり、硝酸 (1 +1) 10mL を加え、水を標線まで加える。
11) 鉄標準液 (Fe 1mg/mL) 鉄 (99.5%以上) 1.000 g をとり、塩酸 (1 +1) 30mL 中に入れ、加熱して溶かし、放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。又はJIS K 8979に規定する硫酸アンモニウム鉄(Ⅱ)六水和物[ビス(硫酸)鉄(Ⅱ)アンモニウム六水和物]7.02g をとり、塩酸 (1+1) 20mL 及び適量の水に溶かし、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。
12) 鉄標準液 (Fe 0.1mg/mL) 鉄標準液 (Fe 1mg/mL) 10mL を全量フラスコ 100mL にとり、塩酸 (1+1) 2mLを加えた後、水を標線まで加える。
13) 鉄標準液 (Fe 10μg/mL) 鉄標準液 (Fe 0.1mg/mL) 10mL を全量フラスコ 100mL にとり、塩酸 (1+1) 2mLを加えた後、水を標線まで加える。
14) ニッケル標準液(Ni 0.1mg/mL) JIS K 9062 に規定するニッケル(99.9%以卜) 0.100g をとり、硝酸 (1+1) 20mL に溶かし、煮沸して窒素酸化物を追い出す。放冷後、全量フラスコ 1,000mL に移し入れ、水を標線まで加える。
15) ニッケル標準液(Ni 10μg/mL) ニッケル標準液(Ni 0.1mg/mL) 10mL を全敬フラスコ 100mL にとり、硝酸 (1+1) 2mLを加えた後、水を標線まで加える。
16) コバルト標準液(Co 0.1mg/mL) コバルト(99.5‰以上) 0.100gをとり、硝酸 (1+1) 20mLに溶かし、煮沸して窒素酸化物を追い出す。放冷後、全量フラスコ 1,000 mL に移し入れ、水を標線まで加える。
17) コバルト標準液 (Co 10μg/mL) コバルト標準液 (Co 0.1mg/mL) 10mL を全量フラスコ 100mL にとり、硝酸 (1+1) 2mL を加え、水を標線まで加える。
b) 装 置
装置は、次による。
1) ICP発光分光分析装置
備考9. 試料の噴霧に超音波ネブライザー又はこれと同等の性能をもったものを用いてもよい。この場合は、定量下限値を1桁程度下げることができる。ただし、メモリー効果に注意し、十分に洗浄を行う。
1) ICP発光分光分析装置
備考9. 試料の噴霧に超音波ネブライザー又はこれと同等の性能をもったものを用いてもよい。この場合は、定量下限値を1桁程度下げることができる。ただし、メモリー効果に注意し、十分に洗浄を行う。
c) 準備操作
準備操作は、次による。
試料を 5.5によって処理する、
備考10. 試料の銅又は測定対象元素の濃度が低い試料で、アルカリ金属イオン、アルカリ士類金属イオンなどの共存物質の濃度が高く、測定を妨害する場合の準備操作は、次の 1)~3)の操作によるか、又は備考6.による。次の準備操作は、亜鉛、鉛、カドミウム、マンガン、鉄、ニッケル、コバルト、モリブデン及びバナジウムの定量にも使用できる。
1) 試料 500mL (又は 100~500mL の一定量)をビーカーにとり、JIS K 8180 に規定する塩酸 5mLを加え、約5分間煮沸する。
2) 放冷後、酢酸一酢酸ナトリウム緩衝液 (pH 5) (JIS K 8371 に規定する酢酸ナトリウム三水和物 19.2gとJIS K 8355 に規定する酢酸 3.4mLとを水に溶かして 1L とする。) (*12) 10mL を加え、アンモニア 水 (1+1) (JIS K 8085 に規定するアンモニア水を用いて調製する。) 又は硝酸 (1+10) (JIS K 8541 に規定する硝酸を用いて調製する。)で pH を 5.2 に調整する。
注(*12) この操作に用いる酢酸一酢酸ナトリウム緩衝液 (pH 5) は使用前に1-ビロリジンカルボジチオ酸アンモニウム溶液、ヘキサメチレンアンモニウム-ヘキサメチレンカルバモジチオ酸(ヘキサメチレンアンモニウム-ヘキサメチレンジチオカルバミド酸)のメタノール溶液、JIS K 8271 に規定するキシレンとを加えて振り混ぜ、精製する。
3) この溶液を分液漏斗 1,000mL (又は 200~500mL) に移し、1-ピロリジンカルボジチオ酸アンモニウム溶液(20 g/L) 2mL とヘキサメチレンアンモニウムーヘキサメチレンカルバモジチオ酸 (HMA-HMDC) のメタノール溶液 (20 g/L) 2mL とを加えて混合した後、JIS K 8271 に規定するキシレンの一定量 (5~20mL) を加えて約5分間激しく振り混ぜて静置する。水層を捨てキシレン層を共栓試験管に入れる。定量操作は、備考12.による。
試料を 5.5によって処理する、
備考10. 試料の銅又は測定対象元素の濃度が低い試料で、アルカリ金属イオン、アルカリ士類金属イオンなどの共存物質の濃度が高く、測定を妨害する場合の準備操作は、次の 1)~3)の操作によるか、又は備考6.による。次の準備操作は、亜鉛、鉛、カドミウム、マンガン、鉄、ニッケル、コバルト、モリブデン及びバナジウムの定量にも使用できる。
1) 試料 500mL (又は 100~500mL の一定量)をビーカーにとり、JIS K 8180 に規定する塩酸 5mLを加え、約5分間煮沸する。
2) 放冷後、酢酸一酢酸ナトリウム緩衝液 (pH 5) (JIS K 8371 に規定する酢酸ナトリウム三水和物 19.2gとJIS K 8355 に規定する酢酸 3.4mLとを水に溶かして 1L とする。) (*12) 10mL を加え、アンモニア 水 (1+1) (JIS K 8085 に規定するアンモニア水を用いて調製する。) 又は硝酸 (1+10) (JIS K 8541 に規定する硝酸を用いて調製する。)で pH を 5.2 に調整する。
注(*12) この操作に用いる酢酸一酢酸ナトリウム緩衝液 (pH 5) は使用前に1-ビロリジンカルボジチオ酸アンモニウム溶液、ヘキサメチレンアンモニウム-ヘキサメチレンカルバモジチオ酸(ヘキサメチレンアンモニウム-ヘキサメチレンジチオカルバミド酸)のメタノール溶液、JIS K 8271 に規定するキシレンとを加えて振り混ぜ、精製する。
3) この溶液を分液漏斗 1,000mL (又は 200~500mL) に移し、1-ピロリジンカルボジチオ酸アンモニウム溶液(20 g/L) 2mL とヘキサメチレンアンモニウムーヘキサメチレンカルバモジチオ酸 (HMA-HMDC) のメタノール溶液 (20 g/L) 2mL とを加えて混合した後、JIS K 8271 に規定するキシレンの一定量 (5~20mL) を加えて約5分間激しく振り混ぜて静置する。水層を捨てキシレン層を共栓試験管に入れる。定量操作は、備考12.による。
d) 操 作
操作は、次による。
1) c)1)の準備操作を行った試料を試料導入部を通して発光部に導入し(11) (12)、各測定対象元素の波長の発光強度を測定する(13) (14)。
2) 空試験として e)1)の準備操作で用いた試料と同量の水をとり、e)1)及び 1)の操作を行って各測定対象元素に相当する発光強度を測定し、試料について得た発光強度を補正する。
3) 検量線から各測定対象元素の量を求め、試料中の各元素の濃度(μg/L)を算出する(15)。
注(11) 試料の測定を始める前に、硝酸 (1+20) (JIS K 8541 に規定する硝酸を用いて調製する。)を噴霧して測定系を洗い流す。また、各試料測定の間にも洗い流しを行う。
注(12) 備考11.による。
注(13) 47.の注(8)による。
注(14) 47.の注(9)による。
注(15) 50.の注(11)による。
1) c)1)の準備操作を行った試料を試料導入部を通して発光部に導入し(11) (12)、各測定対象元素の波長の発光強度を測定する(13) (14)。
2) 空試験として e)1)の準備操作で用いた試料と同量の水をとり、e)1)及び 1)の操作を行って各測定対象元素に相当する発光強度を測定し、試料について得た発光強度を補正する。
3) 検量線から各測定対象元素の量を求め、試料中の各元素の濃度(μg/L)を算出する(15)。
注(11) 試料の測定を始める前に、硝酸 (1+20) (JIS K 8541 に規定する硝酸を用いて調製する。)を噴霧して測定系を洗い流す。また、各試料測定の間にも洗い流しを行う。
注(12) 備考11.による。
注(13) 47.の注(8)による。
注(14) 47.の注(9)による。
注(15) 50.の注(11)による。
e) 検量線
検量線の作成は、次による。
1) a)の測定対象元素の各標準液のそれぞれ一定量をとり、希釈して一定量として混合標準液を調製する。この混合標準液は、測定対象の元素を含み(16)、測定する濃度範囲よりも高い濃度(17)とする。
2) 全量フラスコ 100mL に、測定濃度範囲を含むように、混合標準液を段階的にとり、c)1)の試料と同じ酸の濃度となるように硝酸 (1+1) (18) を加えた後、水を標線まで加える。
3) 2)で調製した各溶液について d)1)の操作を行う。
4) 空試験として、全量フラスコ 100mL に c)1)の試料と同じ酸の濃度となるように硝酸 (1+1) を加え、水を標線まで加えた溶液について、d)1)の操作を行い、3)で得た発光強度を補正する。
5) 各測定対象元素について、それぞれの元素の量と発光強度との関係線を作成する。
注(16) 測定対象の単独又は限られた複数の元素だけでもよい。
注(17) 作成する検量線の最高濃度の 5~10倍 程度。
注(18) 又は塩酸 (1十I) 。ただし、指定されている場合はそれに従う。
備考11. 波長の異なる2本以上のスペクトル線の同時測定が可能な装置では、内標準法によることができる。操作は、次による。なお、内標準元素は、イットリウム (Y) のほか、インジウム (Ln) 及びイッテルビウム (Yb) も使用できる。
1) c)1)で処理した試料の適量を全量フラスコ 100mL にとり、イットリウム溶液 (Y 50μg/mL) [47.の備考5.6による。] 10mL を加えた後、水を標線まで加える。
2) この溶液について d)1)の操作を行って各測定対象元素の発光強度及びイットリウムの発光強度を測定し、各測定対象元素の発光強度とイットリウムの発光強度との比を求める。
3) 空試験として、試料に代えて同量の水を用い、c)1)、1)及び 2)の操作を行い、各測定対象元素の発光強度とイットリウムの発光強度との比を求め、2)で得た発光強度比を補正する。
4) 各測定対象元素についての検量線から、各測定対象元素の量を求め、試料中の各測定対象元素の濃度 (mg/L) を算出する。
5) 検量線 全量フラスコ 100mL 数個に e)2)に従って混合標準液を段階的にとり、イットリウム溶液 (Y 50μg/mL) 10mL 及び 1)の試料と同じ酸の濃度となるように硝酸 (1+1) (*) を加えた後、水を標線まで加える。この溶液について 2)の操作を行い、各測定対象元素及びイットリウムの発光強度を測定し、各測定対象元素の発光強度とイットリウムの発光強度との比を求め、別に、空試験として、混合標準液に代えて水を用い、同じ操作を行って、同様に発光強度の比を求め、混合標準液での各測定対象元素の発光強度比を補正し、各測定対象元素の量と、各測定対象元素の発光強度とイットリウムの発光強度との比との関係線を作成する。
注(*) 注(18)による。
備考12 備考10.の 1)~3)によって準備操作を行った場合は、キシレン層をそのまま噴霧して測定対象の各元素の発光強度を測定して定量する。その場合の検量線の作成は、次による。
1) e)1)に準じ、測定対象元素を含む混合標準液を調製する。ただし、各測定対象元素は e)1)の混合標準液よりも低濃度(0.1~1μg/mL)とする。
2) 調製した混合標準液を段階的にとり、水で 500mL とし、備考10.の 1)~3)の操作及び各測定対象元素の発光強度の測定操作を行う。
3) 空試験として、水 500mL を用いて、2)の操作を行い、2)で得た各測定対象元素の発光強度を補正し、各測定対象元素の量とその発光強度との関係線を作成する。
1) a)の測定対象元素の各標準液のそれぞれ一定量をとり、希釈して一定量として混合標準液を調製する。この混合標準液は、測定対象の元素を含み(16)、測定する濃度範囲よりも高い濃度(17)とする。
2) 全量フラスコ 100mL に、測定濃度範囲を含むように、混合標準液を段階的にとり、c)1)の試料と同じ酸の濃度となるように硝酸 (1+1) (18) を加えた後、水を標線まで加える。
3) 2)で調製した各溶液について d)1)の操作を行う。
4) 空試験として、全量フラスコ 100mL に c)1)の試料と同じ酸の濃度となるように硝酸 (1+1) を加え、水を標線まで加えた溶液について、d)1)の操作を行い、3)で得た発光強度を補正する。
5) 各測定対象元素について、それぞれの元素の量と発光強度との関係線を作成する。
注(16) 測定対象の単独又は限られた複数の元素だけでもよい。
注(17) 作成する検量線の最高濃度の 5~10倍 程度。
注(18) 又は塩酸 (1十I) 。ただし、指定されている場合はそれに従う。
備考11. 波長の異なる2本以上のスペクトル線の同時測定が可能な装置では、内標準法によることができる。操作は、次による。なお、内標準元素は、イットリウム (Y) のほか、インジウム (Ln) 及びイッテルビウム (Yb) も使用できる。
1) c)1)で処理した試料の適量を全量フラスコ 100mL にとり、イットリウム溶液 (Y 50μg/mL) [47.の備考5.6による。] 10mL を加えた後、水を標線まで加える。
2) この溶液について d)1)の操作を行って各測定対象元素の発光強度及びイットリウムの発光強度を測定し、各測定対象元素の発光強度とイットリウムの発光強度との比を求める。
3) 空試験として、試料に代えて同量の水を用い、c)1)、1)及び 2)の操作を行い、各測定対象元素の発光強度とイットリウムの発光強度との比を求め、2)で得た発光強度比を補正する。
4) 各測定対象元素についての検量線から、各測定対象元素の量を求め、試料中の各測定対象元素の濃度 (mg/L) を算出する。
5) 検量線 全量フラスコ 100mL 数個に e)2)に従って混合標準液を段階的にとり、イットリウム溶液 (Y 50μg/mL) 10mL 及び 1)の試料と同じ酸の濃度となるように硝酸 (1+1) (*) を加えた後、水を標線まで加える。この溶液について 2)の操作を行い、各測定対象元素及びイットリウムの発光強度を測定し、各測定対象元素の発光強度とイットリウムの発光強度との比を求め、別に、空試験として、混合標準液に代えて水を用い、同じ操作を行って、同様に発光強度の比を求め、混合標準液での各測定対象元素の発光強度比を補正し、各測定対象元素の量と、各測定対象元素の発光強度とイットリウムの発光強度との比との関係線を作成する。
注(*) 注(18)による。
備考12 備考10.の 1)~3)によって準備操作を行った場合は、キシレン層をそのまま噴霧して測定対象の各元素の発光強度を測定して定量する。その場合の検量線の作成は、次による。
1) e)1)に準じ、測定対象元素を含む混合標準液を調製する。ただし、各測定対象元素は e)1)の混合標準液よりも低濃度(0.1~1μg/mL)とする。
2) 調製した混合標準液を段階的にとり、水で 500mL とし、備考10.の 1)~3)の操作及び各測定対象元素の発光強度の測定操作を行う。
3) 空試験として、水 500mL を用いて、2)の操作を行い、2)で得た各測定対象元素の発光強度を補正し、各測定対象元素の量とその発光強度との関係線を作成する。
JIS K 0102-52.5 ICP質量分析法 [抜粋]
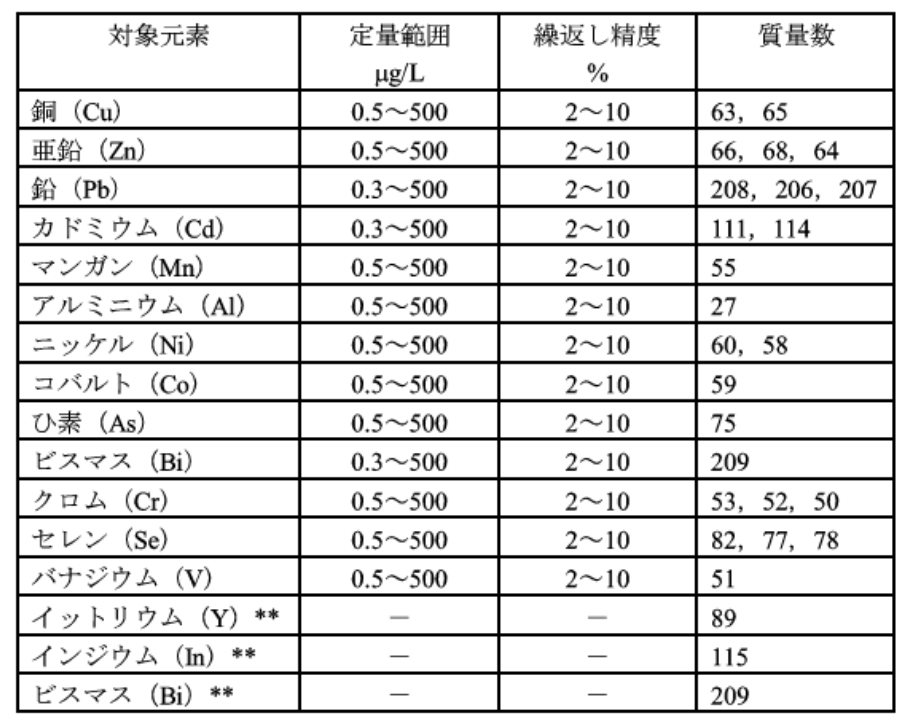
試料を前処理した後、内標準元素を加え、試料導入部を通して高周波プラズマ中に噴霧し、銅(代表元素として)及び内標準元素のそれぞれの質量/電荷数における指示値 (19) を測定し、銅の指示値と内標準元素の指示値との比を求めて銅を定量する。この方法によって、表52.2に示す元素が同時定量できる。それぞれの元素ごとの定量範囲、繰返し精度などの例を、表52.2に示す。
注(19) イオンカウント値、又はその比例値
注(19) イオンカウント値、又はその比例値
* 装置及び測定条件によって異なる。** 内標準元素
a) 試薬
試薬は、次による。
1) 水 52.3-a)1) による。
2) 硝酸 (1+1) 52.3-a)2) による。
3) 内標準液 (1μg/mL)
内標準元素としてイットリウム、インジウム又はビスマスを用いる。内標準液の調製には、次の 3.1)~3.3)に規定する溶液のうち内標準とする元素の溶液 2mL を全量プラスコ 100mL にとり、硝酸 (1+1) 2mL を加え、水を標線まで加える。使用時に調製する(20) (21)。
3.1) イットリウム溶液 (Y 50μg/mL) 47.の備考5.6)による。
3.2) インジウム溶液 (In 50μg/mL) 47.4-a)2.2)による。
3.3) ビスマス溶液 (Bi 50μg/mL) 酸化ビスマス(Ⅲ) 0.279g をとり、硝酸 (1+1) 10mL を加え、加熱して溶かし、放冷後、全量フラスコ 250mL に移し入れ、水を標線まで加える。この溶液 25mL を全量フラスコ 500mL にとり、硝酸 (1+1) 10mL を加え、水を標線まで加える。
4) 混合標準液 (A) [(Cu 10μg、Zn 10μg、Pb 10μg、Cd 10μg、Mn 10μg、Al 10μg、Ni 10μg、Co 10μg、As 10μg、Bi 10μg、Cr 10μg、Se 10μg、V 10μg)/mL](16) (21)
52.4-a)の1) 銅標準液 (Cu 1mg/mL)、3) 亜鉛標準液 (Zn 1mg/L)、5) 鉛標準液 (Pb 1mg/mL)、9) マンガン標準液 (Mn 1mg/mL) のそれぞれ 5mL、58.2-a)の2) アルミニウム標準液 (Al 0.5mg/L) 10mL、及び、67.1-a)の11) セレン標準液 (Se 0.2mg/mL) 25mL、並びに、52.4-a)の7) カドミウム標準液 (Cd 0.1mg/mL)、14) ニッケル標準液 (Ni 0.1mg/mL)、16) コバルト標準液 (Co 0.1mg/mL)、58.4-a)の3) クロム標準液 (Cr 0.1mg/mL)、7) バナジウム標準液 (V 0.1mg/mL)、61.1-a)の12) ひ素標準液 (As 0.1mg/mL)、64.1-a)の5) ビスマス標準液 (Bi 0.1mg/mL) のそれぞれ 50mL、を全量フラスコ 500mLにとり、硝酸 (1+1) 10mL を加えた後、水を標線まで加える(22)。
5) 混合標準液 (B) [(Cu 0.5μg、Zn 0.5μg、Pb 0.5μg、Cd 0.5μg、Mn 0.5μg、Al 0.5μg、Ni 0.5μg、Co 0.5μg、As 0.5μg、Bi 0.5μg、Cr 0.5μg、Se 0.5μg、V 0.5μg)/mL](16) (21)
4)の混合標準液 (A) 5mL を全量フラスコ 100 mL にとり、硝酸 (1+1) 2mL を加え、水を標線まで加える。使用時に調製する。
注(20) 3種類の内標準元素は、単独又は混合して用いてもよい。ICP質量分析法では、主成分(マトリックス)による非スペクトル干渉の大きさは質量数に依存するため、測定対象元素と比較的質量数の近いものを内標準元素とするとよい。ここに挙げた3種類以外にも、元の試料に無視できる量より少ない量しか含まれていないことが確認できれば、内標準元素として用いてもよい。ビスマスが測定対象元素であるときは、内標準元素としてビスマスを用いることはできない。ビスマスの代わりにタリウムを用いることがある。
注(21) 定期的に濃度の安定性を、新たに調製した標準液と比較して確認する。特に、濃度の低い標準液は濃度が低下しやすいため注意する。
注(22) 標準液は、混合したときに沈殿を生じないものを用いる。
1) 水 52.3-a)1) による。
2) 硝酸 (1+1) 52.3-a)2) による。
3) 内標準液 (1μg/mL)
内標準元素としてイットリウム、インジウム又はビスマスを用いる。内標準液の調製には、次の 3.1)~3.3)に規定する溶液のうち内標準とする元素の溶液 2mL を全量プラスコ 100mL にとり、硝酸 (1+1) 2mL を加え、水を標線まで加える。使用時に調製する(20) (21)。
3.1) イットリウム溶液 (Y 50μg/mL) 47.の備考5.6)による。
3.2) インジウム溶液 (In 50μg/mL) 47.4-a)2.2)による。
3.3) ビスマス溶液 (Bi 50μg/mL) 酸化ビスマス(Ⅲ) 0.279g をとり、硝酸 (1+1) 10mL を加え、加熱して溶かし、放冷後、全量フラスコ 250mL に移し入れ、水を標線まで加える。この溶液 25mL を全量フラスコ 500mL にとり、硝酸 (1+1) 10mL を加え、水を標線まで加える。
4) 混合標準液 (A) [(Cu 10μg、Zn 10μg、Pb 10μg、Cd 10μg、Mn 10μg、Al 10μg、Ni 10μg、Co 10μg、As 10μg、Bi 10μg、Cr 10μg、Se 10μg、V 10μg)/mL](16) (21)
52.4-a)の1) 銅標準液 (Cu 1mg/mL)、3) 亜鉛標準液 (Zn 1mg/L)、5) 鉛標準液 (Pb 1mg/mL)、9) マンガン標準液 (Mn 1mg/mL) のそれぞれ 5mL、58.2-a)の2) アルミニウム標準液 (Al 0.5mg/L) 10mL、及び、67.1-a)の11) セレン標準液 (Se 0.2mg/mL) 25mL、並びに、52.4-a)の7) カドミウム標準液 (Cd 0.1mg/mL)、14) ニッケル標準液 (Ni 0.1mg/mL)、16) コバルト標準液 (Co 0.1mg/mL)、58.4-a)の3) クロム標準液 (Cr 0.1mg/mL)、7) バナジウム標準液 (V 0.1mg/mL)、61.1-a)の12) ひ素標準液 (As 0.1mg/mL)、64.1-a)の5) ビスマス標準液 (Bi 0.1mg/mL) のそれぞれ 50mL、を全量フラスコ 500mLにとり、硝酸 (1+1) 10mL を加えた後、水を標線まで加える(22)。
5) 混合標準液 (B) [(Cu 0.5μg、Zn 0.5μg、Pb 0.5μg、Cd 0.5μg、Mn 0.5μg、Al 0.5μg、Ni 0.5μg、Co 0.5μg、As 0.5μg、Bi 0.5μg、Cr 0.5μg、Se 0.5μg、V 0.5μg)/mL](16) (21)
4)の混合標準液 (A) 5mL を全量フラスコ 100 mL にとり、硝酸 (1+1) 2mL を加え、水を標線まで加える。使用時に調製する。
注(20) 3種類の内標準元素は、単独又は混合して用いてもよい。ICP質量分析法では、主成分(マトリックス)による非スペクトル干渉の大きさは質量数に依存するため、測定対象元素と比較的質量数の近いものを内標準元素とするとよい。ここに挙げた3種類以外にも、元の試料に無視できる量より少ない量しか含まれていないことが確認できれば、内標準元素として用いてもよい。ビスマスが測定対象元素であるときは、内標準元素としてビスマスを用いることはできない。ビスマスの代わりにタリウムを用いることがある。
注(21) 定期的に濃度の安定性を、新たに調製した標準液と比較して確認する。特に、濃度の低い標準液は濃度が低下しやすいため注意する。
注(22) 標準液は、混合したときに沈殿を生じないものを用いる。
b) 装置
装置は、次による。
1) ICP質量分析装置
備考12. イオン源として、高周波プラズマと同等の性能をもつものを用いてもよい。
備考13. 試料の噴霧に超音波ネブライザー又はこれと同等の性能をもったものを用いてもよい。この場合は、定量下限値を1桁程度上げることができる。ただし、メモリー効果に注意し、十分に洗浄を行う。
備考14. サンプリングコーン及びスキマーコーンの材質からの汚染が認められないことを確認する。
1) ICP質量分析装置
備考12. イオン源として、高周波プラズマと同等の性能をもつものを用いてもよい。
備考13. 試料の噴霧に超音波ネブライザー又はこれと同等の性能をもったものを用いてもよい。この場合は、定量下限値を1桁程度上げることができる。ただし、メモリー効果に注意し、十分に洗浄を行う。
備考14. サンプリングコーン及びスキマーコーンの材質からの汚染が認められないことを確認する。
c) 準備操作
準備操作は、次による(23)。
1) 試料を 5.5によって処理する。ただし、クロムを定量する場合は、前処理に 5.3は用いない。
2) 1)で処理した試料の適量(測定対象元素として 0.05~50μg を含む。)を全量フラスコ 100 mL にとり、内標準液 (1μg/mL) 1mL を加え、硝酸の最終濃度が 0.1~0.5mol/L となるように硝酸 (1+1) を加えた後、水を標線まで加える。
注(23) 分析者からの汚染がないように注意する。JIS T 9107 に規定する使い捨て手術用ゴム手袋(打粉のないもの)などを用いるとよい。
備考15. 試料の銅又は洲定対象元素の濃度が低い試料で、アルカリ金属イオン、アルカリ土類金属イオンなどの共存物質の濃度が高く、測定を妨害する場合の準備操作は、備考6.による。ただし、3.6)は除く。得られた液は全量フラスコ 20mL に移し入れ、内標準液 (1μg/mL) 0.2mL を加え、標線まで水を加える。
1) 試料を 5.5によって処理する。ただし、クロムを定量する場合は、前処理に 5.3は用いない。
2) 1)で処理した試料の適量(測定対象元素として 0.05~50μg を含む。)を全量フラスコ 100 mL にとり、内標準液 (1μg/mL) 1mL を加え、硝酸の最終濃度が 0.1~0.5mol/L となるように硝酸 (1+1) を加えた後、水を標線まで加える。
注(23) 分析者からの汚染がないように注意する。JIS T 9107 に規定する使い捨て手術用ゴム手袋(打粉のないもの)などを用いるとよい。
備考15. 試料の銅又は洲定対象元素の濃度が低い試料で、アルカリ金属イオン、アルカリ土類金属イオンなどの共存物質の濃度が高く、測定を妨害する場合の準備操作は、備考6.による。ただし、3.6)は除く。得られた液は全量フラスコ 20mL に移し入れ、内標準液 (1μg/mL) 0.2mL を加え、標線まで水を加える。
d) 操 作
操作は、次による(24)。
1) ICP質量分析装置を作動できる状態にし、e)2)の溶液を試料導入部を通してイオン化部に導入して測定対象元素及び内標準元素 (イットリウム、インジウム又はビスマス) のそれぞれの質量/電荷数(25) における指示値を読み取り、測定対象元素の指示値と内標準元素の指示値との比をそれぞれ求める。
2) 空試験として、e)1)での試料と同量の水をとり、試料と同様に c)及び d)1)の操作を行って測定対象元素の指示値と内標準元素の指示値との比を求め、試料について得た測定対象元素と内標準元素との表示値の比を補正する。
3) 検量線から測定対象元素の量を求め、試料中の測定対象元素の濃度 (μg/L) を算出する。
注(24) 妨害物質の存在が不明の場合には、定量に先だってICP質量分析計による定性分析を行うことによって、測定対象元素及び内標準元素の測定質量数に対する妨害 (スペクトル干渉及び非スベクトル干渉) の有無と程度を推定することができる。スペクトル干渉が認められる場合には、測定質量数の変更、試料の希釈又は前処理を行って妨害の軽減を図る。スペクトル干渉のため、上記のイットリウム、インジウム又はビスマスを内標準元素として使用できない場合もあるが、その場合には、他の内標準元素を用いる。スペクトル干渉の例を、表52.3に示す。非スペクトル干渉 (マトリックス干渉ともいい、検以線の傾きに影響する。) は、一般にこの方法で採川している内標準法によって補正できるが、妨害物質の濃度が高い場合には、補正が不十分となることがある。このような場合には、試料の希釈又は前処理を行った後、内標準法を適用して妨害の軽減を図る。非スペクトル干渉の程度は、標準液を添加して回収率を求めることによって推定することができる。すなわち、試料(元の試料又は希釈・前処理後の試料)中の測定対象元素の濃度が10ng/mL分だけ (ただし、試料中の測定元素の濃度が高い場合には、増加分が精度よく測定できるように、試料中と同程度の濃度だけ) 増加するように、測定対象元素の標準液 (0.5μg/mL) の適量を試料に添加後、d)に準じた操作を行って測定対象元素の濃度を求め、その回収率を求める。回収率が 90~110% の範囲にあれば、非スペクトル干渉は、ほぼ無視し得るものと考えられる。
注(25) 質量数を設定するには、表52.2及び表52.3を参考にするとよい。複数の安定同位体がある場合、複数の同位体の質量/電荷数を用いて測定を行うことによって、スペクトル干渉による妨害を推定することができる。
1) ICP質量分析装置を作動できる状態にし、e)2)の溶液を試料導入部を通してイオン化部に導入して測定対象元素及び内標準元素 (イットリウム、インジウム又はビスマス) のそれぞれの質量/電荷数(25) における指示値を読み取り、測定対象元素の指示値と内標準元素の指示値との比をそれぞれ求める。
2) 空試験として、e)1)での試料と同量の水をとり、試料と同様に c)及び d)1)の操作を行って測定対象元素の指示値と内標準元素の指示値との比を求め、試料について得た測定対象元素と内標準元素との表示値の比を補正する。
3) 検量線から測定対象元素の量を求め、試料中の測定対象元素の濃度 (μg/L) を算出する。
注(24) 妨害物質の存在が不明の場合には、定量に先だってICP質量分析計による定性分析を行うことによって、測定対象元素及び内標準元素の測定質量数に対する妨害 (スペクトル干渉及び非スベクトル干渉) の有無と程度を推定することができる。スペクトル干渉が認められる場合には、測定質量数の変更、試料の希釈又は前処理を行って妨害の軽減を図る。スペクトル干渉のため、上記のイットリウム、インジウム又はビスマスを内標準元素として使用できない場合もあるが、その場合には、他の内標準元素を用いる。スペクトル干渉の例を、表52.3に示す。非スペクトル干渉 (マトリックス干渉ともいい、検以線の傾きに影響する。) は、一般にこの方法で採川している内標準法によって補正できるが、妨害物質の濃度が高い場合には、補正が不十分となることがある。このような場合には、試料の希釈又は前処理を行った後、内標準法を適用して妨害の軽減を図る。非スペクトル干渉の程度は、標準液を添加して回収率を求めることによって推定することができる。すなわち、試料(元の試料又は希釈・前処理後の試料)中の測定対象元素の濃度が10ng/mL分だけ (ただし、試料中の測定元素の濃度が高い場合には、増加分が精度よく測定できるように、試料中と同程度の濃度だけ) 増加するように、測定対象元素の標準液 (0.5μg/mL) の適量を試料に添加後、d)に準じた操作を行って測定対象元素の濃度を求め、その回収率を求める。回収率が 90~110% の範囲にあれば、非スペクトル干渉は、ほぼ無視し得るものと考えられる。
注(25) 質量数を設定するには、表52.2及び表52.3を参考にするとよい。複数の安定同位体がある場合、複数の同位体の質量/電荷数を用いて測定を行うことによって、スペクトル干渉による妨害を推定することができる。
e) 検量線
検量線の作成は、次による。
1) a)4)の混合標準液 (各元素濃度 10μg/mL) 又は a)5)の混合標準液 (各元素濃度 0.5μg/mL) いずれか(26)の混合標準液 0.1~5mL を、全量フラスコ 100mL に段階的にとり、内標準液(1μg/L) 1mL を加え、c)2)の試料と同じ酸の濃度になるように硝醸 (1+1) を加えた後、水を標線まで加える。使用時に調製する。
2) この溶液について d)1)の操作を行う。
3) 別に、空試験として全量フラスコ 100mL に内標準液 (1μg/mL) 1mL を加え、c)2)の試料と同じ酸の濃度になるように硝酸 (1+1) を加え、水を標線まで加えた後、d)1)の操作を行って標準液について得た指示値の比をそれぞれ補正し、測定対象元素の濃度に対する、測定元素の指示値と内標準元素の指示値との比の関係線をそれぞれ作成する。検量線の作成は、試料測定時に行う。
注(26) a)4)の混合標準液の調製に用いた各元素の標準液のうち、測定対象元素の各標準液のそれぞれ一定量をとり、希釈して一定量として混合標準液を調製して用いてもよい。この混合標準液は、測定対象の元素を含み、測定する濃度範囲よりも高い濃度とする。
備考16 注(24)の操作で、主成分の元素又は有機物の含有量が少なく、非スペクトル干渉が無視できる試料の場合は、内標準元素の添加を省略し、検量線法によって定量してもよい。
1) a)4)の混合標準液 (各元素濃度 10μg/mL) 又は a)5)の混合標準液 (各元素濃度 0.5μg/mL) いずれか(26)の混合標準液 0.1~5mL を、全量フラスコ 100mL に段階的にとり、内標準液(1μg/L) 1mL を加え、c)2)の試料と同じ酸の濃度になるように硝醸 (1+1) を加えた後、水を標線まで加える。使用時に調製する。
2) この溶液について d)1)の操作を行う。
3) 別に、空試験として全量フラスコ 100mL に内標準液 (1μg/mL) 1mL を加え、c)2)の試料と同じ酸の濃度になるように硝酸 (1+1) を加え、水を標線まで加えた後、d)1)の操作を行って標準液について得た指示値の比をそれぞれ補正し、測定対象元素の濃度に対する、測定元素の指示値と内標準元素の指示値との比の関係線をそれぞれ作成する。検量線の作成は、試料測定時に行う。
注(26) a)4)の混合標準液の調製に用いた各元素の標準液のうち、測定対象元素の各標準液のそれぞれ一定量をとり、希釈して一定量として混合標準液を調製して用いてもよい。この混合標準液は、測定対象の元素を含み、測定する濃度範囲よりも高い濃度とする。
備考16 注(24)の操作で、主成分の元素又は有機物の含有量が少なく、非スペクトル干渉が無視できる試料の場合は、内標準元素の添加を省略し、検量線法によって定量してもよい。
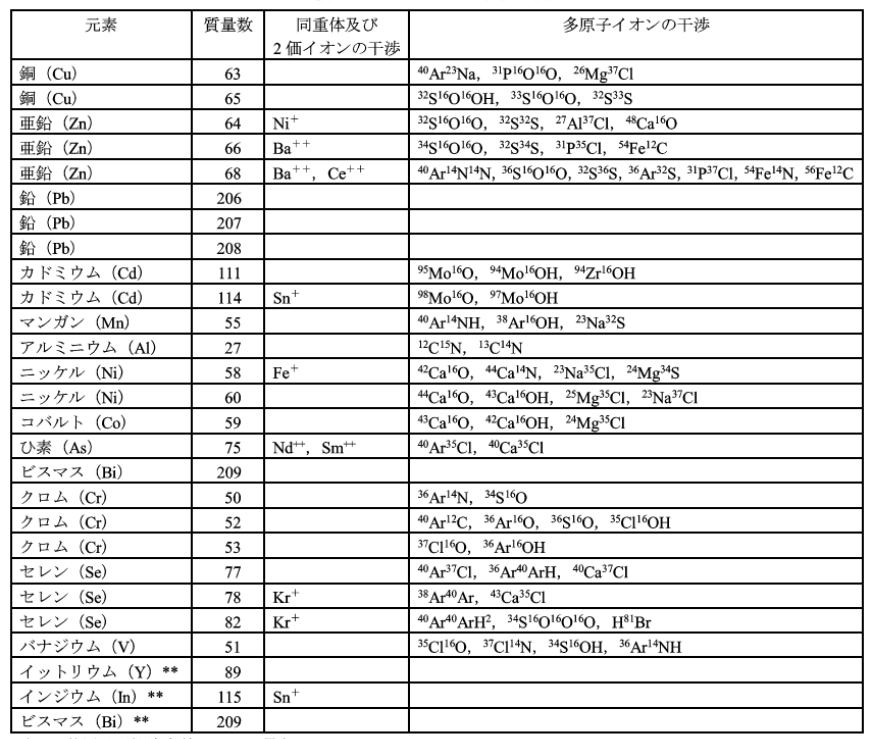
* 装置及び測定条件によって異なる。 ** 内標準元素
参考文献
Charlot, G.: Les Reactions Chemiques En Solution, Masson(1969)
Cotton, F.A., G. Wilkinson: Advanced Inorganic Chemistry, John Wiley & Sons(1972)
Ewing, G.W: Instrumental Methods of Chemical Analysis, McGraw-Hill(1975)
大木 道則:化学事典、東京化学同人(1994)
国土交通省水質連絡会:河川水質試験方法(案)2008年度版
産業環境管理協会:新・公害防止の技術と法規2016 水質編
床野 利之,脇田 久伸 (編集):入門機器分析化学,三共出版(1988)
電気化学会(編集):電気化学測定マニュアル 基礎編、丸善出版(2002)
日本規格協会:詳解 工場排水試験方法 [JIS K 0102:2013] (2014)
日本分析化学会:分析化学便覧、丸善(2011)
用水廃水便覧編集委員会:用水廃水便覧,丸善(1973)
掲載日:2018年11月27日
更新日:2018年12月07日(リンク先の一部修正)、2019年08月27日(測定方法を修正・加筆)
