村上定瞭(水浄化フォーラム)
はじめに
地球内部を含む物質循環
水浄化と農地還元
金属イオンの水酸化物と沈殿生成
銅(Ⅱ)水酸化物の沈殿生成の速度と機構
アルミニウム(Ⅲ)・鉄(Ⅲ)の水酸化物
シリカ(Ⅳ)の重合体
無機系凝集剤・使用上の留意事項
無機系凝集剤と発生汚泥の農地還元
参考文献
地球内部を含む物質循環
水浄化と農地還元
金属イオンの水酸化物と沈殿生成
銅(Ⅱ)水酸化物の沈殿生成の速度と機構
アルミニウム(Ⅲ)・鉄(Ⅲ)の水酸化物
シリカ(Ⅳ)の重合体
無機系凝集剤・使用上の留意事項
無機系凝集剤と発生汚泥の農地還元
参考文献
はじめに
地球内部を含む物質循環
地球は、半径およそ6,400kmのほぼ球体である。この球体の中心部分は核、その外側がマントルで、マントルの外側に地殻がある。地表からおよそ30~40km厚さで覆われる部分が大陸地殻である。地球の半径を1mとすると、5.5mm程度の厚さとなる。海洋地殻は大陸下で沈み込み、マントル下層にまで運ばれる。一方で、マントルブルームにより下部マントル物質は上昇して地表へ運ばれて(火山噴火など)、冷却されて岩石(一次鉱物)なる。
この岩石は、物理・化学・生物の各作用を受けて新たな鉱物(二次鉱物)へ変化する。一次鉱物は2,000にも及ぶ種類があるが、二次鉱物の種類は少なく、重要なものは5種類である。さらに、水循環に伴って岩石風化の過程で溶出した成分は、地表・地下を流れる水によって海域へ運ばれて、その溶解成分を構成している。
この風化の過程をサイズで見ると、岩石→礫→粗砂→細砂→シルト→粘土というように粒径が小さくなっていく。礫・砂・シルト・粘土が混ざり合って土壌を形成する。これに大気・水の循環が加わって、土壌には細菌・動植物が生息して、地上動物も加わった、有機物の生産と分解(食物連鎖を含む)の循環が行われている。
この岩石は、物理・化学・生物の各作用を受けて新たな鉱物(二次鉱物)へ変化する。一次鉱物は2,000にも及ぶ種類があるが、二次鉱物の種類は少なく、重要なものは5種類である。さらに、水循環に伴って岩石風化の過程で溶出した成分は、地表・地下を流れる水によって海域へ運ばれて、その溶解成分を構成している。
この風化の過程をサイズで見ると、岩石→礫→粗砂→細砂→シルト→粘土というように粒径が小さくなっていく。礫・砂・シルト・粘土が混ざり合って土壌を形成する。これに大気・水の循環が加わって、土壌には細菌・動植物が生息して、地上動物も加わった、有機物の生産と分解(食物連鎖を含む)の循環が行われている。
水浄化と農地還元
本サイトは水浄化に係る科学・技術を取り上げている。用水・廃水を問わず水浄化に伴って、汚濁物質を除去する過程で副産物が生じる。過去において、この副産物は中間処理されて埋立などの最終処分が行われていたが、今日では回収再利用や農地還元されるようになった。本解説では、農地還元を目的とする水浄化を中心に解説する。
本ページの冒頭で、いきなり、地球内部を含めた物質循環を述べた。本解説では、岩石風化の物質循環を逆の方向へたどることとなる。具体的には、溶解・懸濁物質を溶解した浄化材で凝集し、固液分離して取り出し、これを農地還元して、再び、有機物の生産ルートへ戻すことである。内容は、極めて基礎的な内容であるが、金属イオンを用いた懸濁物質の凝集機構や岩石風化と土壌の機能の理解を深めることにもなることと考えている。
本ページの冒頭で、いきなり、地球内部を含めた物質循環を述べた。本解説では、岩石風化の物質循環を逆の方向へたどることとなる。具体的には、溶解・懸濁物質を溶解した浄化材で凝集し、固液分離して取り出し、これを農地還元して、再び、有機物の生産ルートへ戻すことである。内容は、極めて基礎的な内容であるが、金属イオンを用いた懸濁物質の凝集機構や岩石風化と土壌の機能の理解を深めることにもなることと考えている。
金属イオンの水酸化物と沈殿生成
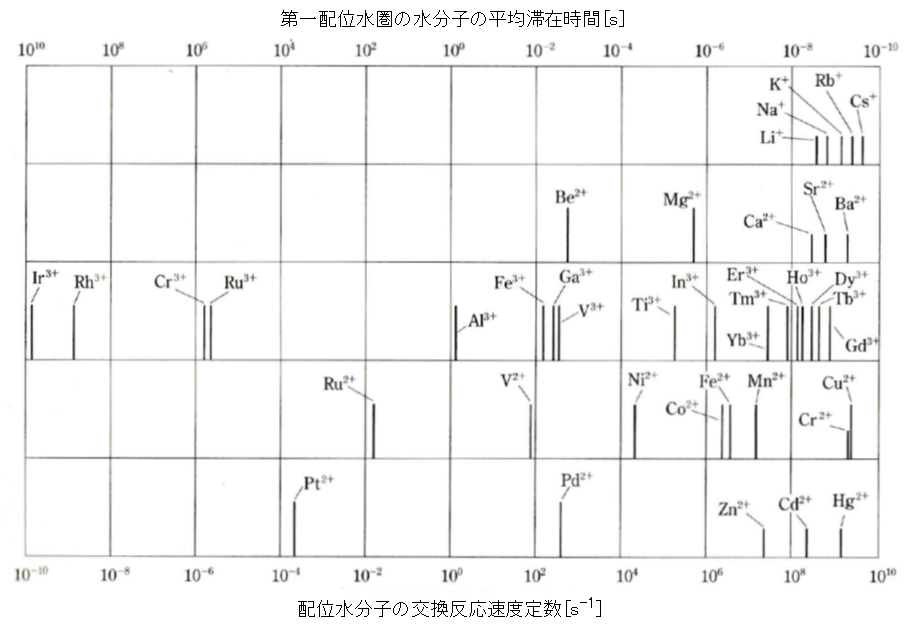
浄水場や工業廃用水の懸濁物質を沈降分離するために、Al(Ⅲ)塩やFe(Ⅲ)塩が凝集剤が用いられる。この3価イオンの凝集効果は複雑であるので、先ず、Cu(Ⅱ)塩の沈殿生成を解説する。Cu(Ⅱ)を取り上げた理由は、アリカリを加えると弱酸性で白青色の水酸化物Cu(OH)2の沈殿を生じること。また、Cu(Ⅱ)は、外殻電子が3d9(S = 1/2)で、電子スピン共鳴ESRの情報が得られることにある。
銅(Ⅱ)水酸化物の沈殿生成の速度と機構
(1)水中での銅の挙動
銅は、自然環境ではその pH および酸化還元電位 E により、図2に示すように原子価は 0、Ⅰ、Ⅱの状態で存在する。
水溶液中のCu(Ⅱ)は図1に示すように 6配位・八面体構造であるが、一つの C4 軸方向が伸びた歪八面体構造である。水酸化物 Cu(OH)2 は難溶性(Ksp = 19.9)であるが、図3に示すように、酸性・強塩基性で溶解する。
酸性では、 [Cu(H2O)6]2+、[Cu(OH)(H2O)5]+(単量体)、[Cu(OH)2(H2O)8]2+( 2量体)、[nCu(OH)2(1-δ)・2δ(H2O)]2δ+(溶解性 n 量体: n>2)の状態で存在する。
強塩基性では、[Cu(OH)3(H2O)3]–、[Cu(OH)4(H2O)2)]2-として溶解する。
水溶液中のCu(Ⅱ)は図1に示すように 6配位・八面体構造であるが、一つの C4 軸方向が伸びた歪八面体構造である。水酸化物 Cu(OH)2 は難溶性(Ksp = 19.9)であるが、図3に示すように、酸性・強塩基性で溶解する。
酸性では、 [Cu(H2O)6]2+、[Cu(OH)(H2O)5]+(単量体)、[Cu(OH)2(H2O)8]2+( 2量体)、[nCu(OH)2(1-δ)・2δ(H2O)]2δ+(溶解性 n 量体: n>2)の状態で存在する。
強塩基性では、[Cu(OH)3(H2O)3]–、[Cu(OH)4(H2O)2)]2-として溶解する。
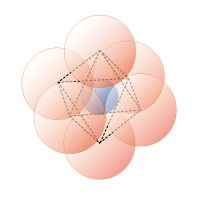
図1 6 配位正八面体の金属(Ⅱ/Ⅲ)水和錯イオン(Cu2+: 正八面体 Oh → 歪八面体 D4h)
金属イオン(●)、OH–/OH2(●)
6 配位のイオン半径比 0.41≦rx/ro≦ 0.65、X [Å] (半径比): Mg2+ 0.66 (0.47)、Cu2+ 0.72 (0.51)、Al3+ 0.31 (0.36)、Fe3+ 0.64 (0.46)、O2- 1.40 (OH、OH2の水素は、中心金属から反対方向へ配向)
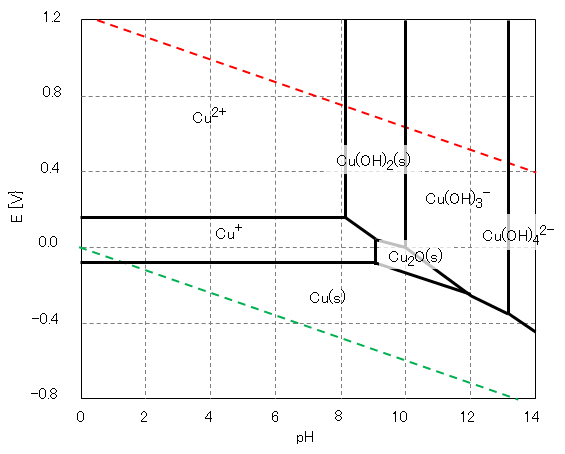
図2 銅の酸化還元電位EとpHの関係(作図方法:参照)
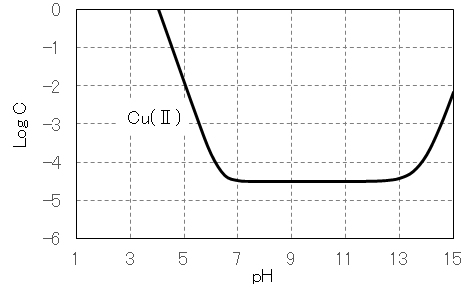
図3 Cu(Ⅱ)塩のpHと溶解度の関係(作図方法:参照)
(2)水酸化銅(Ⅱ)の沈殿生成の速度とメカニズム
<沈殿生成速度の測定>
水酸化銅(Ⅱ)沈殿の生成速度を測定した事例を紹介する。詳しくは、文献を参照されたい。
図5は Cu(ClO4)2 に対して半モルの NaOH を反応させた時の pH 値の経時変化を測定したものである。NaOH 添加直後、瞬時に pH が上昇し、しばらくは pH に変化は見られず、反応液は透明で外見上も変化はない。一定時間(τA)が経過すると pH の低下が始まり白色沈殿が生成し始める。一定時間(τB)を経て pH 低下は極めて緩やかとなり、沈殿生成もほとんど停止する。反応初期に放出される H+(NaOH添加によって中和される)とτBで放出される H+ の比率はおよそ 600:1 である。
この沈殿生成速度は、媒誘電率の低下(極性有機溶媒の添加)や共存陰イオン(塩酸塩や硫酸塩の添加)によって著しく加速される。酸・塩基 pH 滴定(過塩素酸銅(Ⅱ)の塩基滴定とその逆の水酸化銅(Ⅱ)懸濁液の酸滴定)・ESR・電気伝導率の測定や文献 [Fujita] 等から、銅(Ⅱ)水酸化物沈殿生成のメカニズムとして、編集者は図5に示すモデルを考えている。
水酸化銅(Ⅱ)沈殿の生成速度を測定した事例を紹介する。詳しくは、文献を参照されたい。
図5は Cu(ClO4)2 に対して半モルの NaOH を反応させた時の pH 値の経時変化を測定したものである。NaOH 添加直後、瞬時に pH が上昇し、しばらくは pH に変化は見られず、反応液は透明で外見上も変化はない。一定時間(τA)が経過すると pH の低下が始まり白色沈殿が生成し始める。一定時間(τB)を経て pH 低下は極めて緩やかとなり、沈殿生成もほとんど停止する。反応初期に放出される H+(NaOH添加によって中和される)とτBで放出される H+ の比率はおよそ 600:1 である。
この沈殿生成速度は、媒誘電率の低下(極性有機溶媒の添加)や共存陰イオン(塩酸塩や硫酸塩の添加)によって著しく加速される。酸・塩基 pH 滴定(過塩素酸銅(Ⅱ)の塩基滴定とその逆の水酸化銅(Ⅱ)懸濁液の酸滴定)・ESR・電気伝導率の測定や文献 [Fujita] 等から、銅(Ⅱ)水酸化物沈殿生成のメカニズムとして、編集者は図5に示すモデルを考えている。
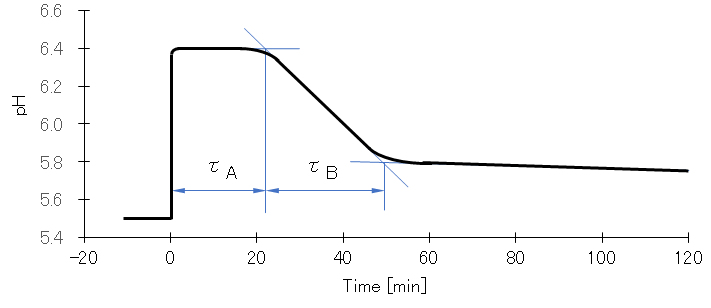
図4 水酸化銅(Ⅱ)の沈殿生成速度の測定(50℃)
窒素ガス曝気により脱酸素した密封容器内の1.0×10-3mol/L Cu(ClO4)2水溶液へ急速攪拌下で、0.5×10-3mol/Lとなるように1mL注射器でNaOH溶液を瞬時に添加した後のpH値の経時変化を測定した。
1/τAは、Cu2+およびOH–の初濃度にそれぞれ比例、1/τBはOH–の初濃度のみに比例し、50℃における kA = 1.6×103 mole-2/sec、kB = 1.6×10-1 mole-2/sec である。活性化エネルギーは、EA = 4.6 kcal/mole、EB = 18.3 kcal/mole である。
1/τAは、Cu2+およびOH–の初濃度にそれぞれ比例、1/τBはOH–の初濃度のみに比例し、50℃における kA = 1.6×103 mole-2/sec、kB = 1.6×10-1 mole-2/sec である。活性化エネルギーは、EA = 4.6 kcal/mole、EB = 18.3 kcal/mole である。
<沈殿生成のメカニズム>
水酸化銅(Ⅱ)の沈殿生成は図5のモデルで示すような 3 段階も過程で進行する。
第Ⅰ段階は、八面体・水和錯イオン[Cu(H2O)6]2+が 2 個のプロトン H+ を放出して、銅(Ⅱ)に配位した水分子 H2O が水酸化物イオン OH– に変化して[Cu(OH)2(H2O)4](単量体)を生じる。これは極めて早い反応で、可逆反応である。Cu2+に配位している水分子は、極めて早い速度で、周囲の水と H+ を交換しており [*) H2O(配位) + H2(周囲) ⇄ OH–(配位) + H3O+(周囲)]、Cu2+に配意した 2 つの OH– は、八面体 6 頂点の内のどの 2 頂点にも区別なく均等に位置している。
第Ⅱ段階は、上記の単量体同士が脱水縮合して、OHブリッジによる 2 量体(八面体の一つ辺を共有)を生成する。このように脱水縮合が、逐次、進行して n 量体が生成する。脱水縮合は、図5に示す a方向にも、b方向にも進行して、図6で示す八面体シート(層)が形成される。
第Ⅲ段階は、多数の八面体シートがファンデルワールス力によって平行に積み重なってある程度の大きさに成長すると水に難溶性となって、沈殿として析出する。
第Ⅰ段階は、図4の t = 0 における pH 上昇に対応し、第Ⅱ段階はτA、第Ⅲ段階はτBにそれぞれ対応している。① 第Ⅲ段階で第Ⅰ段階の H+ に比べて、およそ1/600の H+ を放出している。② 誘電率の低下および共存するアニオンによって、沈殿生成速度が加速する。③ 多量体の n 値はどのくらいであろうか。
現象①は、[nCu(OH)2(1-δ)・2δ(H2O)]2δ+(δ ≒ 1/300)で示すように、n 量体の極一部の OH が H2O となっている [上記の*)参照]。このため、Cu2+と 2(1-δ)OH–の僅かな正負電荷数の不均衡により、n 量体は正に帯電している。電荷 2δ+はアニオンによる電気二重層によって水中でより安定化する。一方で、n 値が増大し、n 量体相互の静電気力(斥力)< ファンデル・ワールス力(引力)に達すると、八面体シートは互いに平行に重なりあって、図7に示す積層体(parallel stacking)を形成し、目視で観察できる大きさとなって、沈殿を生成する。
この時、積層体は電気的中性を保つため、n 量体に残存している 2(δ-1)H2O はプロトンを放出し、OH–となる。また、誘電率の低下は、僅かに帯電した n 量体の溶解エネルギーを低下させ、より安定な積層体(沈殿)を形成することとなる。n 値(統計値)は、pH・温度・誘電率・共存アニオン等によって、異なる値となろう。
図5の赤矢印( → )の長さは反応速度を示す。第Ⅰ段階を除いて、右方向の速度が大きい。これは、酸・塩基滴定(塩基を滴下して沈殿を生成したのち、逆に酸を滴下したときの pH 滴定結果はヒステリシス曲線となり、酸滴定曲線は塩基滴定より低 pH 側に移行している)ことからも推定できる。炭酸ナトリウム・リン酸ナトリムなど沈殿生成を伴わない電解質の酸・塩基滴定では、ヒステリシスは起こらない。
水酸化銅(Ⅱ)の沈殿生成は図5のモデルで示すような 3 段階も過程で進行する。
第Ⅰ段階は、八面体・水和錯イオン[Cu(H2O)6]2+が 2 個のプロトン H+ を放出して、銅(Ⅱ)に配位した水分子 H2O が水酸化物イオン OH– に変化して[Cu(OH)2(H2O)4](単量体)を生じる。これは極めて早い反応で、可逆反応である。Cu2+に配位している水分子は、極めて早い速度で、周囲の水と H+ を交換しており [*) H2O(配位) + H2(周囲) ⇄ OH–(配位) + H3O+(周囲)]、Cu2+に配意した 2 つの OH– は、八面体 6 頂点の内のどの 2 頂点にも区別なく均等に位置している。
第Ⅱ段階は、上記の単量体同士が脱水縮合して、OHブリッジによる 2 量体(八面体の一つ辺を共有)を生成する。このように脱水縮合が、逐次、進行して n 量体が生成する。脱水縮合は、図5に示す a方向にも、b方向にも進行して、図6で示す八面体シート(層)が形成される。
第Ⅲ段階は、多数の八面体シートがファンデルワールス力によって平行に積み重なってある程度の大きさに成長すると水に難溶性となって、沈殿として析出する。
第Ⅰ段階は、図4の t = 0 における pH 上昇に対応し、第Ⅱ段階はτA、第Ⅲ段階はτBにそれぞれ対応している。① 第Ⅲ段階で第Ⅰ段階の H+ に比べて、およそ1/600の H+ を放出している。② 誘電率の低下および共存するアニオンによって、沈殿生成速度が加速する。③ 多量体の n 値はどのくらいであろうか。
現象①は、[nCu(OH)2(1-δ)・2δ(H2O)]2δ+(δ ≒ 1/300)で示すように、n 量体の極一部の OH が H2O となっている [上記の*)参照]。このため、Cu2+と 2(1-δ)OH–の僅かな正負電荷数の不均衡により、n 量体は正に帯電している。電荷 2δ+はアニオンによる電気二重層によって水中でより安定化する。一方で、n 値が増大し、n 量体相互の静電気力(斥力)< ファンデル・ワールス力(引力)に達すると、八面体シートは互いに平行に重なりあって、図7に示す積層体(parallel stacking)を形成し、目視で観察できる大きさとなって、沈殿を生成する。
この時、積層体は電気的中性を保つため、n 量体に残存している 2(δ-1)H2O はプロトンを放出し、OH–となる。また、誘電率の低下は、僅かに帯電した n 量体の溶解エネルギーを低下させ、より安定な積層体(沈殿)を形成することとなる。n 値(統計値)は、pH・温度・誘電率・共存アニオン等によって、異なる値となろう。
図5の赤矢印( → )の長さは反応速度を示す。第Ⅰ段階を除いて、右方向の速度が大きい。これは、酸・塩基滴定(塩基を滴下して沈殿を生成したのち、逆に酸を滴下したときの pH 滴定結果はヒステリシス曲線となり、酸滴定曲線は塩基滴定より低 pH 側に移行している)ことからも推定できる。炭酸ナトリウム・リン酸ナトリムなど沈殿生成を伴わない電解質の酸・塩基滴定では、ヒステリシスは起こらない。
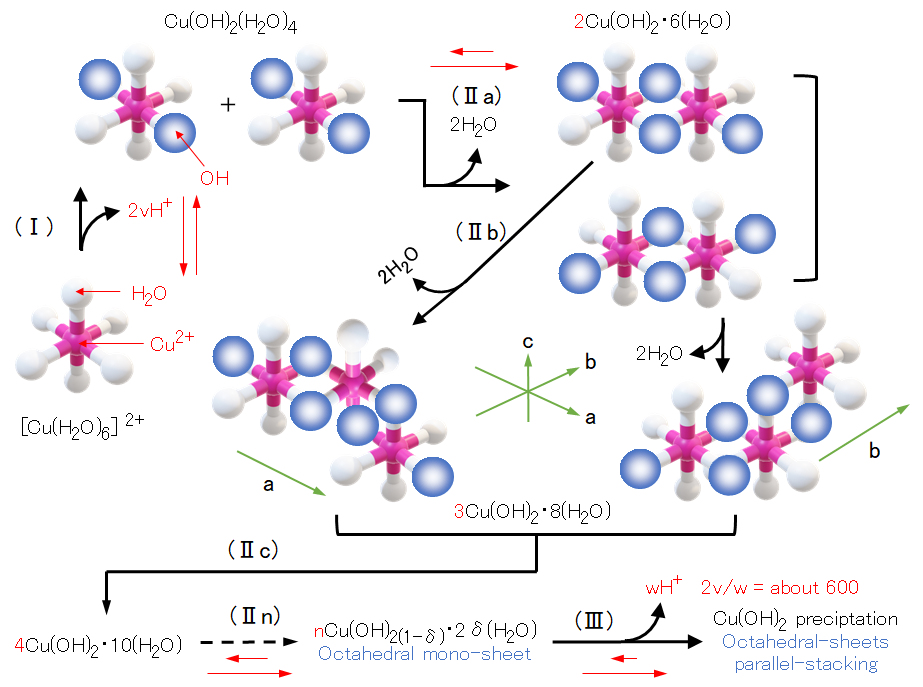
図5 水酸化銅(Ⅱ)の沈殿生成のメカニズム
<八面体シートの構造とその積層体の立体構造>
前節で述べた銅(Ⅱ)水酸化物の八面体シートを図6に示す。Cu2+ に OH– が八面体 6 配位した基本単位(図1参照)がその頂点に位置する OH を共有して、a軸方向、b軸方向に延びてシート状構造(八面体シート)を形成している。同図に示す実際のOH–のイオン半径は大きくて、図1に示すように、Cu2+イオンは 6 個のOH–イオン球の隙間に位置ししている。
図7は八面体シートが互いに平行に向かい合い、弱いファンデルワールス力によって c 軸方向に重なった積層体の構造である。同図には、Cu2+は示されていないが、正八面体の中心に位置している。
前節で述べた銅(Ⅱ)水酸化物の八面体シートを図6に示す。Cu2+ に OH– が八面体 6 配位した基本単位(図1参照)がその頂点に位置する OH を共有して、a軸方向、b軸方向に延びてシート状構造(八面体シート)を形成している。同図に示す実際のOH–のイオン半径は大きくて、図1に示すように、Cu2+イオンは 6 個のOH–イオン球の隙間に位置ししている。
図7は八面体シートが互いに平行に向かい合い、弱いファンデルワールス力によって c 軸方向に重なった積層体の構造である。同図には、Cu2+は示されていないが、正八面体の中心に位置している。
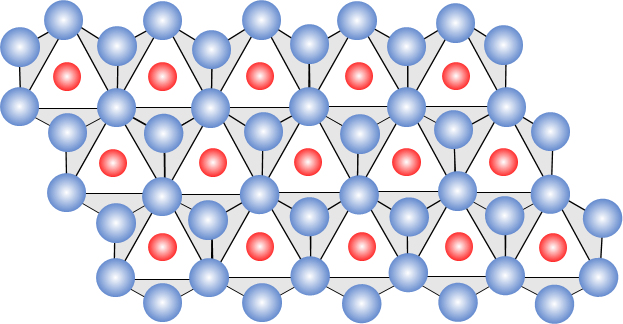
図6 金属(Ⅱ)イオンの水酸化物(例えば、Mg(OH)2:brucite)のシート構造
赤球(●):Cu2+、青球(●):OH–
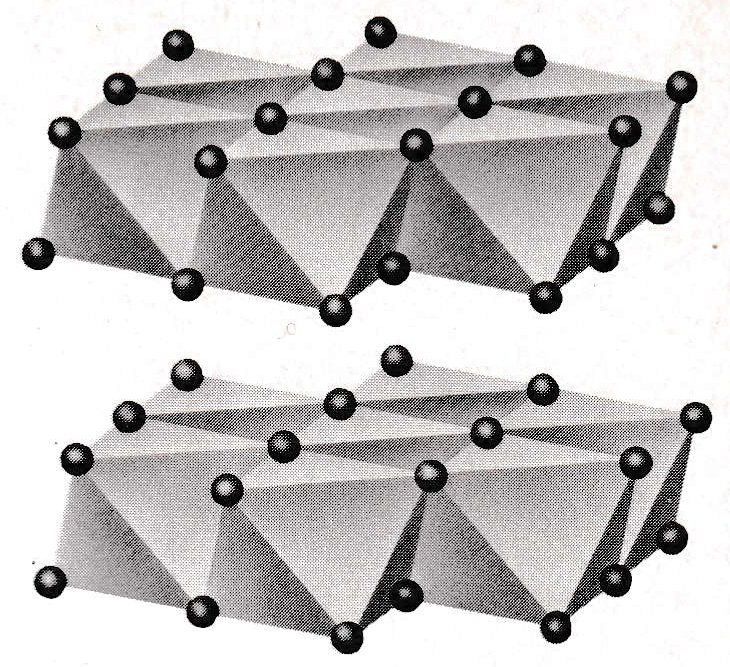
図7 金属(Ⅱ)イオンの水酸化物(例えば、Mg(OH)2:brucite)の立体構造
黒球(●):OH–
目次へ
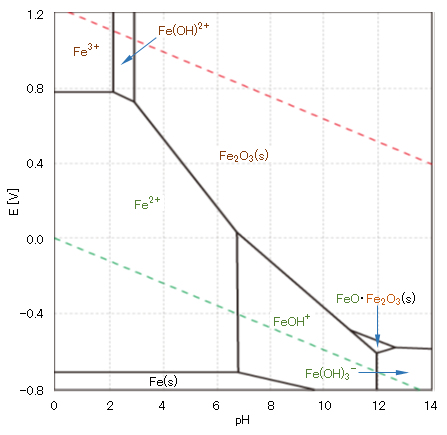
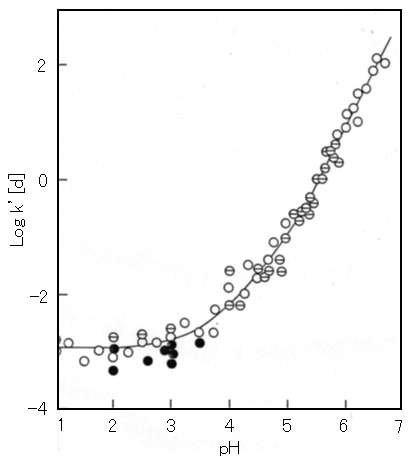
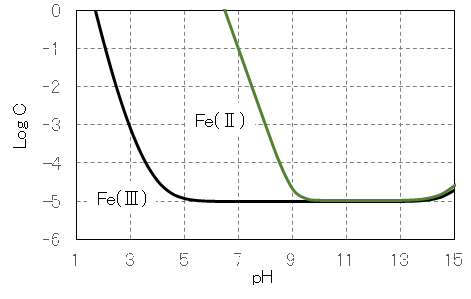
アルミニウム(Ⅲ)・鉄(Ⅲ)の水酸化物
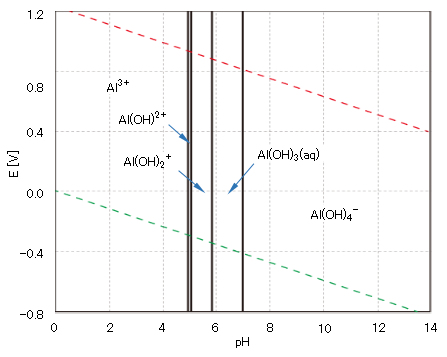
図8 アルミニウムの酸化還元電位EとpHの関係
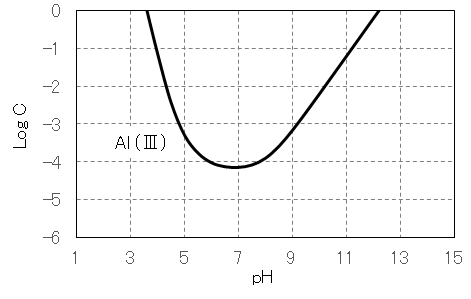
図9 Al(Ⅲ)塩のpHと溶解度の関係
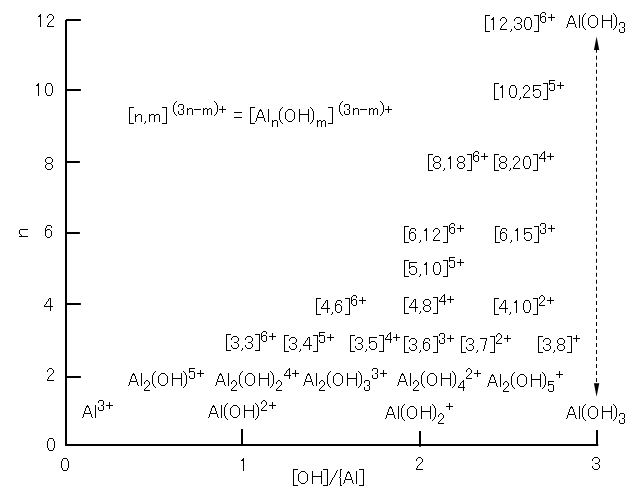
図10 Al(Ⅲ)塩の塩基滴定における滴下当量([OH]/[Al])とAl(Ⅲ)の優先種の関係
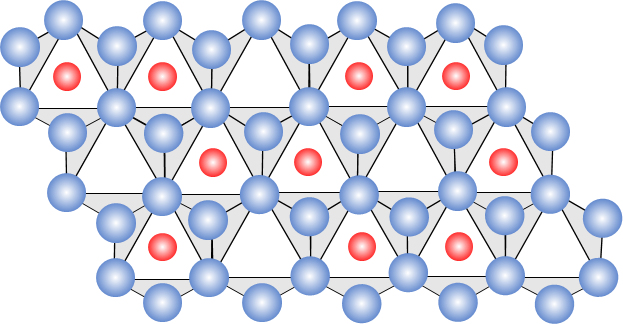
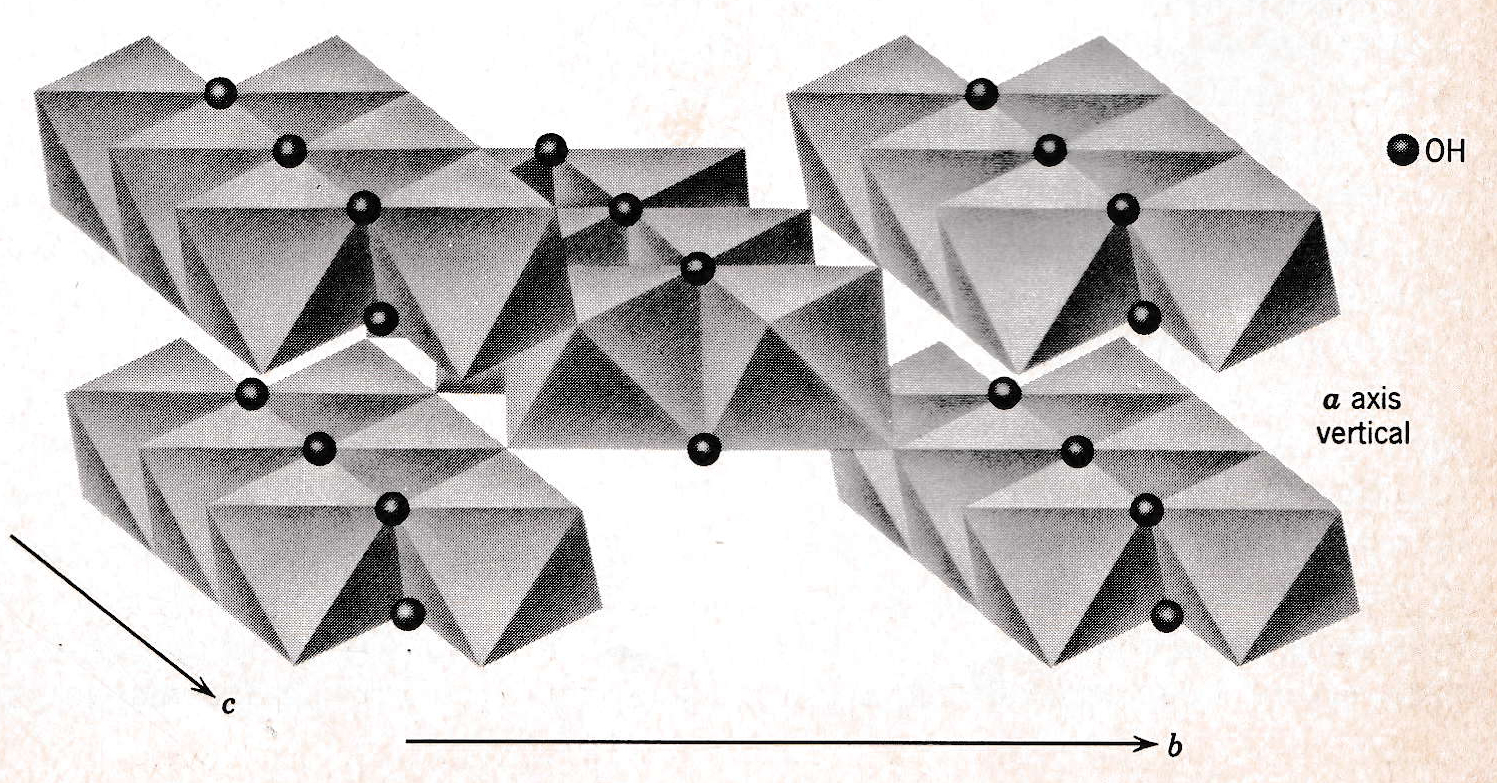
図11 3 価金属イオンの水酸化物(例えば、Al(OH)3、Fe(OH)3)など)のシート構造
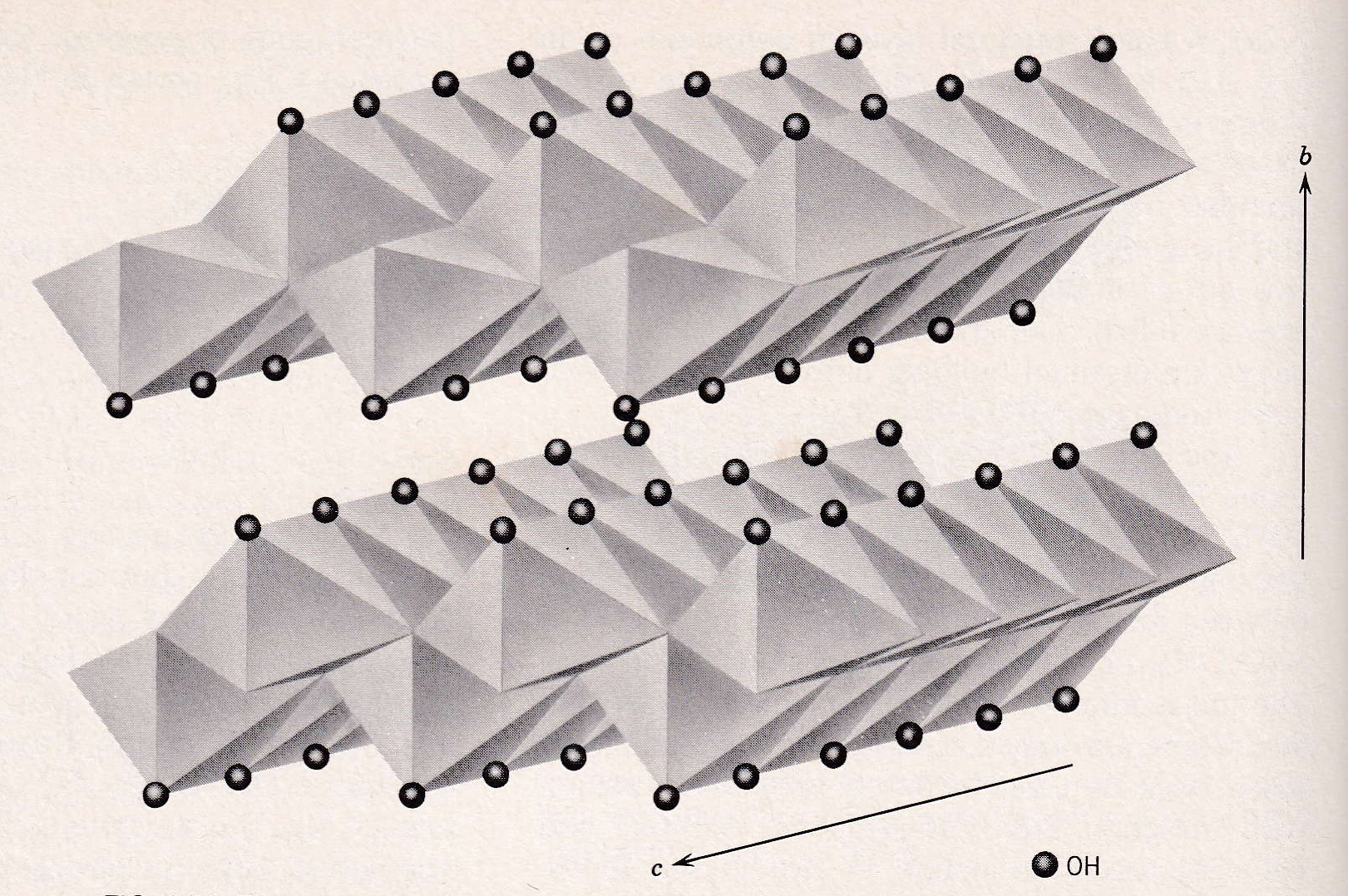
図12 3価金属イオンの水酸化物(例えば、Al(OH)3 or γ-AlO-OH:boehmite、Fe(OH)3) or γ-FeO-OH:lepidochrocite )の立体構造
目次へ
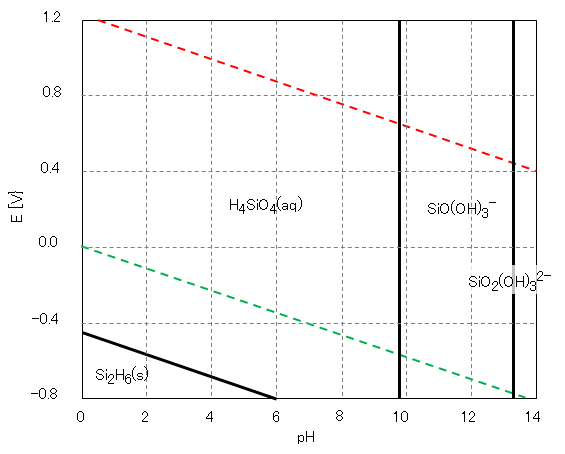
シリカの重合体
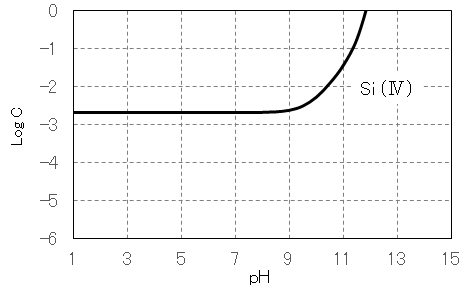
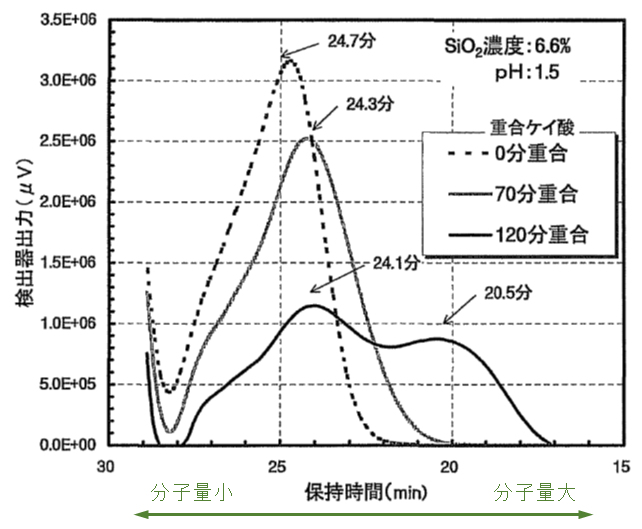
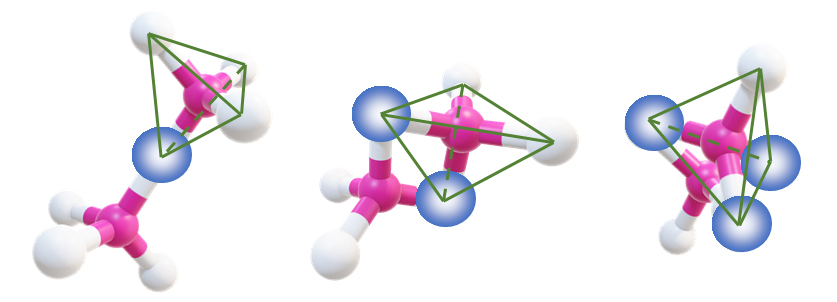
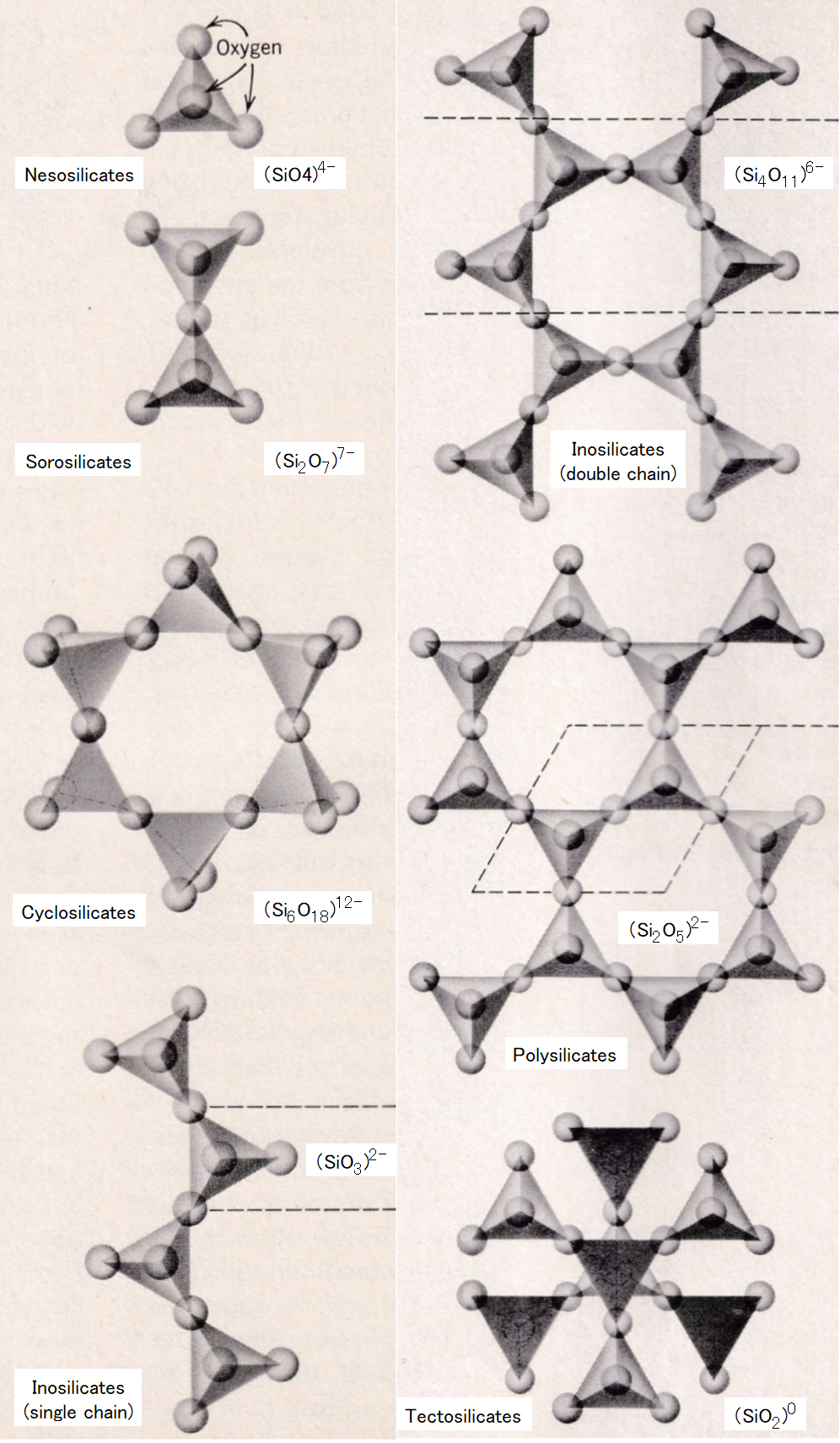
目次へ
無機系凝集剤・使用上の留意事項
無機系凝集剤と発生汚泥の農地還元
参考文献
Fujita, W., et al.: Inorg.Chem., 35, 1915(1996); J.Am.Chem.Soc., 117, 4563(1997); Bull.Chem.Soc.Jpn.,86, 921(2013).
4563
Stol,B.J., A.K. Van Heldey, P.L. De Bruyn: J. Colloid Interface Sci., 57(1), 115-131(1976).
掲載日:2020年03月05日
更新日:
