村上定瞭(水浄化フォーラム)
1.金属成分の溶出
2.有機物の分解
3.原子吸光法(フレーム、電気加熱)
ICP発光分光光度法
ICP質量分析法
4.濃縮と分離
(1)蒸発濃縮
(2)共沈
(3)気化
(4)イオン交換
(5)溶媒抽出
2.有機物の分解
3.原子吸光法(フレーム、電気加熱)
ICP発光分光光度法
ICP質量分析法
4.濃縮と分離
(1)蒸発濃縮
(2)共沈
(3)気化
(4)イオン交換
(5)溶媒抽出
はじめに
排水中の金属などを対象とする検定方法(環境庁告示64号)では、JIS K 0102に従って、検水の前処理を行うことが原則となっている。水銀・ヒ素などを除けば共通しているので、ここでは共通事項について解説する。
なお、金属定量の前処理(調整)を行うときには、事前に、対象元素の水中での化学的性質をよく理解することが重要と考える。学生さんや初心者は別ページを参照されたい。
なお、金属定量の前処理(調整)を行うときには、事前に、対象元素の水中での化学的性質をよく理解することが重要と考える。学生さんや初心者は別ページを参照されたい。
1.金属成分の溶出
鉄・マンガンは、溶解性成分だけを定量するように定めらており、検水採取直後に濾紙5種Cを用いてろ過し、そのろ液に硝酸を加えてpHを1とする。
その他の金属成分については、以下の酸処理を行う。
その他の金属成分については、以下の酸処理を行う。
(1)塩酸/硝酸酸性での煮沸
有機物や懸濁物質が極めて少ない試料に適用する。上記の溶解性鉄・マンガンの検水用ろ液も原則としてこの扱いとなる。
<操作>
所定量の検水をビーカーに移し、検水100mlにつき、塩酸 5mLまたは硝酸 5mlを加える。加熱して約10分静かに煮沸して放冷後、必要に応じて水で一定量(メスフラスコを使用、以下、同様)とする。
<操作>
所定量の検水をビーカーに移し、検水100mlにつき、塩酸 5mLまたは硝酸 5mlを加える。加熱して約10分静かに煮沸して放冷後、必要に応じて水で一定量(メスフラスコを使用、以下、同様)とする。
(2)塩酸/硝酸による分解
有機物が少なく、懸濁物として水酸化物、酸化物、硫化物、リン酸塩などを含む検水に適用する。
<操作1>
① 検水をよく振り混ぜた後、直ちにビーカーにとり、検水100mLにつき塩酸 5mLまたは硝酸 5mLを加え、加熱して液量が15mLになるまで濃縮する。
② 不溶解物が残った場合には、ろ紙5種Bでろ過した後、水でよく洗浄する。放冷後、ろ液と洗水に水を加えて一定量とする。
<操作2>
塩酸と硝酸の併用による分解が適当である場合には、次の操作を行う。
① 上記操作1-①を行う。15mLまで濃縮した後、室温にまで放冷する。
② 前記①の操作で塩酸を用いたときには硝酸を、硝酸を用いたときには塩酸を、それぞれ 5mL加え、時計皿で覆い再び加熱し、激しい反応が終わったら時計皿を取り外し、さらに加熱して窒素酸化物を追い出し、約5mLになるまで加熱・濃縮する。
③ 上記操作1-②を行う。
<操作1>
① 検水をよく振り混ぜた後、直ちにビーカーにとり、検水100mLにつき塩酸 5mLまたは硝酸 5mLを加え、加熱して液量が15mLになるまで濃縮する。
② 不溶解物が残った場合には、ろ紙5種Bでろ過した後、水でよく洗浄する。放冷後、ろ液と洗水に水を加えて一定量とする。
<操作2>
塩酸と硝酸の併用による分解が適当である場合には、次の操作を行う。
① 上記操作1-①を行う。15mLまで濃縮した後、室温にまで放冷する。
② 前記①の操作で塩酸を用いたときには硝酸を、硝酸を用いたときには塩酸を、それぞれ 5mL加え、時計皿で覆い再び加熱し、激しい反応が終わったら時計皿を取り外し、さらに加熱して窒素酸化物を追い出し、約5mLになるまで加熱・濃縮する。
③ 上記操作1-②を行う。
2.有機物の分解
検水中に存在する有機物は、吸着や錯体生成など、対象金属の定量妨害となることが多い。事前によく分解しておくことが重要である。
(1)硝酸と過塩素酸による分解
この方法は、上記1.金属の溶出の酸処理では分解されにくい有機物を含む検水に適用する。
<操作>
① 検水をよく振り混ぜた後、直ちにその適量をビーカーまたは磁器蒸発皿に採る。
② 硝酸 5~10mLを加え、加熱板上で静かに加熱し、約10mLになるまで濃縮し、放冷する。
③ 硝酸 5mL、過塩素酸 10mLを少量ずつ加え、加熱を続け、過塩素酸の白煙が発生し始めたら時計皿で容器を覆い、過塩素酸が器壁を流下する状態を保って有機物を分解する。有機物の分解が不十分なときには、さらに硝酸 5mLを加えて加熱を続ける。
④ 放冷後、水を加えて液量を 50mLに薄め、不溶解物が残った場合には、ろ紙5種Bを用いてろ過し、水で洗い流してろ液と洗液を合わせて水で一定量とする。
<注意事項>
この方法は、強力な分解方法であるが、不用意な取扱いは爆発を招くことがあるので、次のような注意が必要である。
① 過塩素酸を加える前に、硝酸を加え加熱処理して、酸化されやすい有機物を分解しておく。
② 過塩素酸の添加は、必ず、上記操作②の終了後、すなわち、加熱・濃縮液を放冷した後で行う。
③ 上記操作③に示すように、必ず、硝酸と過塩素酸を共存させた状態で加熱分解を行う。
④ 上記操作③に示すように、乾固しないよう、適宜、硝酸 5mLを添加して加熱を継続する。
<操作>
① 検水をよく振り混ぜた後、直ちにその適量をビーカーまたは磁器蒸発皿に採る。
② 硝酸 5~10mLを加え、加熱板上で静かに加熱し、約10mLになるまで濃縮し、放冷する。
③ 硝酸 5mL、過塩素酸 10mLを少量ずつ加え、加熱を続け、過塩素酸の白煙が発生し始めたら時計皿で容器を覆い、過塩素酸が器壁を流下する状態を保って有機物を分解する。有機物の分解が不十分なときには、さらに硝酸 5mLを加えて加熱を続ける。
④ 放冷後、水を加えて液量を 50mLに薄め、不溶解物が残った場合には、ろ紙5種Bを用いてろ過し、水で洗い流してろ液と洗液を合わせて水で一定量とする。
<注意事項>
この方法は、強力な分解方法であるが、不用意な取扱いは爆発を招くことがあるので、次のような注意が必要である。
① 過塩素酸を加える前に、硝酸を加え加熱処理して、酸化されやすい有機物を分解しておく。
② 過塩素酸の添加は、必ず、上記操作②の終了後、すなわち、加熱・濃縮液を放冷した後で行う。
③ 上記操作③に示すように、必ず、硝酸と過塩素酸を共存させた状態で加熱分解を行う。
④ 上記操作③に示すように、乾固しないよう、適宜、硝酸 5mLを添加して加熱を継続する。
(2)硝酸と硫酸による分解
この方法は、多種類の検水に利用できるが、検水を噴霧するフレーム原子吸光法やICP発光分析法では、残留した硫酸が妨害するので使用できない。
<操作>
① 試料をよく振り混ぜた後、ビーカーまたは蒸発皿に採る。
② 硝酸 5~20mLを加える。加熱して液量が約10mLになったら、硝酸 5mLと (1+1)硫酸 10mLを加え、硫酸の白煙が出て有機物が分解するまで加熱を続ける。有機物の分解が不十分なときには、さらに硝酸を 10mLを加えて、加熱操作を繰り返す。
③ 放冷後、水を加えて、50mLに薄める。
④ 不溶解物が残った場合には、ろ紙5種Bを用いてろ過・水洗を行い、ろ液と洗液を合わせて水で一定量とする。
<鉛の含有液>
検水に鉛が含まれており、沈殿を生じる場合には、上記(1)硝酸と過塩素酸による分解を行うか、または、次の操作を行う。
上記②の操作を行い、溶液をほとんど蒸発乾固させた後、水約 30mLと塩酸 15mLを加え加熱して硫酸鉛(Ⅱ)の沈殿を溶かす。その後に不溶物が残存する場合には、ろ紙5種Bを用いてろ過下の後、不溶物を温塩酸 (1+10) で洗浄する。放冷後、ろ液と洗液を合わせて水で一定量とする。
<操作>
① 試料をよく振り混ぜた後、ビーカーまたは蒸発皿に採る。
② 硝酸 5~20mLを加える。加熱して液量が約10mLになったら、硝酸 5mLと (1+1)硫酸 10mLを加え、硫酸の白煙が出て有機物が分解するまで加熱を続ける。有機物の分解が不十分なときには、さらに硝酸を 10mLを加えて、加熱操作を繰り返す。
③ 放冷後、水を加えて、50mLに薄める。
④ 不溶解物が残った場合には、ろ紙5種Bを用いてろ過・水洗を行い、ろ液と洗液を合わせて水で一定量とする。
<鉛の含有液>
検水に鉛が含まれており、沈殿を生じる場合には、上記(1)硝酸と過塩素酸による分解を行うか、または、次の操作を行う。
上記②の操作を行い、溶液をほとんど蒸発乾固させた後、水約 30mLと塩酸 15mLを加え加熱して硫酸鉛(Ⅱ)の沈殿を溶かす。その後に不溶物が残存する場合には、ろ紙5種Bを用いてろ過下の後、不溶物を温塩酸 (1+10) で洗浄する。放冷後、ろ液と洗液を合わせて水で一定量とする。
解説
学生さんは、金属元素の酸化還元反応も参照されたい。
<塩酸 HCl>
水溶液では、完全に解離しており強酸である。多くの金属と反応して水素を発生し、金属を溶かす。Cu、Fe、Ni、Coなどの重金属は加熱によって反応が進む。Au、Ag、Ptとはほとんど反応しない。
<硝酸 HNO3>
強力な酸化剤で、多くの金属をを溶かす。Au、Pt、Rh、Irには作用しない。Al、Cr、Feは希硝酸には溶けるが、濃硝酸には不動態を形成して不溶となる。Cu、Ag、Pbは硝酸を還元してNO(g)を発生する。非金属に対しても酸化性を示し、例えば、SやPは酸化されて硫酸やリン酸を生じる。
濃硝酸単独で、または濃硫酸とともに有機物に作用して、酸化、ニトロ化、エステル化などの反応を行って、難溶性有機物を分解・水溶性にする。
<硫酸 H2SO4>
硫酸は水と任意に混和し、その際、発熱する。濃硫酸を水で希釈する場合には、水を満たした一回り大きな容器に浸したビーカーに一定量の水を入れ、かき混ぜながら(冷却)少しずつ濃硫酸を加えて、所定の硫酸濃度とする。決して濃硫酸に水を加えない、水が沸騰して濃硫酸が飛び散り、極めて危険である。
熱濃硫酸は酸化作用があるため、Au、Ptを除いたイオン化傾向の小さい金属と反応する。このときH2Sが発生する。有機化合物とは脱水・酸化・スルホン化などの反応を起こし、有機物を分解・水溶性とする。
<過塩素酸 HClO4>
無色の液体で、空気中で発煙する。不安定で放置すると分解し、加熱によって爆発する。強い酸化力を示す。ClO4–イオンは正四面体構造をした安定なイオンで、塩素のオキシ酸では、最も強い酸である。
<錯体や難溶性塩の生成>
塩化物イオンCl–と硫酸イオンSO42-は、金属によっては、安定な錯体を形成したり、難溶性塩を生成して、測定の妨害となることがある。測定対象元素の金属塩や金属錯体について、事前に調べておく必要がある。
<塩酸 HCl>
水溶液では、完全に解離しており強酸である。多くの金属と反応して水素を発生し、金属を溶かす。Cu、Fe、Ni、Coなどの重金属は加熱によって反応が進む。Au、Ag、Ptとはほとんど反応しない。
<硝酸 HNO3>
強力な酸化剤で、多くの金属をを溶かす。Au、Pt、Rh、Irには作用しない。Al、Cr、Feは希硝酸には溶けるが、濃硝酸には不動態を形成して不溶となる。Cu、Ag、Pbは硝酸を還元してNO(g)を発生する。非金属に対しても酸化性を示し、例えば、SやPは酸化されて硫酸やリン酸を生じる。
濃硝酸単独で、または濃硫酸とともに有機物に作用して、酸化、ニトロ化、エステル化などの反応を行って、難溶性有機物を分解・水溶性にする。
<硫酸 H2SO4>
硫酸は水と任意に混和し、その際、発熱する。濃硫酸を水で希釈する場合には、水を満たした一回り大きな容器に浸したビーカーに一定量の水を入れ、かき混ぜながら(冷却)少しずつ濃硫酸を加えて、所定の硫酸濃度とする。決して濃硫酸に水を加えない、水が沸騰して濃硫酸が飛び散り、極めて危険である。
熱濃硫酸は酸化作用があるため、Au、Ptを除いたイオン化傾向の小さい金属と反応する。このときH2Sが発生する。有機化合物とは脱水・酸化・スルホン化などの反応を起こし、有機物を分解・水溶性とする。
<過塩素酸 HClO4>
無色の液体で、空気中で発煙する。不安定で放置すると分解し、加熱によって爆発する。強い酸化力を示す。ClO4–イオンは正四面体構造をした安定なイオンで、塩素のオキシ酸では、最も強い酸である。
<錯体や難溶性塩の生成>
塩化物イオンCl–と硫酸イオンSO42-は、金属によっては、安定な錯体を形成したり、難溶性塩を生成して、測定の妨害となることがある。測定対象元素の金属塩や金属錯体について、事前に調べておく必要がある。
3.原子吸光法(フレーム、電気加熱)、ICP発光分光光度法、ICP質量分析法
1)調整した検水をそのまま噴霧するフレーム原子吸光法またはICP発光分析法を低要する場合には、特に断らない限り、検水は塩酸または硝酸による酸性とする。
2)電気加熱原子吸光法およびICP質量分析では、硝酸酸性とする。
3)調整検水中の金属濃度は、フレーム/電子加熱・原子吸光法では 0.1~1 mol/L、ICP・発光分光/質量・分析法では 0.1~0.5 mol/Lとする。ただし、すずおよびアンチモンを対象とする場合には、1~1.5 mol/Lとする。
4)検水用と検量線用の溶液の酸濃度はほぼ同じ濃度とする。
2)電気加熱原子吸光法およびICP質量分析では、硝酸酸性とする。
3)調整検水中の金属濃度は、フレーム/電子加熱・原子吸光法では 0.1~1 mol/L、ICP・発光分光/質量・分析法では 0.1~0.5 mol/Lとする。ただし、すずおよびアンチモンを対象とする場合には、1~1.5 mol/Lとする。
4)検水用と検量線用の溶液の酸濃度はほぼ同じ濃度とする。
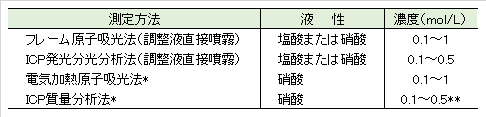
*)JIS 高純度試薬を用いる。**)Sb、Sn、Mo、W、を対象とする場合には、塩酸又は硝酸 11.5 mol/Lとする。
目次へ
4.濃縮と分離
対象ととする重金属が低濃度で、利用する分析機器の限界以下である場合には濃縮操作が必要となる。
また、環境水や排水に様々な物質が混在し、それらが対象物質の定量に妨害となることが多い。さらに、同じ元素の金属でも、その環境条件によって価数が異なり、その価数に対応する金属をそれぞれ定量することもある。妨害物質が共存する検水や価数の異なる元素をそれぞれ定量する場合には、対象とする(価数の)金属を分離する必要がある。
また、環境水や排水に様々な物質が混在し、それらが対象物質の定量に妨害となることが多い。さらに、同じ元素の金属でも、その環境条件によって価数が異なり、その価数に対応する金属をそれぞれ定量することもある。妨害物質が共存する検水や価数の異なる元素をそれぞれ定量する場合には、対象とする(価数の)金属を分離する必要がある。
(1)蒸発濃縮
検水を加熱するなどして水分を蒸発させ、定量対象成分を濃縮する方法である。最も一般的な濃縮方法であるが、定量対象成分と同時に共存成分も濃縮される。その結果、妨害成分による干渉が著しくなったり、検水溶液の粘性が高くなって、噴霧状態で測定するフレーム原子吸光法などへの検水の注入量が減少し、感度が低下するなどの障害が生じるので注意する。
この濃縮法は、原則として酸性溶液について行うべきである。中性~アルカリ性検水では、多くの金属イオンは、保存容器・前処理器具容器・定量装置検水導入管などの器壁に不溶化・固着して、保存・操作中に損失して正確な定量ができない。
この濃縮法は長時間を要するので、操作環境からの汚染に十分に注意する。
この濃縮法は、原則として酸性溶液について行うべきである。中性~アルカリ性検水では、多くの金属イオンは、保存容器・前処理器具容器・定量装置検水導入管などの器壁に不溶化・固着して、保存・操作中に損失して正確な定量ができない。
この濃縮法は長時間を要するので、操作環境からの汚染に十分に注意する。
(2)共沈
濃度mg/Lレベルの微量成分を沈殿として捕集することは非常に困難である。この場合には、少量の類縁元素を加え、これを沈殿させるときに定量対象元素が同時に沈殿する方法が用いられる。また、単独では沈殿しない定量元素が、その成分が沈殿すると同時に沈殿する場合もある。このような現象を共沈という。
共沈操作を行うとき、添加元素をキャリャー(担体)といい、鉄(Ⅲ)、マンガン(Ⅲ)、銅などがよく用いられる。水酸化鉄(Ⅲ)、酸化マンガン(Ⅳ)、硫化銅の沈殿生成のときの共沈現象を利用している。
具体的には、ひ素・マンガンなどの分離濃縮やクロム(Ⅵ)とクロム(Ⅲ)の分離に、鉄(Ⅲ)塩が用いられている。
共沈操作を行うとき、添加元素をキャリャー(担体)といい、鉄(Ⅲ)、マンガン(Ⅲ)、銅などがよく用いられる。水酸化鉄(Ⅲ)、酸化マンガン(Ⅳ)、硫化銅の沈殿生成のときの共沈現象を利用している。
具体的には、ひ素・マンガンなどの分離濃縮やクロム(Ⅵ)とクロム(Ⅲ)の分離に、鉄(Ⅲ)塩が用いられている。
(3)気化
分析対象元素を気化しやすい化学種として分離する方法である。
検水を酸性として強い還元剤で、ひ素を水素化ひ素(Ⅲ)として気化させる方法、検水中の水銀の還元や水銀化合物の加熱分解よる水銀蒸気を発生させる定量法などに採用されている。
検水を酸性として強い還元剤で、ひ素を水素化ひ素(Ⅲ)として気化させる方法、検水中の水銀の還元や水銀化合物の加熱分解よる水銀蒸気を発生させる定量法などに採用されている。
(4)イオン交換
イオン交換樹脂を充填したカラムに試料を通して定量対象元素を交換吸着させるもので、微量成分の濃縮には長時間を要するが、有力な方法である。
金属成分を同時に濃縮するには、スルホン基を含む強陽イオン交換樹脂が用いられ、広いpH範囲で適用できる。
金属類を選択的に濃縮するためには、特殊な交換基を導入したキレート樹脂も用いられる。
金属イオンは塩酸溶液中でいろいろなクロロ錯体の陰イオンを形成している。これらは強塩基性陰イオン交換樹脂に吸着されるが、塩酸濃度によってその吸着挙動が大きく異なるので、この現象を利用して様々な分離が可能となる。
具体的な例として、検水中に多量の鉄・マンガンが含まれているときのカドミウムの選択的な分離・濃縮に用いられている。
金属成分を同時に濃縮するには、スルホン基を含む強陽イオン交換樹脂が用いられ、広いpH範囲で適用できる。
金属類を選択的に濃縮するためには、特殊な交換基を導入したキレート樹脂も用いられる。
金属イオンは塩酸溶液中でいろいろなクロロ錯体の陰イオンを形成している。これらは強塩基性陰イオン交換樹脂に吸着されるが、塩酸濃度によってその吸着挙動が大きく異なるので、この現象を利用して様々な分離が可能となる。
具体的な例として、検水中に多量の鉄・マンガンが含まれているときのカドミウムの選択的な分離・濃縮に用いられている。
(5)溶媒抽出
互いに混じり合わない2つの液相間の物質の分配を利用した分離濃縮法である。通常は、金属を金属キレート化合物あるいは分子会合錯体などの電荷のない形にして、定量対象元素に対して大きな分配係数を持ち、加えて水に不溶な溶媒に抽出する。吸光光度法、フレーム原子吸光法やICP発光分光分析法などの前処理として広く利用されている。
<分配比>
ある化学種が水相と溶媒相に分配されるとき、分配比Dは式(1)で示される。実用的には、式(2)で示す抽出率E(%)が便利である。
D = (溶媒相の全濃度)/(水相の全濃度) (1)
E = 100D/(D + Vw/Vs) (2)
Vw:水相の体積、Vs:溶媒相の体積
<分配比>
ある化学種が水相と溶媒相に分配されるとき、分配比Dは式(1)で示される。実用的には、式(2)で示す抽出率E(%)が便利である。
E = 100D/(D + Vw/Vs) (2)
Vw:水相の体積、Vs:溶媒相の体積
1)抽出試薬の選択
選択性、鋭敏さ、生成錯体の安定性などを考慮する。
2)溶媒の選定
溶媒は、定量対象成分の①分配比と②生成錯体の溶解度がいずれも大きく、③水相との密度差が大きいことに加え、④二液相の相互の溶解度がなるべく小さいことが要件である。
揮発性・粘性が低いこと、測定者の健康管理面では毒性が低いことも条件である。
フレーム原子吸光法では、燃焼時にすすを発生しないこと、また、ICP発光分光分析法では、ICPに導入したときプラズマが不安定にならないことである。一般に、常温での蒸気圧が低い溶媒を選ぶとプラズマが不安定にならない。
フレーム原子吸光法およびICP発光分光分析法などで、溶媒抽出に用いられる溶媒とその性質を表1に示す。ベンゼン、クロロホルム、2,2’-オキシビスプロパン(ジイソプロピルアルコール)はICP発光分光分析法への直接導入には適さない。
揮発性・粘性が低いこと、測定者の健康管理面では毒性が低いことも条件である。
フレーム原子吸光法では、燃焼時にすすを発生しないこと、また、ICP発光分光分析法では、ICPに導入したときプラズマが不安定にならないことである。一般に、常温での蒸気圧が低い溶媒を選ぶとプラズマが不安定にならない。
フレーム原子吸光法およびICP発光分光分析法などで、溶媒抽出に用いられる溶媒とその性質を表1に示す。ベンゼン、クロロホルム、2,2’-オキシビスプロパン(ジイソプロピルアルコール)はICP発光分光分析法への直接導入には適さない。
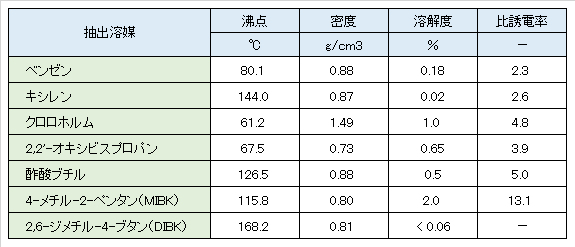
3)抽出条件の設定
安定な錯体生成には、水相を最適pHに調整し、酸化または還元操作によって、定量対象元素を適正な酸化数に設定する。また、pHがすぐに変化しないように緩衝液を加えることが多い。共存成分が抽出の妨害となるときには、マスキング剤を添加すると、その妨害を阻止できることがある。
4)逆抽出(ストリッピング)
定量対象成分を抽出した溶媒相を、適当な酸水溶液と振り混ぜて抽出されていた金属成分を酸水溶液に分配・抽出させる操作をいう。
5)溶媒抽出法の具体例
金属類の定量で多用される溶媒抽出法には、以下の2つの方法がある。
(a)ジエチルジチオカルバミド酸塩抽出法(DDTC抽出法)
<DDTC>
ジエチルジチオカルバミド酸(DDTC)ナトリウム(図1)は白い結晶性の化合物で、水によく溶ける。
DDTCは、約30の金属元素と反応して、安定な金属キレートを生成し、これらのキレート化合物は水に不溶となるが、酢酸ブチル、4-メチル-2-ペンタノン(メチルイソブチルケトン、MIBK)などの有機溶媒には可溶である。
生成する錯体の多くは無色であるが、銅(黄褐色)、ビスマス(黄)コバルト(緑)、ニッケル(黄緑)、鉄(褐色)などの有色の錯体もある。
JIS K 0102-2013では、銅の定量法の1つとしてジエチルジチオカルバミド酸吸光光度法が規定されている。検定方法においても、この溶媒抽出法はフレーム原子吸光光度法による銅、亜鉛、鉛、カドミウムなどの定量で、同時抽出法として、これらの金属元素の他成分からの分離・濃縮に採用されている。
<APDC>
DDTCは酸性で分解しやすく、多数の試料を取り扱う場合には不便である。そこで、低いpHでも使用できる試薬として1-ピロリジンカルボジチオ酸アンモニウム(ピロリジン-N-ジチオカルバミド酸アンモニウム、APDC)が広く用いられるようになっている。
この試薬は図1に示す構造式で、pH 2~3 以上の溶液に適用できる。この試薬による金属の同時抽出は、フレーム原子吸光光度法の前処理として検定方法にも採用されている。
<HMAHMDC>
さらに、APDCを改良した図1に構造式を示すヘキサメチレンアンモニウム-ヘキサメチレンカルバモジチオ酸(ヘキサメチレンアンモニウム-ヘキサメチレンジチオカルバミド、HMAHMDC)も開発され、これとAPDCとの併用による金属類の同時抽出がICP発光分光分析法の前処理として用いられている。この抽出法では、キシレンを抽出溶媒とすると、pH 5.4 付近で、30を超える元素の同時抽出が可能となる。
ジエチルジチオカルバミド酸(DDTC)ナトリウム(図1)は白い結晶性の化合物で、水によく溶ける。
DDTCは、約30の金属元素と反応して、安定な金属キレートを生成し、これらのキレート化合物は水に不溶となるが、酢酸ブチル、4-メチル-2-ペンタノン(メチルイソブチルケトン、MIBK)などの有機溶媒には可溶である。
生成する錯体の多くは無色であるが、銅(黄褐色)、ビスマス(黄)コバルト(緑)、ニッケル(黄緑)、鉄(褐色)などの有色の錯体もある。
JIS K 0102-2013では、銅の定量法の1つとしてジエチルジチオカルバミド酸吸光光度法が規定されている。検定方法においても、この溶媒抽出法はフレーム原子吸光光度法による銅、亜鉛、鉛、カドミウムなどの定量で、同時抽出法として、これらの金属元素の他成分からの分離・濃縮に採用されている。
<APDC>
DDTCは酸性で分解しやすく、多数の試料を取り扱う場合には不便である。そこで、低いpHでも使用できる試薬として1-ピロリジンカルボジチオ酸アンモニウム(ピロリジン-N-ジチオカルバミド酸アンモニウム、APDC)が広く用いられるようになっている。
この試薬は図1に示す構造式で、pH 2~3 以上の溶液に適用できる。この試薬による金属の同時抽出は、フレーム原子吸光光度法の前処理として検定方法にも採用されている。
<HMAHMDC>
さらに、APDCを改良した図1に構造式を示すヘキサメチレンアンモニウム-ヘキサメチレンカルバモジチオ酸(ヘキサメチレンアンモニウム-ヘキサメチレンジチオカルバミド、HMAHMDC)も開発され、これとAPDCとの併用による金属類の同時抽出がICP発光分光分析法の前処理として用いられている。この抽出法では、キシレンを抽出溶媒とすると、pH 5.4 付近で、30を超える元素の同時抽出が可能となる。
(b)ジチゾン抽出法
ジチゾン(DTZ)はジフェニルカルバゾンの略称で、図1で示す構造式を持つ黒紫食の固体である。水や酸には溶けないが、アルカリ溶液には溶ける。また、クロロホルムや四塩化炭素には可溶で、溶液は濃緑色を呈する。
亜鉛、鉛、カドミウムなどのジチゾン錯体は、有機溶媒中で濃い赤色を呈するので、ジチゾン抽出液はこれらの金属の吸光光度法やフレーム原子吸光法の前処理に用いられていた。
しかし、オゾン層の破壊を抑制するため、四塩化炭素の使用は厳しく制限され、これに伴ってジチドン-四塩化炭素抽出法はJIS K 0102から削除された。
金属類の定量でジチゾン用いる方法は、JIS K 0102において、ジチゾン-クロロホルム抽出法が電子加熱原子吸光法による水銀の定量に適用されている。
亜鉛、鉛、カドミウムなどのジチゾン錯体は、有機溶媒中で濃い赤色を呈するので、ジチゾン抽出液はこれらの金属の吸光光度法やフレーム原子吸光法の前処理に用いられていた。
しかし、オゾン層の破壊を抑制するため、四塩化炭素の使用は厳しく制限され、これに伴ってジチドン-四塩化炭素抽出法はJIS K 0102から削除された。
金属類の定量でジチゾン用いる方法は、JIS K 0102において、ジチゾン-クロロホルム抽出法が電子加熱原子吸光法による水銀の定量に適用されている。
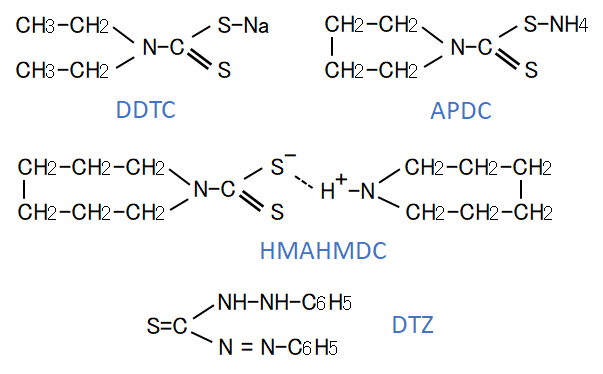
図1 溶媒抽出に用いられる抽出試薬(キレート)の事例
目次へ
参考文献
並木 博(編):詳細 工場排水試験方法 JIS K 0102-2013
産業環境管理協会:新・公害防止の技術と法規2016 水質編
掲載日:2018年12月07日
更新日:2018年12月09日(一部加筆)、2019年09月26日(ページタイトルを変更)
