pH titration curve and alkalinity
村上定瞭(水浄化フォーラム), Sadaaki Murakami (Water & Solutions Forum)
1.強塩基と強酸の中和
2.炭酸ナトリウムの中和と炭酸の解離定数
3.リン酸ナトリムの中和とリン酸の解離定数
4.留意事項ー酸解離定数の表記
5.pH-存在率の計算・作図
6.pH緩衝作用とアルカリ度
7.pHメーター使用上の注意事項
8.pH標準液
1. Neutralization of strong base and strong acid
2. Neutralization of sodium carbonate and dissociation constant of carbonic acid
3. Neutralization of sodium phosphate and dissociation constants of phosphoric acid
4. Notes-Notation of acid dissociation constant
5. Calculation and plotting of pH-abundance
6. pH buffering and alkalinity
7. Notes for using pH meter
8. pH standard solutions
1.強塩基と強酸の中和
強塩基を強酸で中和する例として、水酸化ナトリウムNaOHを塩酸HClで中和したときの添加量(当量比 a = [acid]/[base] で示している)とpHの関係を図1に示す。NaOHが全て中和された当量比 a = 1.0 において、急激なpH変化が認められる。
図1は、計算によって求めたもので、強酸性域(約pH4以下)・強塩基性域では実際の測定値と異なることに注意する。
1. Neutralization of strong base and strong acid
As an example of neutralizing a strong base with a strong acid, the relationship between the addition amount (indicated by the index of equivalent ratio a = [acid]/[base]) and pH when sodium hydroxide NaOH is neutralized with hydrochloric acid HCl is shown in Fig.1. A sharp pH change is observed at a = 1.0 where all the NaOH has been neutralized.
It should be noted that Fig.1 is obtained by calculation, and it differs from the actual measured value in the strongly acidic region (about pH 4 or less) and the strongly basic region (about pH 10 or more).
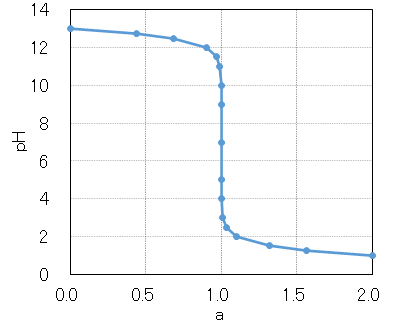
図1 0.1mol/L NaOHの0.1mol/L HCl滴定のpH曲線
Fig.1 pH curve of 0.1mol/L HCl titration of 0.1mol/L NaOH.
2.炭酸ナトリウムの中和と炭酸の解離定数
炭酸ナトリウムNa2CO3の水溶液を塩酸HClや硫酸H2SO4などの強酸で中和したときの、強酸の添加量 a と pH の関係を図2に示す。また、水に溶解した炭酸H2CO3について、その各解離種の存在率のpH依存性を図2に示す。
a = 0.5 では、CO32-が半分量ほど中和され、半分量のHCO3–が生成している。このときのpHの値がpKa1となる。a = 1.0 においては全てのCO32-が中和され、a = 1.0~2.0 においてHCO3–が中和されH2CO3が生成している。pKa1と同様に、pKa2 = [H+][HCO3–]/[H2CO3]の値も a = 1.5 におけるpHの値から求めることができる。
pKa2およびpKa1の値を用いて、図3に示す各pHにおける各解離種の存在率がわかる。逆に、pKa2およびpKa1の値から、図2に示す a と pH の関係を示す曲線を描くこともできる。
2. Neutralization of sodium carbonate and dissociation constant of carbonic acid
Fig.2 shows the relationship between the addition amount (indicated with the index a) and pH when an aqueous solution of sodium carbonate Na2CO3 is neutralized with a strong acid such as hydrochloric acid HCl or sulfuric acid H2SO4. Further, Fig.3 shows pH dependence of the existence rate of each dissociation species for carbonic acid H2CO3 which carbon dioxide CO2 is dissolved in wate.
At a = 0.5, about half of CO32− is neutralized and half of HCO3− is produced. The pH value at this a-value is pKa1. At a = 1.0, all CO32- is neutralized, and at a = 1.0 to 2.0, HCO3– is neutralized and H2CO3 is produced. In the same manner as pKa1, value pf pKa2 (= [H+] [HCO3–]/[H2CO3]) can also be obtained from pH values at a = 1.5.
The existence ratio of each dissociated species at each pH shown in Fig.3 can be drawn using the valuesof pKa2 and pKa1. Conversely, from the values of pKa2 and pKa1, it is also possible to draw a curve showing the relationship between a and pH shown in Fig.2.
[CO32-] = [HCO3–] (at a = 0.5) ⇨ pKa1 = pH (at a = 0.5)

図2 炭酸ナトリウム水溶液の酸滴定のpH曲線
Fig.2 pH curve of acid titration of aqueous sodium carbonate solution.
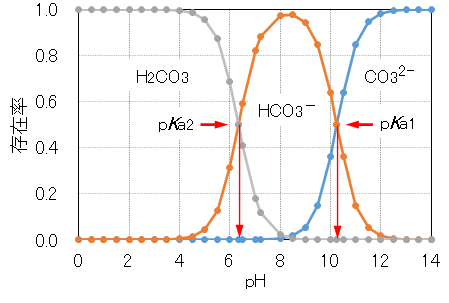
図3 各pHにおける炭酸の各解離種の存在率
Fig.3 Existence rate of each dissociated species of carbonic acid at each pH.
3.リン酸ナトリムの中和とリン酸の解離定数
炭酸ナトリウムで述べたように、リン酸ナトリムNa3PO4を強酸で中和すると、図4の中和曲線が得られる。これからKa1、Ka2およびKa3を求めることができる。また、各解離種のpH依存性を図5に示す。
目次へ
3. Neutralization of sodium phosphate and dissociation constants of phosphoric acid
As mentioned for sodium carbonate, for phosphate sodium Na3PO4 neutralization with a strong acid, the neutralization curves are obtained as shown in Fig.4. From this figure, Ka1, Ka2 and Ka3 can be obtained. The pH dependence of each dissociated species is shown in Fig.5.
To table of contents
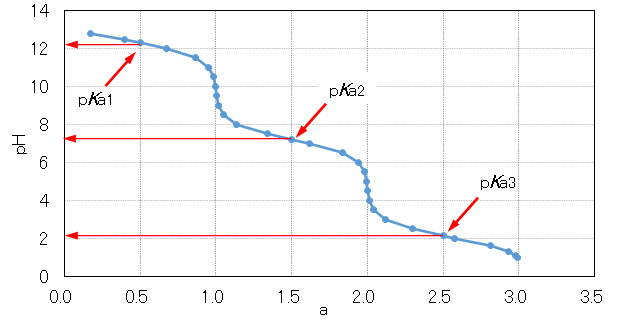
図4 リン酸ナトリウム水溶液の酸滴定のpH曲線
Fig.4 pH curve of acid titration of sodium phosphate solution.
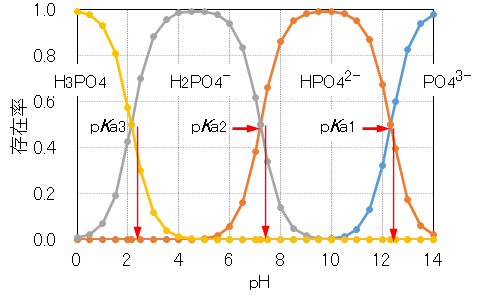
図5 各pHにおけるリン酸の各解離種の存在率
Fig.5 Existence rate of each dissociated species of phosphoric acid at each pH.
4.留意事項ー酸解離定数の表記
多塩基酸HnAの解離定数(Kaiまたはkai)は、慣例的に、下記の平衡式(A)または(B)に示すように定義される。以下、簡略化のため、定数の下付”a”は省略する。”Ki“(K:大文字)は酸の第 i 解離という正式な表記法である。”ki“(k:小文字)は利便性から利用されることが多い。
下記の平衡式(A)と(B)を比較して分かるように、”Ki“の利点は、”i”の数と解離種の電荷数が同じであるが、そのプロトン数が分かりにくい。一方で、”ki“の”i”は解離種のプロトン数に対応しているが、電荷数は分かりにくい。
本サイトでは、”Ki“と”ki“を区別せず、各ページの内容によって”Ki“または”ki“のいずれかを用いている。これは以下の理由による。
(1) 区別しなくても、定数の相対値から、いずれの表記法か簡単に推定できる。
(2) 内容の理解や図表の作成上、具体的に数値計算することが多く、プログラム作成上、利便性のよいkiを使っている。計算プログラムでは、平衡式を一般化する必要がある。平衡式(B)に示すように、プログラム作成において、解離種HiA(n-1)-のプロトン数”i”は重要となるが、電荷”(n-i)-“は省略している。電荷数は、計算結果の整理や図表の作成の段階で表示している。
(3) “ki“を使っているのに”Ki“で表示しているのは、kiで表示すると、Webページ上の文章や図表において、「小文字”k“では添字との判別が難しい」という編集・表示上の理由からである。また、”k“は速度定数やボルツマン定数などが混在するとき、”K“は平衡定数であることを明示する意味もある。
以上に述べたように、本サイトの各ページでの酸解離定数”K“または”k“の表記については、注意されたい。
4. Notes-Notation of acid dissociation constant
The dissociation constants (Kai or kai ) of the polybasic acid HnA are conventionally defined as shown in the following equilibrium equations (A) or (B). For simplification, the constant subscript “a” for “ai” is omitted. “Ki” (K: capital letter) is the formal notation of the i-th dissociation of acid. On the other hand, “ki” (k: small letter) is often available from the convenience.
As can be seen by comparing the following equilibrium equations (A) and (B), the advantage of “Ki” is that the number of “i” is equal to the number of charges of dissociated species, but the number of protons is difficult directly to understand. On the other hand, the number “i” of “ki” corresponds to the number of protons of dissociated species, but its charge number is not directly known.
This site makes no distinction between “Ki” and “ki “. Depending on the content of each page, either “Ki” or “k i” is used. This is for the following reason.
(1) It is possible to easily estimate which notation is used from the relative values of constants without making a distinction .
(2) In order to understand the contents and create charts, we often use specific numerical calculations, and we use ki, which is convenient for programming. In the calculation program, the equilibrium equation needs to be generalized. As shown in the equilibrium equation (B-i), the number, “i”, of protons of the dissociated species HiA(n-1)- is important in programming, but the charge “(n-i)-” is omitted. The number of charges is displayed at the stage of organizing the calculation results and preparing the chart.
(3) “Ki” is displayed even though “ki” is used for the actual calculation. This is because of the editing or displaying reason that it is difficult to distinguish a small letter “k” from a subscript in sentences and charts on Web pages. It also means that “K” is an equilibrium constant when the reaction rate constant and the Boltzmann constant are mixed and described.
As mentioned above, please be careful about the notation of the acid dissociation constant “K” or “k” on each page of this site.
Hn-1A– ⇆ H+ + Hn-2A2- K2 = [H+][Hn-2A2-]/[Hn-1A–] (A-2)
・・・・・・・・・・
Hn-iA– ⇆ H+ + Hn-i-1Ai- Ki = [H+][Hn-i-1Ai-]/[Hn-iAi-] (A-i)
・・・・・・・・・・
HA(n-1)- ⇄ H+ + An- Kn = [H+][An-]/[HA(n-1)-] (A-n)
HA(n-1)- ⇄ H+ + An- k1 = [H+][An-]/[HA(n-1)-] (B-1)
H2A(n-2)- ⇆ H+ + H2A(n-1)- k2 = [H+][H2A(n-1)-]/[H2A(n-2)-] (B-2)
・・・・・・・・・・
HiA(n-i)- ⇆ H+ + Hi-1A(n-i+1)- ki = [H+][Hi-1A(n-i+1)-]/[HiA(n-i)-] (B-i)
・・・・・・・・・・
HnA ⇄ H+ + Hn-1A– kn = [H+][H
5.pH-存在率の計算・作図
図3および図5に示すpH-酸解離種の存在率の関係図は、溶液中の化学平衡の理解や水浄化プロセスの設計・維持管理において重要な情報である。pH-存在率の計算・作図を自動的に行う xlsファイルを本サイト内に保存してあるので、ダウンロードして、適宜、他の多塩基酸のpki 値を該当枠に記入して活用されたい。
目次へ
5. Calculation and plotting of pH-abundance
The relationship diagrams of pH-abundance of dissociated acid species shown in Fis.3 and 5 are important information for understanding chemical equilibrium in a solution and for designing and maintaining a water purification process. Since the xls file that automatically calculates and plots the pH-abundance is stored on this web surver, you can download it and enter the pki values of other poly-basic acids in the appropriate boxes to utilize.
To table of contents
6.pH緩衝作用とアルカリ度
pH緩衝作用
炭酸ナトリウムのpH曲線(図2)では、pH10(pKa1=10.26)付近とpH6(pKa2=6.34)付近では酸添加量Δaに対するpH変化量ΔpHの割合ΔpH/Δaが小さい。炭酸水素ナトリウムを含む水は、これらのpH領域ではある範囲内で酸や塩基を加えても、pH変化は小さいことを意味し、これをpH緩衝作用という。
リン酸ナトリウム(図4)では、pH 12(pKa1=12.32)、pH 7(pKa2=7.21)付近およびpH 2(pKa3=2.13)付近にpH緩衝作用がある。
このように、強酸・弱塩基および弱酸・強塩基の塩はpH緩衝能力を有し、これらの塩を組合わせて所定pHの水溶液(pH標準液)を調整できる。
6. pH buffering and alkalinity
pH buffer action
In the pH curve of sodium carbonate (Fig.2), the ratio ΔpH/Δa (the pH change amount ΔpH to the acid addition amount Δa), is small near pH 10 (pKa1 = 10.26) and around pH 6 (pKa2 = 6.34). Water containing sodium hydrogencarbonate means that the pH change is small even if an acid or a base is added within a certain range in these pH regions, which is called a pH buffering action.
In sodium phosphate (Fig.4), pH 12 (pKa1 = 12.32), pH 7 (pKa2 = 7.21) and near pH 2 (pKa3 is pH buffering action in the vicinity of = 2.13).
Thus, the salts of strong acids / weak bases and weak acids / strong bases have pH buffering ability, and these salts can be combined to prepare an aqueous solution (pH standard solution) of a predetermined pH.
天然水や産業排水は様々なpH緩衝能をもつ物質を含んでいる。これらの物質は炭酸塩、炭酸水素塩および水酸化物が主なものであるが、その他に、アンモニア、ホウ酸塩、リン酸塩、ケイ酸塩および有機酸塩などがある。
これらの物質量(濃度)を示す指標としてアルカリ度がある。アルカリ度はこれらの物質の中和に必要な強酸量を測定し、この強酸量に等しい当量の炭酸カルシウムCaCO3量(濃度)で表す。
アルカリ度にはPアルカリ度と総アルカリ度があり、前者はpH 8.3(指示薬:フェノールフタレイン)まで中和に要する強酸量、後者はpH 4.5(ブロモクレゾールグリーン・メチルレッド混合液)まで中和に要する強酸量である。pH 8.3は炭酸ナトリウムが全量中和されるpH((pKa1+pKa2)/2=8.3)、pH 4.5は炭酸水素ナトリムの全量が中和されるpHに対応する(図2)。
目次へ
Natural water and industrial wastewater contain substances with various pH buffering capacities. These substances are mainly carbonates, hydrogen carbonates and hydroxides, but also ammonia, borates, phosphates, silicates and organic acid salts.
Alkalinity is an index indicating the amount (concentration) of pH buffering substances. The alkalinity is determined by measuring the amount of strong acid required for neutralizing these substances, and is expressed by the amount (concentration) of CaCO3 equivalent to the amount of strong acid.
The alkalinity includes P alkalinity and total alkalinity. The former is a strong acid amount required for neutralization up to pH 8.3 (indicator: phenolphthalein), the latter up to pH 4.5 (indicator: mixed solution of bromocresol green and methyl red). It is the amount of strong acid required for neutralization. pH 8.3 corresponds to the pH at which the total amount of sodium carbonate is neutralized [(pKa1 + pKa2) /2 = 8.3], and pH 4.5 corresponds to the pH at which the total amount of sodium hydrogen carbonate is neutralized (Fig.2).
To table of contents
7.pHメーター使用上の注意事項
pH測定には、センサーとして一般的にガラス電極が用いられている。pH測定の原理は、ガラス膜の内側(標準液、pH7に近い値)と外側(測定液)での水素イオン濃度差により発生する電位差(膜電位)を検出・増幅し、pH値に変換・表示している。主な注意事項を下記に示すが、専門書を参考にするとよい。
■ 弱酸性~弱アルカリ性の範囲では、膜電位と測定液pHには比例関係が認められるが、強酸性域(pH約4以下)や強塩基性域(pH約10以上)になると発生する膜電位は理論値よりも小さくなっていく。この結果、測定pHの値は実際の値よりも、強酸性域では高く、強塩基性域では低くなる。
■ 測定液中の電解質濃度が低いと、測定電位が不安定となる。環境水には電解質が含まれており特に問題は認められないが、特定事業所での純水を用いる工程排水のpH測定では、塩化カリウムなどの強電解質(0.1~1mol/L)を添加する。
■ ガラス膜は電気抵抗(300~500MΩ)が極めて大きいので、測定電位差(pH)が安定するまである程度の時間を要する。
■ pHメーターでは、膜に発生する電位差を検出・pH変換して表示するので、定期的な較正が欠かせない。較正液も変質するので、適正に保存・更新する。
■ 自動計測を行う際には、測定電極にスケールや生物膜などが付着すると正常な測定ができない。定期的に電極を洗浄する。
7. Notes for using pH meter
A glass electrode is generally used as a sensor for pH measurement. The principle of pH measurement is to detect and amplify the potential difference (membrane potential) generated by the hydrogen ion concentration difference inside the glass membrane (standard solution, value close to pH 7) and outside (measurement solution), and convert it to pH value. The main notes are shown below,when using a pH meter, but it is recommended to refer to the technological books.
■ In the weakly acidic to weakly alkaline range, there is a proportional relationship between the membrane potential and the pH of the measurement solution, but the relationship is not observed when it is in the strongly acidic range (pH about 4 or less) or the strongly basic range (pH about 10 or more). The electric potential becomes smaller than the theoretical value. As a result, the measured pH value is higher in the strongly acidic region and lower than the actual value in the strongly basic region.
■ If the electrolyte concentration in the measurement solution is low, the measurement potential becomes unstable. Environmental water contains electrolytes and no particular problems are observed. However, when measuring pH of process water using pure water at a manufacturing plant, add a strong electrolyte (0.1 to 1 mol/L) such as potassium chloride.
■ Since the electric resistance (300 to 500 MΩ) of the glass film is extremely large, it takes some time for the measured potential difference (pH) to stabilize.
■ The pH meter detects the potential difference generated through the membrane and converts it into a pH value for display, so regular calibration is essential. The calibration solution will also deteriorate, so save and update it properly.
■ When performing automatic measurement, normal measurement cannot be performed if a scale or biofilm adheres to the measurement electrode. Clean the electrodes regularly.
8.pH標準液
下記に標準液pH、標準液名および組成濃度を示す。
pH 2(pH 1.68 at 25℃)-シュウ酸塩標準液-0.05mol/kg 二しゅう酸三水素カリウム水溶液
pH 4(pH 4.01 at 25℃)-フタル酸塩標準液-0.05mol/kg フタル酸水素カリウム水溶液
pH 7(pH 6.86 at 25℃)-中性リン酸塩標準液-0.025mol/kg りん酸二水素カリウム + 0.025mol/kg-りん酸水素二ナトリウム水溶液
pH 9(pH 9.18 at 25℃)-ホウ酸塩標準液-0・01mol/kg 四ほう酸ナトリウム(ほう砂)水溶液
pH 10(pH 10.02 at 25℃)-炭酸塩標準液-0・025mol/kg 炭酸水素ナトリウム+0・025mol/kg 炭酸ナトリウム水溶液
目次へ
掲載日:2016年07月19日
更新日:2019年05月10日 H2CO3:pKa1 ⇄ pKa2、H3PO4:pKa1 ⇄ pKa3、にそれぞれ変更した(説明)。
8. pH standard solutions
The pH standard solutions, and their names and composition concentrations are shown below.
pH 2 (pH 1.68 at 25°C): oxalate standard solution-0.05mol/kg potassium trihydrogen dioxalate aqueous solution
pH 4 (pH 4.01 at 25°C): phthalate standard solution-0.05mol/kg potassium hydrogen phosphate aqueous solution
pH 7 (pH 6.86 at 25°C): neutral phosphate standard solution-0.025mol/kg potassium dihydrogen phosphate + 0.025mol/kg-disodium hydrogen phosphate aqueous solution
pH 9 (pH 9.18 at 25 ℃): borate standard solution-0.01mol/kg sodium tetraborate (borax) aqueous solution
pH 10 (pH 10.02 at 25 ℃): carbonate standard solution-0.025mol/kg
sodium hydrogen carbonate + 0.025mol/kg sodium carbonate aqueous solution
To table of contents
Posted: May 27, 2020
